Alachlor – Wikipedia
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Alachlor | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C14H20ClNO2 | ||||||||||||||||||
| Kurzbeschreibung | farbloses bis graues, brennbares, schwach süßlich riechendes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 269,77 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Dichte | 1,13 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | sehr schlecht in Wasser (212 mg·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Alachlor ist eine organisch-chemische Verbindung aus der Gruppe der Carbonsäureamide und Acetanilide. Es gehört zur Herbizidgruppe der Chloracetamide und liegt in Form eines farblosen, schwach süßlich riechenden Pulvers vor.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Als selektives Vorauflaufherbizid wurde Alachlor 1965 von Monsanto (heute Bayer AG) unter dem Namen Lasso auf den Markt gebracht.[4]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Die kommerzielle Synthese von Alachlor erfolgt zunächst durch Reaktion von 2,6-Diethylanilin (1) mit Formaldehyd (2), wobei in einer Kondensationsreaktion das entsprechende Imin (3) gebildet wird. Dieses reagiert anschließend mit Chloressigsäurechlorid (4) zum N-Chloracetylierten Zwischenprodukt (5), welches schließlich mit Methanol in Gegenwart von Ammoniak (oder Triethylamin) unter Abspaltung von Salzsäure zum Alachlor (6) umgesetzt wird.[5]

Im letzten Reaktionsschritt wird die freiwerdende Salzsäure von dem zugegebenen Ammoniak zum Ammoniumchlorid neutralisiert.
Verwendung
[Bearbeiten | Quelltext bearbeiten]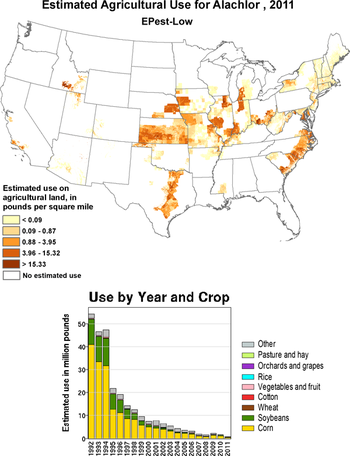
Alachlor wurde als selektives Vorlaufherbizid gegen Ungräser im Kohl-, Mais-, Erdnuss-, Sojabohnen-, Baumwoll-, Raps- und Sonnenblumenanbau verwendet.[6] Es wurde dabei häufig mit anderen Herbiziden wie Atrazin, Glyphosat, Trifluralin oder Imazaquin gemischt.
Zulassung
[Bearbeiten | Quelltext bearbeiten]Die EU-Kommission entschied 2006, Alachlor nicht in die Liste der in der Europäischen Union zugelassenen Pflanzenschutzmittel-Wirkstoffe aufzunehmen.[7] In Deutschland und Österreich ist daher kein Pflanzenschutzmittel mit diesem Wirkstoff zugelassen. In der Schweiz waren einige Pflanzenschutzmittel mit Alachlor im Ackerbau zugelassen, die Bewilligungen wurden allerdings mittlerweile beendet. Alachlorhaltige Präparate durften dort bis September 2011 noch verkauft werden, nach dem 15. September 2012 dürfen sie nicht mehr verwendet werden.[8]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Alachlor ist nur schwach giftig, wird aber als potentiell krebserregend eingestuft.[2] Es wirkt besonders giftig bei Algen, Kleinkrebsen und Fischen.[6]
Da es beim Einsatz in die Nutzpflanzen und über Niederschläge in das Grundwasser eindringen kann, wurden (und werden, da es in anderen Ländern noch verwendet wird) Rückstände in Lebensmitteln gefunden. In Deutschland dürfen laut Rückstands-Höchstmengenverordnung (RHmV) Raps- und Rübensamen 0,1 mg/kg, Tee und teeähnliche Erzeugnisse 0,05 mg/kg und andere pflanzliche Lebensmittel 0,2 mg/kg maximal enthalten.[6] Das Europäische Arzneibuch legt als Grenzwert für Alachlor-Rückstände in pflanzlichen Drogen 0,05 mg·kg−1 fest.[9]
Nachweis
[Bearbeiten | Quelltext bearbeiten]Alachlor lässt sich durch Festphasenextraktion und anschließende GC/ECD-Analytik bis zu einer Nachweisgrenze von 0,025 µg/l nachweisen.[6] Für zuverlässige qualitative und quantitative Bestimmungen werden heute die Kopplungsverfahren zwischen HPLC, Gaschromatographie und Massenspektrometrie nach geeigneter Probenvorbereitung eingesetzt.[10][11]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i Eintrag zu Alachlor in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b c WHO/FAO Data Sheet on Pesticides (PDS) für Alachlor, abgerufen am 9. Dezember 2014.
- ↑ Eintrag zu Alachlor im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag zu Alachlor. In: Römpp Online. Georg Thieme Verlag, abgerufen am 21. Januar 2021.
- ↑ Thomas A. Unger: Pesticide Synthesis Handbook. William Andrew, 1996, ISBN 0-8155-1853-6, S. 8 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d Emissionsminderung für prioritäre und prioritäre gefährliche Stoffe der Wasserrahmenrichtlinie – Stoffdatenblätter – Datenblatt Alachlor. (PDF; 3,5 MB) Texte 29/07, Umweltforschungsplan des Bundesministers für Umwelt, Naturschutz und Reaktorsicherheit, S. 5 ff.
- ↑ Entscheidung der Kommission vom 18. Dezember 2006 über die Nichtaufnahme von Alachlor in Anhang I der Richtlinie 91/414/EWG … (PDF)
- ↑ Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Alachlor in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 11. März 2016.
- ↑ Europäisches Arzneibuch 10.0. Deutscher Apotheker Verlag, 2020, ISBN 978-3-7692-7515-5, S. 432.
- ↑ R. Loos, S. Tavazzi, B. Paracchini, E. Canuti, C. Weissteiner: Analysis of polar organic contaminants in surface water of the northern Adriatic Sea by solid-phase extraction followed by ultrahigh-pressure liquid chromatography-QTRAP® MS using a hybrid triple-quadrupole linear ion trap instrument. In: Anal Bioanal Chem., Band 405, Nr. 18, Jul 2013, S. 5875–5885. PMID 23657443.
- ↑ Evangelia Terzopoulou, Dimitra Voutsa, George Kaklamanos: A multi-residue method for determination of 70 organic micropollutants in surface waters by solid-phase extraction followed by gas chromatography coupled to tandem mass spectrometry. In: Environ Sci Pollut Res Int., Band 22, Nr. 2, Jan 2015, S. 1095–1112. PMID 25109470.


 French
French Deutsch
Deutsch

