Azacitidin – Wikipedia
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Azacitidin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H12N4O5 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 244,21 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Azacitidin (INN), chemisch 5-Azacytidin (5-azaC) (Handelsname: Vidaza, Hersteller: Celgene) ist ein synthetisches Nukleosid. Es besteht aus der β-D-Ribofuranose (Zucker) und einem substituierten Triazin. Es ist ein chemisches Analogon des Nukleosids Cytidin. Die zytostatisch wirkende Substanz wird als Arzneistoff in der Chemotherapie von bösartigen Erkrankungen des blutbildenden Systems verwendet. Sie verhindert das Wachstum von Krebszellen. 5-Azacytidin wird aus Streptoverticillium ladakanus isoliert und zeigt auch eine schwache antibiotische Aktivität.[1]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Das 5-Azacytidin unterscheidet sich chemisch vom Cytidin, indem in der 5-Position eine C-H-Einheit formal durch ein Stickstoffatom ersetzt wird. Aus dem Pyrimidingrundgerüst wird somit ein 1,3,5-Triazingrundgerüst. Das Analogon mit Desoxyribose ist das Decitabin.
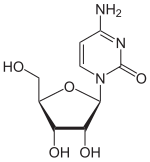 |  |  |
| Cytidin, C | 5-Azacytidin, 5-azaC | Decitabin |
Wirkung
[Bearbeiten | Quelltext bearbeiten]Wenn 5-Azacytidin in der Zelle vorhanden ist, wird es während der Replikation in die DNA und während der Transkription in die RNA eingebaut. Dieser Einbau von 5-Azacytidin in DNA und RNA hemmt DNA-Methyltransferasen bzw. RNA-Methyltransferasen und verursacht dadurch eine Demethylierung in jener Sequenz. Damit werden die Proteine der Zellregulation beeinflusst, die an das DNA/RNA-Substrat binden können.
Klinische Angaben
[Bearbeiten | Quelltext bearbeiten]Anwendungsgebiete (Indikationen)
[Bearbeiten | Quelltext bearbeiten]Azacitidin ist angezeigt zur Behandlung von erwachsenen Patienten, die für eine Transplantation hämatopoetischer Stammzellen (Stammzelltransplantation) nicht geeignet sind und eines der folgenden Krankheitsbilder aufweisen:
- myelodysplastische Syndrome (MDS) mit intermediärem Risiko 2 oder hohem Risiko nach International Prognostic Scoring System (IPSS),
- chronische myelomonozytäre Leukämie (CMML) mit 10–29 % Knochenmarkblasten ohne myeloproliferative Störung,
- akute myeloische Leukämie (AML) mit 20–30 % Blasten und Mehrlinien-Dysplasie gemäß Klassifikation der World Health Organisation (WHO).[4]
Art und Dauer der Anwendung
[Bearbeiten | Quelltext bearbeiten]Die Behandlung mit Azacitidin sollte unter Aufsicht eines Arztes eingeleitet und überwacht werden, der über Erfahrung in der Anwendung chemotherapeutischer Arzneimittel verfügt. Die Patienten sollten eine Prämedikation mit Antiemetika gegen Übelkeit und Erbrechen erhalten.[4] Azacitidin ist ein Pulver zur Herstellung einer Injektionssuspension.
Unerwünschte Wirkungen (Nebenwirkungen)
[Bearbeiten | Quelltext bearbeiten]Die am häufigsten berichteten Nebenwirkungen einer Behandlung mit Azacitidin bestanden in hämatologischen Reaktionen (71,4 %) einschließlich Thrombozytopenie, Neutropenie und Leukopenie (in der Regel Grad 3–4), gastrointestinale Ereignissen (60,6 %) einschließlich Übelkeit, Erbrechen (in der Regel Grad 1–2) sowie Reaktionen an der Injektionsstelle (77,1 %; in der Regel Grad 1–2).[4] Außerdem Angstzustände, Verwirrtheit, Schlaflosigkeit.
Sonstige Informationen
[Bearbeiten | Quelltext bearbeiten]Orphan Drug
[Bearbeiten | Quelltext bearbeiten]Bereits 2004 erhielt Azacitidin von der Food and Drug Administration (FDA) den Status als Orphan Drug zuerkannt.[5] Der Begriff wird für Arzneimittel verwendet, die zur Behandlung sehr seltener Krankheiten eingesetzt werden.
Geschichtliches (Zulassung)
[Bearbeiten | Quelltext bearbeiten]2004 wurde Vidaza von der FDA für den US-amerikanischen Markt zugelassen.[5] Die Europäische Arzneimittel-Agentur (EMA) erteilte für Azacitidin die Zulassung für den europäischen Markt im Dezember 2008.[6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu 5-Azacytidin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- ↑ a b Datenblatt Azacitidin bei Sigma-Aldrich, abgerufen am 29. Mai 2022 (PDF).
- ↑ Eintrag zu Azacitidine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b c Fachinformation Vidaza ( vom 21. September 2011 im Internet Archive) (PDF; 244 kB).
- ↑ a b Pressemeldung der FDA auf der Website der Food and Drug Administration (FDA).
- ↑ Öffentlicher Beurteilungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) zu: Vidaza.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Eintrag zu Azacitidine in der Human Metabolome Database (HMDB), abgerufen am 7. November 2013.
- Orphan-Drug-Liste des Verbands Forschender Arzneimittelhersteller


 French
French Deutsch
Deutsch