Blei(IV)-acetat – Wikipedia
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
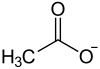 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Blei(IV)-acetat | |||||||||||||||
| Andere Namen | Bleitetraacetat | |||||||||||||||
| Summenformel | C8H12O8Pb | |||||||||||||||
| Kurzbeschreibung | farbloser bis rosafarbener Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 443,37 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 2,23 g·cm−3 (17 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Blei(IV)-acetat bildet farblose bis blass rosafarbene, monokline Kristalle. Es ist das Bleisalz der Essigsäure in der Oxidationsstufe +IV. Es stellt ein starkes Oxidationsmittel dar.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Blei(IV)-acetat wird normalerweise durch Reaktion von Blei(II,IV)-oxid („Mennige“) mit heißem Eisessig[4] beziehungsweise einem Gemisch aus Eisessig und Acetanhydrid hergestellt, wobei letzteres zum Abfangen des entstehenden Wassers dient.[5][6] Wird elementares Chlor in eine Lösung von Blei(II)-acetat in Essigsäure eingeleitet, entsteht ebenfalls zum Teil Blei(IV)-acetat.[6]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Blei(IV)-acetat tritt in Form farbloser bis blass rosafarbener, monokliner Kristalle auf. Es ist löslich in Chloroform und heißer Essigsäure. In kaltem Wasser oder in Ethanol zersetzt es sich. Es wirkt als Oxidationsmittel.[4]
Reaktionen und Verwendung
[Bearbeiten | Quelltext bearbeiten]Blei(IV)-acetat wird in der organischen Synthese of für die Glycolspaltung sowie zur Spaltung von α-Hydroxysäuren wie Oxalsäure genutzt.[4] Es kann Aldoxime zu Nitriloxiden oxidieren.[7] Die Oxidation von Hydrazonen mit Blei(IV)-acetat ergibt Diazoverbindungen.[8] Verbindungen, die durch die Oxidation mit Blei(IV)-acetat hergestellt werden können, sind beispielsweise Lactone aus Alkoholen unter Kohlenstoffmonoxid-Atmosphäre. So ergibt die Oxidation von 4-Heptanol als Produkt Octano-1,5-lacton.[9]
Blei(IV)-acetat eignet sich außerdem als Edukt zur Herstellung von Tetraalkylblei-Verbindungen. So ergibt die Reaktion mit Methylmagnesiumchlorid als Produkt Tetramethylblei und mit Ethylmagnesiumchlorid als Produkt Tetraethylblei.[10]
Die Kochi-Reaktion dient der Decarboxylierung/Chlorierung von Carbonsäuren mit Blei(IV)-acetat und Lithiumchlorid.[11] Weiterhin eignet sich Blei(IV)-acetat zur Einführung von Acetoxygruppen in Moleküle.[4] Beispielsweise entsteht bei der Reaktion von Cyclohexen mit Blei(IV)-acetat 2-Cyclohexenylacetat und 1,2-Cyclohexylendiacetat[12] und bei der Reaktion von 4-Methylanisol das Anisylacetat.[13]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Eintrag zu Bleiacetate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. Oktober 2014.
- ↑ a b Datenblatt Blei(IV)-acetat bei Sigma-Aldrich, abgerufen am 13. März 2011 (PDF).
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag lead compounds with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b c d Ullmann's Encyclopedia of Industrial Chemistry. 1. Auflage. Wiley, 2003, ISBN 978-3-527-30385-4, doi:10.1002/14356007.a15_249 (wiley.com [abgerufen am 16. September 2024]).
- ↑ Organikum, 16. Auflage, VEB Deutscher Verlag der Wissenschaften, Berlin 1986, S. 642.
- ↑ a b Ralph E. Oesper, Clara L. Deasy: The Preparation of Lead Tetraacetate. In: Journal of the American Chemical Society. Band 61, Nr. 4, April 1939, S. 972–973, doi:10.1021/ja01873a510.
- ↑ G. Just, K. Dahl: Lead tetraacetate oxidation of aldoximes. In: Tetrahedron. Band 24, Nr. 15, Januar 1968, S. 5251–5269, doi:10.1016/S0040-4020(01)96322-7.
- ↑ Terrence L. Holton, Harold Schechter: Advantageous Syntheses of Diazo Compounds by Oxidation of Hydrazones with Lead Tetraacetate in Basic Environments. In: The Journal of Organic Chemistry. Band 60, Nr. 15, Juli 1995, S. 4725–4729, doi:10.1021/jo00120a013.
- ↑ Shinji Tsunoi, Ilhyong Ryu, Noboru Sonoda: Remote Carbonylation. The Synthesis of .delta.-Lactones from Saturated Alcohols and Carbon Monoxide. In: Journal of the American Chemical Society. Band 116, Nr. 12, Juni 1994, S. 5473–5474, doi:10.1021/ja00091a063.
- ↑ Kenneth Charles Williams: Synthesis of organolead compounds from lead tetraacetate. In: The Journal of Organic Chemistry. Band 32, Nr. 12, Dezember 1967, S. 4062–4063, doi:10.1021/jo01287a079.
- ↑ Thomas Laue, Andreas Plagens: Named Organic Reactions. John Wiley & Sons, 2005, ISBN 978-0-470-02644-1, S. 169.
- ↑ Charles D. Hurd, O. E. Edwards: THE ACTION OF LEAD TETRAACETATE ON DIHYDROPYRAN. In: The Journal of Organic Chemistry. Band 19, Nr. 8, August 1954, S. 1319–1324, doi:10.1021/jo01373a015.
- ↑ Peter J. Andrulis, Michael J. S. Dewar, R. Dietz, Richard L. Hunt: Aromatic Oxidation by Electron Transfer. I. Oxidations of p-Methoxytoluene. In: Journal of the American Chemical Society. Band 88, Nr. 23, Dezember 1966, S. 5473–5478, doi:10.1021/ja00975a020.


 French
French Deutsch
Deutsch
![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{4}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/497e0f8548c953ccfb88df25aeee20c689569abf)


