Häme (Stoffgruppe) – Wikipedia

Häme (von altgriechisch αἷμα haima ‚Blut‘) sind Komplexverbindungen mit einem Eisen-Ion als Zentralatom und einem Porphyrin-Molekül als Ligand. Der bekannteste Vertreter ist das Fe-Protoporphyrin IX, auch Häm b oder einfach Häm genannt. Häme finden sich als prosthetische Gruppe in verschiedenen Gruppen von Proteinen, unter anderem den Globinen und den Cytochromen.
Das für die Stoffgruppe namensgebende Häm b ist als eisenhaltiger Farbstoff in roten Blutkörperchen enthalten. Eingebaut in das Protein von Globin-Ketten bildet es Hämoglobin, das in den Erythrozyten für die Sauerstoffaufnahme des Körpers eine zentrale Rolle spielt. Andere Häme als Häm b sind in Bakterien und Pflanzen anzutreffen.
Mitglieder
[Bearbeiten | Quelltext bearbeiten]Häme sind eisenhaltige Porphyrinkomplexe. Die Häme im engeren Sinn unterscheiden sich zunächst in den funktionellen Gruppen, die an das Porphyringerüst gebunden sind.
| Name | Grundstruktur | R3 | R8 | R18 | Vorkommen |
|---|---|---|---|---|---|
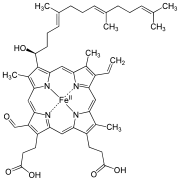
| Häm a |  | Hydroxyfarnesyl | –CH=CH2 | –CH=O | Cytochrom-c-Oxidase |
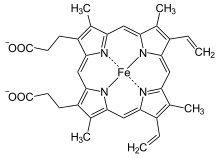
| Häm b | –CH=CH2 | –CH=CH2 | –CH3 | Hämoglobin, Myoglobin, Katalase, Succinat-Dehydrogenase, Cytochrom-c-Reduktase, Cyclooxygenase, Cytochrom P450 | |
| Häm c | –CH(CH3)SH | –CH(CH3)SH | –CH3 | Cytochrom c, Cytochrom cd1 | |
| Häm o | Hydroxyfarnesyl | –CH=CH2 | –CH3 | (Zwischenprodukt) | |
| Häm s | –CHO | –CH=CH2 | –CH3 | Chlorocruorin[1] |
Während Häm c kovalent an die Thiolgruppen von Cysteinresten im Protein gebunden ist, ist dies bei Häm a und b auf nicht-kovalente Weise der Fall. Ansonsten unterscheiden sich Häm b und c nicht. Durch Austauschen von bestimmten Aminosäuren mit Cystein im gebundenen Protein können b/c-Mischformen erzeugt werden, die unterschiedliche Eigenschaften haben.
Weitere zu den Hämen zählende Verbindungen sind
- Häm d,
- Häm d1, die prosthetische Gruppe von Cytochrom cd1, einer bakteriellen Nitritreduktase (EC 1.7.2.1)
- Häm-P460, die prosthetische Gruppe der Hydroxylamin-Oxidoreduktase in Nitrosomonas europaea (EC 1.7.3.4)
- Sirohäm, die prosthetische Gruppe der Ferredoxin-Nitritreduktase in Pflanzen, Algen und Cyanobakterien (EC 1.7.7.1), sowie der bakteriellen und pflanzlichen Sulfitreduktasen (EC 1.8.1.2 und EC 1.8.7.1)
- Strukturformel von Häm a
- Strukturformel von Häm b
- Strukturformel von Häm c
- Strukturformel von Häm d
- Strukturformel von Häm d1
- Strukturformel von Häm o
- Strukturformel von Häm P460
- Strukturformel des Sirohäms
Physiologie
[Bearbeiten | Quelltext bearbeiten]Häme werden in Lebewesen aus den Porphyrinen synthetisiert. Die Abbauwege führen dagegen über Biliverdin und Bilirubin zu nicht weiter abbaubaren Tetrapyrrolen, den Gallenfarbstoffen, die ausgeschieden werden.
Biosynthese
[Bearbeiten | Quelltext bearbeiten]Im menschlichen Körper geht die Biosynthese aller Porphyrine von Succinyl-CoA und der Aminosäure Glycin aus. Der erste und gleichzeitig geschwindigkeitsbestimmende Schritt wird katalysiert durch das Enzym δ-Aminolävulinatsynthase und führt zum δ-Aminolävulinat. Pflanzen, Algen, Bakterien (mit Ausnahme der Alphaproteobacterien) sowie Archaebakterien können δ-Aminolävulinat auch ausgehend von Glutaminsäure herstellen, was als C5- bzw. Beale-Weg bezeichnet wird. Je zwei δ-Aminolävulinat-Moleküle werden zum Porphobilinogen kondensiert, vier dieser Moleküle werden darauffolgend zu Hydroxymethylbilan umgesetzt. Weitere Umwandlungen erfolgen schrittweise über Uroporphyrinogen III und Coproporphyrinogen III zu Protoporphyrinogen IX und Protoporphyrin IX.
Häm b entsteht durch Einbau von zweiwertigem Eisen in Protoporphyrin IX mithilfe des Enzyms Ferrochelatase.
Häm a als Bestandteil der Cytochrom c-Oxidase wird beim Menschen in zwei Schritten aus Häm b erzeugt. Mittels der mitochondriellen Protohäm-IX-Farnesyltransferase (COX10) entsteht zunächst Häm o, das mittels eines weiteren Enzyms namens COX15 an der 18-Position hydroxyliert wird; als Cofaktoren sind Ferredoxin und die entsprechende Ferredoxin-Reduktase notwendig. Der letzte Schritt der Umwandlung zum Aldehyd wird von einem im Mensch unbekannten Enzym katalysiert, das in Bacillus subtilis als das Genprodukt des ctaA-Gens identifiziert wurde.[2][3][4][5]
Abbau und Ausscheidung
[Bearbeiten | Quelltext bearbeiten]Das Eisenion kann oxidieren, wodurch Hämatin entsteht, z. B. im Methämoglobin oder im Methämalbumin.
Die Abbauprodukte des Häms heißen Gallenfarbstoffe. Die Hämooxygenase wandelt das rote Häm noch im Blut unter Sprengung des Porphyrinrings und unter Eisen- und Kohlenmonoxidabspaltung zum grünen Biliverdin um. Galle besitzt eine typische gelbliche bis grünliche Färbung, abhängig vom wechselnden Gehalt an Biliverdin und orange-rotem Bilirubin; letzteres wird von der Biliverdin-Reduktase durch Reduktion aus Biliverdin hergestellt. Ausgeschieden werden die Gallenfarbstoffe vorwiegend mit dem Urin (als gelbe bis orange Urochrome Sterkobilin, Urobilinogen und Urobilin) bzw. mit dem Kot (als Koprochrome ebenfalls Sterkobilin, Bilifuscin und Mesobilifuscin).

Auch weitere Abbauprodukte des Bilirubins wie das farblose Sterkobilinogen (das durch Darmbakterien zu den braunen Dipyrrolen Mesobilifuchsin und Bilifuchsin umgesetzt wird) tragen zur normalen Stuhlfarbe bei. Teilweise werden Bilirubinabbauprodukte wieder resorbiert und mit dem Urin ausgeschieden.
Pathologie
[Bearbeiten | Quelltext bearbeiten]Jedes der bei der Biosynthese und beim Abbau beteiligten Enzyme kann einen Defekt aufweisen, was zu jeweils einer typischen erblichen (seltenen) Stoffwechselstörung führt. Die bei der Porphyrinbiosynthese auftretenden Defekte wie auch der Ferrochelatase-Mangel werden unter dem Namen Porphyrie zusammengefasst. Defekte bei der Häm-a-Synthese, also COX-10- und COX-15-Mangel führen dagegen zum Leigh-Syndrom.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]- Hämine
- Hämatine
- Chlorophyll, darin ist das Eisen-Ion des Häms durch ein Magnesium-Ion ersetzt.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Ivano Bertini: Biological inorganic chemistry: structure and reactivity University Science Books, 2007, ISBN 978-1-891389-43-6.
- P. M. Jordan: Highlights in haem biosynthesis. In: Curr. Opin. Struct. Biol. Bd. 4, 1994, S. 902–911. PMID 7712294.
- H. Panek, M. R. O’Brian: A whole genome view of prokaryotic haem biosynthesis. In: Microbiology. Bd. 148, 2002, S. 2273–2282. PMID 12177321.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 5. Auflage. Spektrum Akademischer Verlag, Heidelberg 2003, ISBN 3-8274-1303-6.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Heme and Porphyrin Metabolism (engl.)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ A. Pallavicini, E. Negrisolo, R. Barbato u. a.: The primary structure of globin and linker chains from the chlorocruorin of the polychaete Sabella spallanzanii. In: J. Biol. Chem. Band 276, Nr. 28, Juli 2001, S. 26384–26390, doi:10.1074/jbc.M006939200, PMID 11294828.
- ↑ M. Bugiani, V. Tiranti, L. Farina, G. Uziel, M. Zeviani: Novel mutations in COX15 in a long surviving Leigh syndrome patient with cytochrome c oxidase deficiency. In: J. Med. Genet. Band 42, Nr. 5, Mai 2005, S. e28, doi:10.1136/jmg.2004.029926, PMID 15863660, PMC 1736058 (freier Volltext).
- ↑ A. L. Sonenshein, James A. Hoch, Richard Losick: Bacillus subtilis and its closest relatives. ASM Press, 2002, ISBN 1-55581-205-8, S. 174.
- ↑ M. H. Barros, F. G. Nobrega, A. Tzagoloff: Mitochondrial ferredoxin is required for heme A synthesis in Saccharomyces cerevisiae. In: J. Biol. Chem. Band 277, Nr. 12, März 2002, S. 9997–10002, doi:10.1074/jbc.M112025200, PMID 11788607.
- ↑ F. Fontanesi, I. C. Soto, D. Horn, A. Barrientos: Assembly of mitochondrial cytochrome c-oxidase, a complicated and highly regulated cellular process. In: Am. J. Physiol., Cell Physiol. Band 291, Nr. 6, Dezember 2006, S. C1129–C1147, doi:10.1152/ajpcell.00233.2006, PMID 16760263 (physiology.org).


 French
French Deutsch
Deutsch