Monolinuron – Wikipedia
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
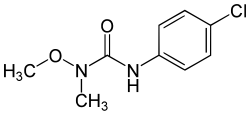
| Name | Monolinuron | ||||||||||||||||||
| Andere Namen | 3-(4-Chlorphenyl)-1-methoxy-1-methylharnstoff | ||||||||||||||||||
| Summenformel | C9H11ClN2O2 | ||||||||||||||||||
| Kurzbeschreibung | farblose Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 214,65 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Dichte | 1,3 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | zersetzt sich vor dem Sieden bei 220 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Monolinuron ist ein synthetisches Herbizid aus der Substanzklasse der Phenylharnstoffe. Es wurde 1958 von Hoechst auf den Markt gebracht.
Darstellung
[Bearbeiten | Quelltext bearbeiten]4-Chloranilin reagiert mit Phosgen zum Isocyanat. Dieses wird mit N,O-Dimethylhydroxylamin zur Reaktion gebracht, wodurch Monolinuron entsteht.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Monolinuron ist ein weißer, kristalliner und geruchloser Feststoff. In neutralem Medium ist es hydrolysestabil, jedoch bauet es sich im Alkalischen und Sauren schnell ab. Außerdem zersetzt es sich unter Einwirkung von UV-Licht. Im Boden ist es mit einer Halbwertszeit von 60 Tagen moderat persistent. Wenn flüssige Formulierungen Hitze ausgesetzt sind, können giftige und explosive Gasgemische entstehen.[1][5]
Wirkungsweise und Verwendung
[Bearbeiten | Quelltext bearbeiten]Die Wirkungsweise von Monolinuron ist analog zu anderen Phenylharnstoffherbiziden. Es hemmt den Elektronentransport des Photosystems II. Dadurch kommt die Photosynthese zum Erliegen und die Pflanze stirbt ab.[6]
Monolinuron kann sowohl als Vorauflaufherbizid als auch zur Nachauflaufbehandlung gegen breitblättrige Unkräuter und einjährige Gräser verwendet werden. Es kann in vielfältigen Bereichen eingesetzt werden, beispielsweise im Obst-, Gemüse- und Getreideanbau, aber auch bei Zierpflanzen und im Weinanbau.[1]
Der Wirkstoff kann auch als Algizid zum Beispiel gegen Fadenalgen eingesetzt werden.[5]
Toxikologie
[Bearbeiten | Quelltext bearbeiten]Der Wirkstoff wird von der WHO als "unwahrscheinlich, giftig zu sein" eingestuft. Dennoch sollte bei der Anwendung für ausreichenden Schutz gesorgt werden, da Chlorwasserstoff und Stickoxide entstehen können.[5]
Zulassung
[Bearbeiten | Quelltext bearbeiten]In keinem Mitgliedstaat der Europäischen Union sowie der Schweiz sind Pflanzenschutzmittel mit Monolinuron zugelassen.[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Eintrag zu Monolinuron in der Pesticide Properties DataBase (PPDB) der University of Hertfordshire, abgerufen am 10. Juli 2020.
- ↑ a b c d e f Eintrag zu Monolinuron in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Juli 2020. (JavaScript erforderlich)
- ↑ Eintrag zu Monolinuron im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 10. Juli 2020. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Thomas A. Unger: Pesticide synthesis handbook. Noyes Publications, 1996, ISBN 0-8155-1401-8, S. 360 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Paranjape, Kalyani.: The pesticide encyclopedia. CABI, Wallingford, Oxfordshire UK 2014, ISBN 978-1-78064-014-3 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Monolinuron. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. Juli 2020.
- ↑ Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Monolinuron in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 10. Juli 2020.


 French
French Deutsch
Deutsch

