Nitrosylverbindungen – Wikipedia
Nitrosyl ist ein Namensteil chemischer Verbindungen, die NO+- oder NO−-Ionen enthalten, für erstere ist die Bezeichnung üblicher. Die Verbindungen leiten sich vom Stickstoffmonoxid NO ab. NO-Liganden in Komplexverbindungen werden ebenfalls mit Nitrosyl bezeichnet.
Die Reduktion von Stickstoffmonoxid ergibt das bei Temperaturen über −95 °C instabile Hyponitrit-Anion NO−:
Bei der recht leicht erfolgenden Oxidation von NO entsteht das Nitrosyl- oder Nitrosonium-Kation NO+:

Beispiele für Nitrosylverbindungen sind:
- Schwarzes Roussin’sches Ammoniumsalz NH4[Fe4S3(NO)7]
- Nitrosyltetrafluoroborat [NO]BF4
- Nitrosylperchlorat NOClO4
- Nitrosylhexafluorophosphat NOPF6
- Nitrosyltricarbonyltriphenylphosphanmangan(-I) [Mn(CO)3(NO)P(C6H5)3]
- Cyclopentadienylnickelnitrosyl
- Nitrosyl-tris(triphenylphoshan)-rhodium [(C6H5)3P]3Rh(NO)
Nitrosylsalze reagieren mit Wasser zu Salpetriger Säure.
Tritt NO (also Stickstoffmonoxid) neutral oder als Anion oder Kation als Ligand in Komplexverbindungen auf, so werden diese manchmal als Metall-Nitrosyl-Komplexe bezeichnet. Das Nitrosyl-Ion ist isoelektronisch zu CO, N2 oder CN−, besitzt den Bindungsgrad 3 und tritt als Nitrosyl-Radikal in einkernigen Komplexen in linearer oder gewinkelter Anordnung auf.[1]
Verwandte Verbindungen
[Bearbeiten | Quelltext bearbeiten]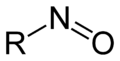
Organische Verbindungen der allgemeinen Form R1R2R3C-N=O, die sich formal vom NO−-Ion ableiten, werden als Nitrosoverbindungen bezeichnet. Gemeinsames Merkmal dieser Verbindungen ist die NO-Gruppe, die als funktionelle Gruppe Nitrosogruppe genannt wird. Derivate der salpetrigen Säure enthalten ebenfalls kovalent gebundene NO-Gruppen, beispielsweise das Nitrosylchlorid oder das Nitrosylbromid.
Quellen
[Bearbeiten | Quelltext bearbeiten]- ↑ Erwin Riedel; Moderne Anorganische Chemie, 3. Auflage, S. 663ff


 French
French Deutsch
Deutsch
