Podozyt – Wikipedia
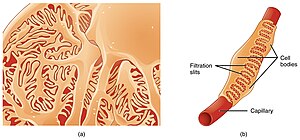
Die Podozyten (von altgriechisch poús (πούς) – Genitiv podós (ποδός) = ‚Fuß‘ und altgriechisch kýtos (κύτος) = „Höhlung“ → ‚Zelle‘) sind Zellen der Nierenkörperchen. Sie bilden das innere Blatt der Bowman-Kapsel und sind daher, zusammen mit der Basalmembran, für die Filterfunktion der Nieren von besonderer Bedeutung. Aufgrund ihrer äußeren Form – vielfach miteinander verzahnter Fortsätze – werden sie auch als Fußzellen und wegen ihrer Funktion als Filtrationsschlitze oder Nierenfilterzellen bezeichnet.
Sie sind nur für Moleküle bis zu einer molaren Masse von etwa 70 Kilodalton (kDa) durchlässig.[1] Das entspricht Molekül-Durchmessern von bis zu 16 Nanometern (andere Angaben: 4 bis 5 nm). Das nennt man Größenselektion. Eine sogenannte Permselektivität kann zusätzlich die Filtration von kleinen erwünschten (also nicht harnpflichtigen) Stoffen in Abhängigkeit von ihrer elektrischen Ladung verhindern. Im Gegensatz zu den Tubuli ist die Fähigkeit der Glomerula zur Selektion hinsichtlich der Homöostase jedoch sehr begrenzt.
Die Podozyten sind als Teil der Bowmanschen Kapsel (zusammen mit den Glomerula, deutsch: Nierenknäuelchen) in den Nierenkörperchen enthalten. Jedes Malpighische Nierenkörperchen bildet zusammen mit dem zugehörigen Tubulus (deutsch: Nierenkanälchen) ein Nephron (von altgriechisch νεφρός nephros, deutsch ‚Niere‘) als kleinste funktionelle Untereinheit der Niere von Menschen und Säugetieren.
Jede menschliche Niere verfügt über etwa eine Million Nephrone, und damit über ebenso viele Nierenkörperchen, Nierenknäuelchen und Nierenkanälchen.[2] In jedem Nephron sind zahlreiche Podozyten enthalten.
Die Podozyten sind damit Teil der Blut-Harn-Schranke. Eine weitere Aufgabe der Podozyten bezieht sich auf die Selbstreinigung des glomerulären Filters. Vermutlich sind sie zusammen mit den Endothelzellen auch für die Lieferung neuen Basalmaterials verantwortlich.
Terminologie
[Bearbeiten | Quelltext bearbeiten]Jedes Malpighische Nierenkörperchen (lateinisch: Corpusculum renale) besteht aus einem Glomerulum und einer Bowmanschen Kapsel. Die Podozyten sitzen am viszeralen Blatt der Bowmanschen Kapsel, also außerhalb des Glomerulums. Jede Bowmansche Kapsel beherbergt viele Fußzellen. Jede Fußzelle (Podozyt) hat viele Zellfüße; diese heißen Podozytenfüßchen. Bei diesen Podozytenfüßchen unterscheidet man die langen Primärfortsätze von den kurzen Sekundärfortsätzen. Ein Sekundärfortsatz wird auch als Cytopodium (wörtlich: Zellfuß) bezeichnet.
Das viszerale Blatt der Bowman-Kapsel bedeckt das Glomerulum. Deswegen definiert der Medizin-Duden einen Podozyten als „Glomerulumdeckzelle mit füßchenförmigen Fortsätzen.“[3]
Über die Anzahl der Podozyten und Zytopodien in einem Nephron gibt es in den Lehrbüchern keine Angaben. Ebenso fehlen Hinweise für einen Zusammenhang zwischen diesen Zahlen und dem Schweregrad (Stadien 1 bis 5) der intrarenalen Niereninsuffizienz. Außerdem gibt es keine therapeutischen Empfehlungen zur Behandlung von Podozytenkrankheiten.
Mitunter wird die Abgrenzung zwischen Glomerulum und Podozyt nicht streng eingehalten. So spricht ein Lehrbuch von „glomerulären Podozyten“,[4] obwohl die Podozyten außerhalb der Glomerula liegen.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Im dreiteiligen Nierenband mit 3000 Seiten im Handbuch der inneren Medizin fehlte noch 1968 eine Erwähnung der Podozyten.[5] Allerdings fehlen die Begriffe Podozyt und Podozytopathie auch in einem aktuellen Lehrbuch zu Nierenerkrankungen im Kindes- und Jugendalter.[6]
Maxim Zetkin und Herbert Schaldach definierten die Podozyten erstmals 1973 in der 5. Auflage ihres Wörterbuches der Medizin (WdM) als „Epithelzellen des Glomerulum der Niere. Sie besitzen zahlreiche Füßchen auf der glomerulären Basalmembran. Zwischen den Füßchen liegen die Schlitzporen.“[7] Analog definierte 1973 das Reallexikon der Medizin und ihrer Grenzgebiete einen Podozyt als „Glomerulusdeckzelle: der Basalmembran des viszeralen Blattes der Glomeruluskapsel mit fußartigen Fortsätzen aufsitzende Epithelzelle.“[8] Willibald Pschyrembel verzeichnete die Podozyten in seinem Klinischen Wörterbuch erstmals 1982 in der 254. Auflage. Er definierte sie als „Deckzellen des inneren Blattes der Bowman-Kapsel. Besitzen zahlreiche Füßchen, die von den Fortsätzen dieser Zellen ausgehen und ineinandergreifend der Basalmembran aufsitzen“,[9] ohne auf ihre Funktion einzugehen.
Histologie
[Bearbeiten | Quelltext bearbeiten]Podozyten, auch als perivaskuläre Zellen bekannt, sind atypische Epithelzellen, die durch einen Zellkörper gekennzeichnet sind, aus dem kurze Füße und lange Prozesse oder Projektionen herausragen.
Diese atypischen Epithelzellen sind die sternförmigen Deckzellen der Kapillaren; sie bilden das innere (viszerale) Blatt der Bowmanschen Kapsel. Sie haben lange Primärfortsätze (Cytotrabecula oder Pedikel genannt) und kurze, feine Sekundärfortsätze (Cytopodia). Diese Fortsätze stehen fußförmig auf der Basalmembran. Ein Pedikel heißt im Lateinischen pediculus; das ist das Diminutiv von lateinisch pedis = Fuß. Pedikel oder Pedicula sind also Füßchen. Als Trabekel (von lateinisch trabecula = ‚kleiner Balken‘) bezeichnet man in der Anatomie bälkchenartige Strukturen in Organen; Cytotrabecula sind also Zellbälkchen. Der Begriff Cytopodia ist eine Umkehrung des Wortes Podozyt (also Zellenfuß statt Fußzelle).
Die sekundären Fortsätze verzahnen sich über Transmembranproteine (Nephrin und Podocin) mit den benachbarten Podozyten. Dabei wird Nephrin durch das CD2-assoziierte Protein zusammen mit Podocin und α-Aktinin-4 verankert.[10] Die Sekundärfortsätze überbrücken so einen kleinen Spaltraum mit einer Breite von etwa 20–30 nm (andere Angabe: 30–40 nm). Diese Lücke (Filtrationsschlitz) wird als Schlitzpore oder als Schlitzmembran bezeichnet wird. Außerdem nennt man sie Schlitzdiaphragma, weil sie den Spaltraum durch ein Diaphragma verschließt.[11]
Dieses die Zellzwischenräume durchspannende proteinerges Schlitzdiaphragma verkleinert die Porengröße auf 4 bis 5 nm und ist undurchlässig für Moleküle, die schwerer als 50 kDa sind. Manche Quellen sehen diese Grenze auch bei 70 kDa. An ihrer apikalen Membran sind die Podozytenfortsätze von einer anionischen Glykokalyx bedeckt.
Funktion
[Bearbeiten | Quelltext bearbeiten]Die Filtrationsbarriere besteht aus drei Komponenten: dem fenestrierten Endothel, der glomerulären Basalmembran und den Podozyten. Für die Funktion der Podozyten wichtige Proteine sind unter anderen Podoplanin, Nephrin und Podocin, deren kürzliche Entdeckung das Wissen um die Podozytenfunktion wesentlich erweitert hat.
Die Podozytenfortsätze bilden mit den ihnen aufsitzenden Transmembranproteinen das letzte und feinste Filter der Blut-Harn-Schranke. Die Podozyten sind damit die wichtigste morphologische Grundlage für die Bildung des Ultrafiltrats. Die Schlitzmembran ermöglicht nur kleinmolekularen Stoffen (zum Beispiel Wasser, Elektrolyte, Glukose) die Passage. Diese Stoffe bezeichnet man als harnfähig. Moleküle mit einem Gewicht von mehr als 70 kDa (zum Beispiel Blutzellen und Makromoleküle) werden zurückgehalten. Das Ultrafiltrat heißt auch Primärharn; die Primärharnbildung pro Zeitspanne ist die glomeruläre Filtrationsrate oder Kreatininclearance. Man spricht von der filtrativen Nierenfunktion in Abgrenzung zur Rückresorption in den Tubuli.
An der Aufrechterhaltung der Blut-Harn-Schranke ist die negativ geladene (anionische) Glykokalyx beteiligt; sie wird von den Podozyten gebildet und bedeckt die apikalen Membranen der Podozytenfortsätze. Die Glykokalyx trägt zur Ladungsselektivität (Permselektivität, abgeleitet von Permeabilität) der glomerulären Filtration bei. Wegen ihrer anionischen Ladung ist die Glykokalyx impermeabel für anionische Moleküle (zum Beispiel für Albumine). Deswegen werden Anionen schlechter filtriert als Kationen oder ungeladene Moleküle.
Pathophysiologie
[Bearbeiten | Quelltext bearbeiten]Ein aktuelles Lehrbuch der Nierenheilkunde erklärt den Pathomechanismus der immunologischen Schädigung der glomerulären Kapillaren wie folgt: Immunkomplexablagerungen an den Podozyten führen zusammen mit Oxidanzien zur Schädigung der glomerulären Kapillaren mit einer Proteinurie. Eine entzündliche Schädigungskaskade führt zusammen mit Fibrin zu einer extrakapillären Proliferation.[12]
Podozyten-Krankheiten
[Bearbeiten | Quelltext bearbeiten]Die Podozyten sind maßgeblich an der glomerulären Filtration und damit an der renalen Clearance beteiligt. Der Einfluss der einzelnen Podozytopathien auf GFR und Clearance ist Gegenstand moderner Forschung. An den Oberflächenproteinen der Podozyten kann es zu reversiblen oder zu irreversiblen Schäden kommen. Mechanische Schäden bedingen einen Podozytenverlust.[13]
Primäre Podozytopathien haben häufig einen genetischen Hintergrund mit Mutationen, die die Funktion von Strukturproteinen der Filtrationsbarriere oder von Proteinen beeinflussen, die an der Regulation des Aktin-Zytoskeletts beteiligt sind. Sekundäre Podozytopathien sind die Folge anderer Krankheiten, die auch einen genetischen Hintergrund haben können. Beispiele für Ursachen sekundärer Podozytenkrankheiten sind Stoffwechselerkrankungen wie Diabetes mellitus, eine alimentär bedingte Adipositas und Funktionsstörungen des Immunsystems.
Bei der fokal segmentalen Glomerulosklerose fanden Forscher eine „Minimal Change Disease (MCD) mit unauffälliger Lichtmikroskopie, aber elektronenmikroskopisch nachweisbarer schwerer Podozytenschädigung“. „Vereinfacht betrachtet kann man sagen, dass Schädigungen an den Podozyten und Schlitzmembranen ein nephrotisches Syndrom verursachen, während Endothelläsionen sowie Defekte der Basalmembran eher mit einem nephritischen Syndrom assoziiert sind.“[14] In Einzelfällen zeigt die Nierenbiopsie nach einer Covid-19-Impfung eine Glomerulopathie in Form einer fokal segmentalen Glomerulosklerose (FSGS) oder einer Minimal-Change-Glomerulopathie (MCGP).[15][16][17][18][19]
Sowohl genetische als auch erworbene Schädigungen des Podozyten verursachen eine Retraktion der Fußfortsätze, die Pseudo-Fußfortsatzverschmelzung, die mit einer Änderung der Struktur der Schlitzmembran einhergeht (Kriz 1997[20]).[21] Eine solche Retraktion der podozytären Fußfortsätze imponiert als Fusion derselben.[22] Ähnlich erwähnt Gerd Harald Herold die Podozytenerkrankung mit einer „Ablösung der Podozyten-Fortsätze von der glomerulären Basalmembran mit Entwicklung einer Proteinurie“ und außerdem mit einer „Verschmelzung der Fußfortsätze der Podozyten.“[23]
Im Zuge entzündlicher Prozesse (Glomerulonephritis) der Glomeruluskapillaren kann es zu einer Insuffizienz der Blut-Harn-Schranke mit Verlust der negativen Ladungseigenschaften und mit einer Porenvergrößerung kommen. Makromoleküle können unabhängig von ihrem Molekülradius und unabhängig von ihrer elektrischen Ladung die Membran passieren. Es kommt zur Hämaturie und zur Albuminurie (Proteinurie).
B7-1-Expression von Podozyten
[Bearbeiten | Quelltext bearbeiten]Unter bestimmten Umständen können Podozyten auch B7-1 als Oberflächenprotein (CD80) exprimieren, besonders bei proteinurischen Nierenerkrankungen. Diese B7-1-positiven Podozyten haben eine reduzierte Bindung an die umgebende extrazelluläre Matrix über β1-Integrin. Eine klinische Studie mit fünf Patienten mit einer primären oder rezidivierten fokal segmentalen Glomerulosklerose, die B7-1-positive Podozyten aufweisen, zeigte bei allen Patienten eine teilweise oder komplette Remission der Proteinurie unter der Behandlung mit Abatacept, einem Fusionsprotein aus dem Peptid CTLA und Immunglobulin. Abatacept ist dabei ein Inhibitor des costimulierenden B7-1-Moleküls auf der T-Zelle, das bereits erfolgreich bei der Therapie der rheumatoiden Arthritis eingesetzt wird.[24]
Podozytogenese
[Bearbeiten | Quelltext bearbeiten]Ebenso gibt es Forschungsarbeiten zur Neubildung von Podozyten.[25]
Anmerkungen
[Bearbeiten | Quelltext bearbeiten]- ↑ Thomas Heinzeller, Carl M. Büsing: Histologie, Histopathologie und Zytologie für den Einstieg. Georg Thieme Verlag, 2001, ISBN 3-13-126831-X, S. 209. eingeschränkte Vorschau in der Google-Buchsuche.
- ↑ Alle diese drei deutschen Begriffe finden sich nicht in den modernen nephrologischen Lehrbüchern, kaum in den einschlägigen medizinischen Wörterbüchern und auch nicht im 228-seitigen Sachverzeichnis am Ende des dreiteiligen Nierenbandes im Handbuch der inneren Medizin (5. Auflage, 8. Band, 3. Teil, Springer-Verlag, Berlin / Heidelberg / New York 1968, ISBN 3-540-04152-4). Quellen für Nierenkanälchen: Alfred Benninghoff, Kurt Goerttler: Lehrbuch der Anatomie des Menschen. 11. Auflage, Verlag Urban & Schwarzenberg, München / Wien / Baltimore 1977, Band 2, ISBN 3-541-00251-4, S. 250–253; Peter Reuter: Springer Klinisches Wörterbuch 2007/2008, Heidelberg 2007, ISBN 978-3-540-34601-2, S. 1294. Quellen für Nierenknäuelchen: Joseph Julius Czermak: Über die Nierenknäuelchen, Isis 1836, S. 783; "Medicinische Jahrbücher des kaiserlich königlichen österreichischen Staates", 32. Band, Wien 1840, S. 557; Theodor Fahr: Harnorgane – Männliche Geschlechtsorgane, 1. Teil, Verlag von Julius Springer, Berlin 1925, ISBN 978-3-7091-3039-1, S. 17; Dieter Vaitl (Hrsg.): Essentielle Hypertonie, Springer-Verlag, Berlin / Heidelberg 1982, ISBN 978-3-540-10975-4, S. 41; "Ergebnisse der inneren Medizin und Kinderheilkunde", 35. Band, Verlag von Julius Springer, Berlin 1929, S. 471; Kenneth A. Anderson (Hrsg.): Springer Lexikon Pflege, 2. Auflage, 2. Band, Springer-Verlag, Berlin / Heidelberg 2002, ISBN 978-3-662-01100-3, S. 384, doi:10.1007/978-3-662-01099-0; Rheinische Post online: NRW-Wissenschaftspreis für Kölner Nierenexperten, 3. Mai 2018; Heiner Fangerau, Stefan Schulz, Thorsten Noack, Irmgard Müller: Medizinische Terminologie, 6. Auflage, Lehmanns Media, Berlin 2017, ISBN 978-3-86541-934-7, S. 69. Quellen für Nierenkörperchen: Günter Thiele (Hrsg.): Handlexikon der Medizin, Verlag Urban & Schwarzenberg, München / Wien / Baltimore ohne Jahr [1980], Teil III (L–R), S. 1734; Willibald Pschyrembel: Klinisches Wörterbuch, 268. Auflage, Verlag Walter de Gruyter, Berlin / Boston 2020, ISBN 978-3-11-068325-7, S. 1230, mit Verweisung auf das Malpighi-Körperchen; Duden: Das Wörterbuch medizinischer Fachausdrücke, 4. Auflage, Bibliographisches Institut, Mannheim / Wien / Zürich 1985, ISBN 3-411-02426-7, S. 482, mit Verweisung auf die Corpuscula renis; analog im Wörterbuch medizinischer Fachbegriffe, 10. Auflage, Dudenverlag, Berlin 2021, ISBN 978-3-411-04837-3, S. 563. – Im maßgeblichen sechsbändigen Reallexikon der Medizin und ihrer Grenzgebiete werden die Nierenkörperchen und die Nierenkanälchen, nicht aber die Nierenknäuelchen definiert; letztere werden kurz als Nierenknäuel bezeichnet. Quelle: Günter Thiele, Heinz Walter (Hrsg.): Reallexikon der Medizin und ihrer Grenzgebiete. Verlag Urban & Schwarzenberg, Loseblattsammlung 1966–1977, 5. Ordner (Membra–R-Zellen-Adenom), München/Berlin/Wien 1973, ISBN 3-541-84005-6, S. N 94. Die Nierenkanälchen werden mitunter auch als Harnkanälchen beschrieben, weil in ihnen der Primärharn zum Sekundärharn (oder Endharn, Urin, Harn) konzentriert wird; analog werden die Nierenknäuelchen als Filterkörperchen erklärt. Alfred Benninghoff und Kurt Goerttler definierten 1977 in der 11. Auflage ihres Lehrbuches der Anatomie des Menschen „Das Nierenkörperchen (Glomerulus, Glomerulum)“ falsch als Nierenknäuelchen (Quelle: Verlag Urban & Schwarzenberg, München / Wien / Baltimore 1977, ISBN 3-541-00251-4, S. 251).
- ↑ Duden: Wörterbuch medizinischer Fachbegriffe. Dudenverlag, 10. Auflage, Berlin 2021, ISBN 978-3-411-04837-3, S. 647.
- ↑ Karl Schärer, Otto Mehls (Hrsg.): Pädiatrische Nephrologie. Springer-Verlag, Berlin/Heidelberg 2002, ISBN 3-540-41912-8, Zitat S. 176.
- ↑ Handbuch der inneren Medizin: Band 8: Nierenkrankheiten, 3 Teile, Springer-Verlag, Berlin / Heidelberg / New York 1968 (herausgegeben von Herbert Schwiegk), ISBN 3-540-04152-4.
- ↑ Jörg Dötsch, Lutz T. Weber (Hrsg.): Nierenerkrankungen im Kindes- und Jugendalter. Springer-Verlag, Berlin / Heidelberg 2017, ISBN 978-3-662-48788-4.
- ↑ Maxim Zetkin, Herbert Schaldach (Hrsg.): Wörterbuch der Medizin, 5. Auflage, VEB Verlag Volk und Gesundheit, Berlin 1973, S. 614.
- ↑ Günter Thiele, Heinz Walter (Hrsg.): Reallexikon der Medizin und ihrer Grenzgebiete, Verlag Urban & Schwarzenberg, Loseblattsammlung, München / Berlin / Wien 1973, 5. Ordner (Mem–Rz), ISBN 3-541-84005-6, S. P 209.
- ↑ Willibald Pschyrembel: Klinisches Wörterbuch, Verlag Walter de Gruyter, 254. Auflage, Berlin / New York 1982, ISBN 3-11-007187-8, S. 944, dortige Autorenangabe: HE.
- ↑ Mark Dominik Alscher, Ulrich Kuhlmann: Angeborene Nierenerkrankungen. In: Ulrich Kuhlmann, Joachim Böhler, Friedrich C. Luft, Mark Dominik Alscher, Ulrich Kunzendorf (Hrsg.): Nephrologie. 6. Auflage. Georg Thieme Verlag, Stuttgart / New York 2015, ISBN 978-3-13-700206-2, S. 671, Abbildung 14.9.
- ↑ Willibald Pschyrembel: Klinisches Wörterbuch. 268. Auflage. Verlag Walter de Gruyter, Berlin/Boston 2020, ISBN 978-3-11-068325-7, S. 1403.
- ↑ Martin Kimmel, Ulrich Kuhlmann: Glomerulonephritis. In: Ulrich Kuhlmann, Joachim Böhler, Friedrich C. Luft, Mark Dominik Alscher, Ulrich Kunzendorf (Hrsg.): Nephrologie. 6. Auflage. Georg Thieme Verlag, Stuttgart / New York 2015, ISBN 978-3-13-700206-2, S. 73, Abbildung 2.1.
- ↑ Wilhelm Kriz: Welche Rolle spielen Podozyten, Kapillaren und Mesangium in der Pathogenese? In: "Current congress", 6. Jahrestagung der Deutschen Gesellschaft für Nephrologie, 6. bis 9. September 2014, 22 Seiten, S. 5 f. (Kapitel Diabetische Nephropathie).
- ↑ Wilhelm Kroukis: Beispiele primärer Glomerulopathien - Minimal Change Disease und Fokal-segmentale Glomerulosklerose und Das nephrotische Syndrom. In: Nefro cme - Fortbildungsperiodikum für Klinik und Praxis. Heft 3/2014, S. 1–5 ("Das nephrotische Syndrom") und S. 6 f.
- ↑ Harald Dormann, Anja Knüppel-Ruppert, Kerstin Amann, Christiane Erley: Nephrotic syndrome after vaccination against COVID-19: three new cases from Germany. In: Deutsches Ärzteblatt international. 1. Oktober 2021, ISSN 1866-0452, doi:10.3238/arztebl.m2021.0330, PMID 34919048, PMC 8762589 (freier Volltext) – (aerzteblatt.de [abgerufen am 28. April 2023]).
- ↑ Cho A Lim, Hyun Soon Lee, Songuk Yoon, Eun Jung Kim, Jang Won Seo, Ja-Ryong Koo, Seon Ha Baek: Focal segmental glomerulosclerosis following the Pfizer-BioNTech COVID-19 vaccine. In: Kidney Research and Clinical Practice. Band 41, Nr. 2, 31. März 2022, ISSN 2211-9140, S. 263–266, doi:10.23876/j.krcp.21.308, PMID 35286791, PMC 8995482 (freier Volltext) – (krcp-ksn.org [abgerufen am 28. April 2023]).
- ↑ Andrew S. Bomback, Satoru Kudose, Vivette D. D’Agati: De Novo and Relapsing Glomerular Diseases After COVID-19 Vaccination: What Do We Know So Far? In: American Journal of Kidney Diseases. Band 78, Nr. 4, Oktober 2021, S. 477–480, doi:10.1053/j.ajkd.2021.06.004, PMID 34182049, PMC 8230841 (freier Volltext) – (elsevier.com [abgerufen am 28. April 2023]).
- ↑ Larissa Lebedev, Marina Sapojnikov, Alexander Wechsler, Ronen Varadi-Levi, Doron Zamir, Ana Tobar, Nomy Levin-Iaina, Shlomo Fytlovich, Yoram Yagil: Minimal Change Disease Following the Pfizer-BioNTech COVID-19 Vaccine. In: American Journal of Kidney Diseases. Band 78, Nr. 1, Juli 2021, S. 142–145, doi:10.1053/j.ajkd.2021.03.010, PMID 33839200, PMC 8028833 (freier Volltext) – (elsevier.com [abgerufen am 28. April 2023]).
- ↑ Fadi Salem, Joshua L. Rein, Samuel Mon-Wei Yu, Mathew Abramson, Paolo Cravedi, Miriam Chung: Report of Three Cases of Minimal Change Disease Following the Second Dose of mRNA SARS-CoV-2 COVID-19 Vaccine. In: Kidney International Reports. Band 6, Nr. 9, September 2021, S. 2523–2524, doi:10.1016/j.ekir.2021.07.017, PMID 34337193, PMC 8313814 (freier Volltext) – (elsevier.com [abgerufen am 28. April 2023]).
- ↑ Wilhelm Kriz: Evolving role of the podocyte in chronic renal failure. In: Kidney and Blood Pressure Research. 20. Jahrgang, Nummer 3/1997, S. 180–183.
- ↑ Judith Knaup: Die Bedeutung des Ciliary Neurotrophic Factor für die Funktion des Podozyten. Dissertation, Medizinische Fakultät der Heinrich-Heine-Universität, Düsseldorf 2014, S. 3 f., mit umfangreichem Literaturverzeichnis.
- ↑ Karl Schärer, Otto Mehls (Hrsg.): Pädiatrische Nephrologie. Springer-Verlag, Berlin/Heidelberg 2002, ISBN 3-540-41912-8, S. 213 f.
- ↑ Gerd Harald Herold: Innere Medizin 2022. Selbstverlag, Köln 2021, ISBN 978-3-9821166-1-7, S. 612.
- ↑ Chih-Chuan Yu, Alessia Fornoni, Astrid Weins, Samy Hakroush, Dony Maiguel, Junichiro Sageshima, Linda Chen, Gaetano Ciancio, Mohd. Hafeez Faridi, Daniel Behr, Kirk N. Campbell, Jer-Ming Chang, Hung-Chun Chen, Jun Oh, Christian Faul, M. Amin Arnaout, Paolo Fiorina, Vineet Gupta, Anna Greka, George W. Burke III, Peter Mundel: Abatacept in B7-1–Positive Proteinuric Kidney Disease. In: The New England Journal of Medicine 2013, Band 369, Ausgabe 25 vom 19. Dezember 2013, S. 2416–2423; DOI:10.1056/NEJMoa1304572.
- ↑ Bart Smeets, Katja Berger: Podozytogenese - Wie tragen parietale Epithelzellen dazu bei? In: "Current congress", 6. Jahrestagung der Deutschen Gesellschaft für Nephrologie, 6. bis 9. September 2014, S. 19.


 French
French Deutsch
Deutsch