Sultiam – Wikipedia
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
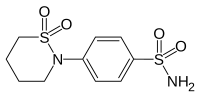 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Sultiam | ||||||||||||||||||
| Andere Namen | 2-(4-Sulfamoylphenyl)-1,2-thiazinan-1,1-dioxid | ||||||||||||||||||
| Summenformel | C10H14N2O4S2 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 290,36 g·mol−1 | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Sultiam (Handelsname: Ospolot; Hersteller: Desitin) ist ein Arzneistoff aus der Gruppe der Sulfonsäureamide, der in der Behandlung von bestimmten Epilepsieformen eingesetzt wird. Pharmakologisch gehört es zu den Carboanhydrasehemmern. Die Hemmung des Enzyms Carboanhydrase bewirkt eine Gewebsübersäuerung, die wiederum die Erregbarkeit von Nervenzellen vermindern kann. Sultiam ist eines der älteren Antikonvulsiva und wurde erst ab Ende der 1980er Jahre „wiederentdeckt“.
Klinische Angaben
[Bearbeiten | Quelltext bearbeiten]Anwendungsgebiete
[Bearbeiten | Quelltext bearbeiten]Sultiam ist zugelassen zur oralen Behandlung der Rolando-Epilepsie. Die Rolando-Epilepsie wird auch als benigne Epilepsie des Kindesalters mit zentrotemporalen Spikes bezeichnet.
Sultiam wird daneben auch häufig bei anderen Epilepsieformen des Kindesalters eingesetzt, die ähnliche EEG-Veränderungen wie die Rolando-Epilepsie aufweisen, zum Beispiel beim Pseudo-Lennox-Syndrom oder beim Landau-Kleffner-Syndrom.[2][3]
Unlängst wurden auch Daten zur Anwendung beim West-Syndrom[4] sowie bei anderen schwer zu behandelnden herdförmigen Epilepsien[5] publiziert. Weiterhin wird Sultiam zur Behandlung der Krampfkomponente beim Rett-Syndrom eingesetzt.[6]
Gegenanzeigen
[Bearbeiten | Quelltext bearbeiten]Sultiam darf nicht angewendet werden bei:
- bekannter Überempfindlichkeit gegen Sultiam oder andere Sulfonamide
- bei bekannter akuter Porphyrie
- bei Schilddrüsenüberfunktion
- bei Bluthochdruck.
Sultiam sollte nicht oder nur mit besonderer Vorsicht eingesetzt werden:
- bei Vorliegen einer Nierenfunktionsstörung
- bei vorbestehenden psychiatrischen Erkrankungen
- bei Frauen im gebärfähigen Alter und Mädchen älter als 12 Jahre
- bei Schwangerschaft oder Stillzeit.
Achtung: die Gegenanzeigen unterscheiden sich Deutschland und der Schweiz.
Wechselwirkungen mit anderen Medikamenten
[Bearbeiten | Quelltext bearbeiten]Bei Kombination von Sultiam mit Phenytoin kann der Phenytoin-Blutspiegel stark ansteigen. In Einzelfällen kam es zu einer Erhöhung der Blutspiegels von Lamotrigin. Bei einer Kombination von Sultiam mit Primidon können die Sultiam-Nebenwirkungen zunehmen (insbesondere bei Kindern). Es gibt Hinweise darauf, dass die Blutkonzentration von Sultiam bei gleichzeitiger Einnahme von Carbamazepin vermindert wird. Die gleichzeitige Einnahme von Sultiam und anderen Carboanhydrasehemmern (z. B. Topiramat, Acetazolamid oder Zonisamid) kann die Nebenwirkungen der Carboanhydrase-Hemmung verstärken. Während der Sultiam-Behandlung sollte auf den Genuss von Alkohol verzichtet werden, da Sulfonamide eine Disulfiram-ähnliche Wirkung besitzen und zusammen mit Alkohol eine unangenehme Reaktion ausgelöst werden könnte.
Anwendung während Schwangerschaft und Stillzeit
[Bearbeiten | Quelltext bearbeiten]Es gibt experimentelle Hinweise auf embryotoxische Effekte. Es ist davon auszugehen, dass Sultiam die Placentaschranke überschreiten und in die Muttermilch übergehen kann. Es kann somit in den Fötus sowie in den gestillten Säugling übergehen. Sultiam darf während der Schwangerschaft und in der Stillzeit nicht angewendet werden, da dafür keine ausreichenden Untersuchungen zur Sicherheit vorliegen.
Unerwünschte Wirkungen
[Bearbeiten | Quelltext bearbeiten]Magenbeschwerden können häufig (1–10 %) bis sehr häufig (≥ 10 %) auftreten. Missempfindungen (Parästhesien) in den Gliedern und im Gesicht sowie Atembeschwerden, Schwindel, Kopfschmerzen, Herzbeschwerden, Doppelbilder, Schluckauf, Gewichtsverlust oder Appetitlosigkeit können auch häufig auftreten. Gelegentlich (0,1–1 %) kommt es zu Halluzinationen, Angst, Muskelschwäche, Antriebsarmut, Gelenkschmerzen, einem Status epilepticus oder zu Anfallshäufung. In Einzelfällen besteht der Verdacht, dass Sultiam mit der Auslösung eines akuten Nierenversagens, eines Stevens-Johnson-Syndroms, eines Lyell-Syndroms oder einer Polyneuritis im Zusammenhang stehen könnte. Sultiam ist ein Carboanhydrasehemmer. Daher sind Nebenwirkungen der Carboanhydrase-Hemmung, wie Nierensteine, Übersäuerung und Veränderungen von Blutwerten nicht auszuschließen.
Pharmakologische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Wirkungsmechanismus
[Bearbeiten | Quelltext bearbeiten]Sultiam ist ein Sulfonamid-Derivat, besitzt jedoch im Gegensatz zu anderen Sulfonamiden keine antibiotische Wirkung. Strukturell bestehen keine Gemeinsamkeiten mit anderen Antikonvulsiva. Der Wirkmechanismus ist nicht vollständig bekannt. Ein wesentlicher biologische Effekt ist die Hemmung der Carboanhydrase des Gehirns: eine Gewebsübersäuerung im Gehirn setzt die Erregbarkeit von Nervenzellen herab. Weiterhin wurden Wirkungen auf erregende und hemmende Botenstoffe im Nervensystem beschrieben. Sultiam reduziert ebenfalls den Natriumeinstrom in die Nervenzelle und setzt so die Erregbarkeit der Nervenzelle herab.[7] Der Arzneistoff zeigte eine gute Wirksamkeit im Elektrokrampftest (Ratte und Maus) und im Krampftest mit Pentamethylentetrazol (Maus).[8]
Aufnahme und Verteilung im Körper
[Bearbeiten | Quelltext bearbeiten]Die Pharmakokinetik von Sultiam wurde bislang nicht systematisch untersucht. Maximale Plasmakonzentrationen werden nach ein bis fünf Stunden gemessen. Die Halbwertszeit beträgt 2 bis 16 Stunden und kann durch eine Kombinationsbehandlung mit anderen Antikonvulsiva verkürzt werden. Die Kinetik ist linear. Im Plasma ist der Wirkstoff zu etwa 29 % an Proteine gebunden. Die empfohlenen Blutspiegel bei der Behandlung der Rolando-Epilepsie liegen bei 1–3 µg/ml.[9]
Bioverfügbarkeit
[Bearbeiten | Quelltext bearbeiten]Nach oraler Gabe wird Sultiam rasch und vollständig, bevorzugt aus dem oberen Dünndarmabschnitt resorbiert. Der Nahrungseinfluss auf die Aufnahme von Sultiam wurde bislang nicht untersucht.
Metabolismus
[Bearbeiten | Quelltext bearbeiten]Bislang wurden zwei Abbauprodukte von Sultiam identifiziert. Davon ist hydroxyliertes Sultiam mengenmäßig das wichtigste Abbauprodukt. Es besitzt keine antikonvulsive Eigenschaften. Nach oraler Gabe werden circa 80–90 % der Dosis über die Nieren ausgeschieden. Etwa 30–60 % werden unverändert ausgeschieden. Mehr als 25 % werden als Abbauprodukt (hydroxyliertes Sultiam) ausgeschieden.
Toxikologie
[Bearbeiten | Quelltext bearbeiten]Sultiam hat eine geringe akute Toxizität. Die orale LD50 für Ratte und Maus liegt über 5000 mg/kg Körpergewicht und für das Kaninchen bei etwa 1000 mg/kg. Bei intraperitonealer Gabe lag die LD50 für die Maus bei ca. 1700 mg/kg.[10]
Bei Überdosierung werden zumeist Kopfschmerzen, Schwindel, Ataxie, Bewusstseinsstörung, Katatonie, Azidose und Sultiamkristalle im Urin beobachtet. Überdosierungen mit vier bis fünf Gramm Sultiam wurden überlebt.[11][12] Die Einnahme von ca. 20 g Sultiam in suizidaler Absicht bei Erwachsenen führte in einem Fall zum Tod.[13] In zwei anderen Fällen kam es bei vergleichbarer Überdosis zur vollständigen Wiederherstellung.[14][15] Es existiert kein spezifisches Antidot.
Sonstige Informationen
[Bearbeiten | Quelltext bearbeiten]Geschichte
[Bearbeiten | Quelltext bearbeiten]Sultiam wurde in den 1950er Jahren bei Bayer synthetisiert und 1960 als Ospolot® in Europa und anderen Ländern in den Handel gebracht. Nach Einführung im Jahre 1960 wurde Sultiam als Mittel der zweiten Wahl zur Behandlung von Epilepsien mit Herdanfällen genutzt und oft zusammen mit dem etablierten Antikonvulsivum Phenytoin eingesetzt. Hansen u. a. beschrieben 1968 erstmals, dass die Phenytoin-Blutspiegel bei einer kombinierten Behandlung mit Sultiam erheblich anstiegen.[16] Diese Ergebnisse führten zu der Annahme, dass Sultiam keine eigenständige antikonvulsiven Wirkung besitzt und nur über die Erhöhung der Phenytoinspiegel wirke. Nach Veröffentlichung einer negativen Vergleichsstudie gegen Phenytoin[17] ging der Einsatz von Sultiam schnell zurück. Erst 1988 entdeckte der deutsche Kinderneurologe Hermann Doose die spezifische Wirkung des Arzneistoffs bei Kindern mit Rolando-Epilepsie.[18] Diese Entdeckung wurde später in einer kontrollierten Studie bestätigt.[19] Trotz der o. a. Einschränkung der behördlichen Zulassung in Deutschland gilt Sultiam heute im deutschen Sprachraum und in Israel als Mittel der ersten Wahl bei Rolando-Epilepsien.[20]
Die Zulassungen wurden 1993 an Desitin übertragen. Sultiam wird heute in einigen europäischen Ländern sowie in Israel, Japan, und Australien vertrieben.
Handelsnamen und Darreichungsformen
[Bearbeiten | Quelltext bearbeiten]- Ospolot 50/200 mg Filmtabletten
Der Vertrieb in Deutschland und der Schweiz erfolgt durch Desitin und in Österreich durch AOP Orphan Pharmaceuticals AG
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Sultiame im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 5. November 2019.
- ↑ G. Gross-Selbeck: Treatment of "benign" partial epilepsies of childhood, including atypical forms. In: Neuropediatrics. 26, 1995, S. 45–50. PMID 7791951.
- ↑ U. Stephani, G. Carlsson: The spectrum from BCECTS to LKS: The Rolandic EEG Trait – Impact on Cognition. In: Epilepsia. 47, Suppl 2, 2006, S. 67–70. PMID 17105466.
- ↑ O. M. Debus, G. Kurlemann: Sulthiame in the primary therapy of West syndrome. In: Epilepsia. 45, 2004, S. 103–108. PMID 14738417.
- ↑ M. J. Koepp, P. N. Patsalos, J. W. Sander: Sulthiame in adults with refractory epilepsy and learning disability: an open trial. In: Epilepsy Res. 50, 2002, S. 277–282. PMID 12200218.
- ↑ P. Huppke, K. Kohler, K. Brockmann u. a.: Treatment of epilepsy in Rett syndrome. In: Eur J Paediatr Neurol. 11 2007, S. 10–16. PMID 17178248.
- ↑ M. Madeja, C. Wolf, E. J. Speckmann: Reduction of voltage-operated sodium currents by the anticonvulsant drug sulthiame. In: Brain Res 2001. 900, S. 88–94. PMID 11325350.
- ↑ W. Wirth, F. Hoffmeister, H. Friebel, S. Sommer: Zur Pharmakologie des N-(4'-sulfamylphenyl)-butansultam-(1,4). In: Dt Med Wschr. 50, 1960, S. 2195–2199.
- ↑ H. Doose: Typische Rolandische Epilepsie. In: Königsteiner Arbeitskreis: Standardtherapien der Epilepsien im Kindes- und Jugendalter. In: Epilepsie-Blätter. 5, 1992, S. 53–54.
- ↑ Registry of Toxic Effects of Chemical Substances. 7. Auflage. US Dept of Health, Education, and Welfare. Cincinnati 1977.
- ↑ G. Stockdill, A. R. Lorimer: Sulthiame Overdosage. In: Br J Clin Pract. 25, 1971, S. 33. PMID 4397483.
- ↑ G. J. Rockley: Attempted suicide with sulthiame. In: British Medical Journal. 2, 1965, S. 632. PMID 14331626.
- ↑ K. F. Ahrend, L. Nagy, D. Tiess: Zur Morphologie und Analytik der Sultiam-Intoxikation. In: Archiv für Toxikologie. 25, 1969, S. 229–237. PMID 4393635.
- ↑ L. J. Mykyta: A case of sulthiame overdosage. In: Med J Austr. 20, 1968, S. 118–119. PMID 4386132.
- ↑ K. Hruby, A. Donner, U. Jäger: Akute Selbstvergiftungen mit Antiepileptika. In: Intensivmedizin. 22, 1985, S. 168–171.
- ↑ J. M. Hansen, M. Kristensen, L. Skovsted: Sulthiame (Ospolot) as inhibitor of diphenylhydantoin metabolism. In: Epilepsia. 9, 1968, S. 17–22. PMID 4386877.
- ↑ J. R. Green, A. S. Troupin, L. M. Halperm u. a.: Sulthiame: Evaluation as an anticonvulsant. In: Epilepsia. 15, 1974, S. 329–349. PMID 4153094.
- ↑ H. Doose, W. K. Baier, J. P. Ernst u. a.: Benign partial epilepsy – treatment with sulthiame. In: Dev Med Child Neurol. 30, 1988, S. 683–684. PMID 2906619.
- ↑ D. Rating, C. Wolf, T. Bast: Sulthiame as monotherapy in children with benign childhood epilepsy with centrotemporal spikes: a 6-month randomized, double-blind, placebo-controlled study. In: Epilepsia. 41, 2000, S. 1284–1288. PMID 11051123.
- ↑ G. Wohlrab: Epilepsiebehandlung im Kindes- und Jugendalter: Kontinuität und Wandel. ( vom 6. Juli 2011 im Internet Archive) (PDF; 392 kB) In: Epileptologie. 20, 2003, S. 25–30.


 French
French Deutsch
Deutsch