Trinitrobenzol – Wikipedia
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Trinitrobenzol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H3N3O6 | |||||||||||||||
| Kurzbeschreibung | farblose rhombisch-bipyramidale Blättchen[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 213,11 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 1,76 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | 315 °C[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
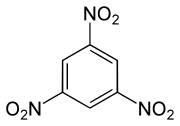
Trinitrobenzol (TNB) ist ein Sprengstoff. Es besteht aus einem Benzolring mit drei Nitrogruppen (–NO2) als Substituenten. Es gibt drei Konstitutionsisomere des TNB (1,2,3-, 1,2,4- und 1,3,5-Trinitrobenzol), die Abkürzung wird jedoch meist für das 1,3,5-Isomer verwendet. Die Sprengkraft von TNB ist vergleichbar mit der von Trinitrotoluol (TNT). Trotz einer leicht höheren Sprengkraft als TNT wird TNB aus wirtschaftlichen Gründen nicht genutzt.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Herstellung von Trinitrobenzol erfolgt durch Nitrierung von m-Dinitrobenzol mit einem Gemisch aus rauchender Salpetersäure und konzentrierter Schwefelsäure, der sogenannten Nitriersäure.[5] Ebenfalls möglich ist die Darstellung aus 2,4,6-Trinitrotoluol, wobei nach einer Oxidation zu 2,4,6-Trinitrobenzoesäure mit Kaliumdichromat und Schwefelsäure eine Decarboxylierung in kochendem Wasser folgt.[6][7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Trinitrobenzol tritt in fünf polymorphen Formen auf. Die thermodynamisch stabile Form I schmilzt bei 125,3 °C mit einer Schmelzenthalpie von 15,0 kJ·mol−1. Die metastabilen Formen II und III zeigen Schmelzpunkte bei 107,2 °C und 109,8 °C mit Schmelzenthalpien von 14,8 kJ·mol−1 bzw. 13,2 kJ·mol−1. Beide Formen stehen monotrop zu Form I. Die Formen II und III stehen enantiotrop zueinander. Der Umwandlungspunkt zwischen Form II und III liegt bei etwa 97 °C.[3] Zwei weitere Formen mit Schmelzpunkten bei 109 °C und 88 °C konnten bisher nur thermomikroskopisch beobachtet werden.[8]
Die Verbindung ist beständig gegen Säuren und reagiert mit Basen. Es ist unlöslich in Wasser, wenig löslich in Alkohol, Ether und Benzol, gut löslich in Aceton oder Ethylacetat. Mit polycyclischen, aromatischen Kohlenwasserstoffen wie Naphthalin, Anthracen und Carbazol werden Charge-Transfer-Komplexe gebildet. Die stöchiometrischen 1:1-Komplexe zeigen definierte Schmelzpunkte, wie mit Naphthalin bei 157,6 °C, mit Anthracen bei 165,4 °C und mit Carbazol bei 204,4 °C.[3]
Die Verbindung übertrifft Trinitrotoluol hinsichtlich der Sprengkraft.[5] Wichtige Explosionskennzahlen sind:
Bildungsenergie −134,5 kJ·kg−1[5] Bildungsenthalpie −204,3 kJ·kg−1[5] Sauerstoffbilanz −56,3 %[5] Stickstoffgehalt 19,72 %[5] Normalgasvolumen 939 l·kg−1[5] Explosionswärme 3927 kJ·kg−1 (H2O (l))
3845 kJ·kg−1 (H2O (g))[5]Spezifische Energie 1051 kJ·kg−1 (107,1 mt/kg)[5] Bleiblockausbauchung 32,5 cm3·g−1[5] Detonationsgeschwindigkeit 7300 m·s−1 bei einer Dichte von 1,6 g·cm−3[5] Schlagempfindlichkeit 7,4 Nm[5] Reibempfindlichkeit bis 353 N Stiftbelastung keine Reaktion
Verwendung
[Bearbeiten | Quelltext bearbeiten]TNB ist etwas schlagempfindlicher als TNT, was aber bei der Anwendung nicht ins Gewicht fallen würde. Aufgrund der aufwendigeren Herstellung ist es bedeutend teurer als TNT und wird daher nicht praktisch verwendet.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu 1,3,5-Trinitrobenzol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. November 2014.
- ↑ a b c d e f Eintrag zu 1,3,5-Trinitrobenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Februar 2018. (JavaScript erforderlich)
- ↑ a b c d e M. Radomska; R. Radomski: Calorimetric studies of binary systems of 1,3,5-trinitrobenzene with naphthalene, anthracene and carbazole. I. Phase transitions and heat capacities of the pure components and charge-transfer complexes, in: Thermochim. Acta, 40 (1980), S. 405–424 (doi:10.1016/0040-6031(80)80082-7).
- ↑ Eintrag zu 1,3,5-trinitrobenzene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b c d e f g h i j k l J. Köhler, R. Meyer, A. Homburg: Explosivstoffe, 10. vollständig überarbeitete Auflage, Wiley-VCH, Weinheim 2008, S. 330, ISBN 978-3-527-32009-7.
- ↑ H. T. Clarke, W. W. Hartman: 2,4,6-Trinitrobenzoic Acid In: Organic Syntheses. 2, 1922, S. 95, doi:10.15227/orgsyn.002.0095; Coll. Vol. 1, 1941, S. 543 (PDF).
- ↑ H. T. Clarke, W. W. Hartman: 1,3,5-Trinitrobenzene In: Organic Syntheses. 2, 1922, S. 93, doi:10.15227/orgsyn.002.0093; Coll. Vol. 1, 1941, S. 541 (PDF).
- ↑ A. Koffler; M. Brandstätter: Zur isomorphen Vertretbarkeit von H, OH, Cl: s-Trinitrobenzol, Pikrinsäure, Pikrylchlorid, in: Monatshefte für Chemie, 1948, 78, S. 65–70 (doi:10.1007/BF00942489).


 French
French Deutsch
Deutsch


