Aciloína , la enciclopedia libre

Las Aciloínas o α-hidroxicetonas[1] son una clase de compuestos orgánicos que se caracterizan porque poseen un sustituyente hidroxilo vecino al carbonilo de un grupo de cetona. El nombre ''aciloína'' está derivado del hecho que son formalmente derivados de condensación de dos grupos acilo (condensación aciloínica).[1]
Síntesis
[editar]Las reacciones orgánicas clásicas para la síntesis de aciloínas son:
- La condensación aciloínica (acoplamiento radicalario reductivo de dos ésteres carboxílicos).
- La condensación benzoínica catalizado por nucleófilos especiales., por ejemplo el anillo tiazólico de la tiamina.
- La oxidación de carbonilos es posible con dioxígeno pero no es selectiva.
- La oxidación correspondiente de dos silil enol éteres con ácido meta-cloroperbenzoico (mCPBA) de acuerdo a la oxidación de Rubottom.
- La oxidación con MoOPH de los carbonilos es un sistema con peróxido de molibdeno, piridina y hexametilfosforamida.
Oxidación de enolatos por sulfoniloxaziridinas
[editar]Los Enolatos pueden ser oxidizadas por sulfoniloxaziridinas.[2][3] El enolato reacciona por sustitución nucleofílica en el anillo oxaziridínico del oxígeno deficiente en densidad electrónica .
Este tipo de reacción está extendido a síntesis asimétrica por el uso de oxaziridinas quirales derivadas del alcanfor (canforsulfonil oxaziridina). Cada isómero da acceso exclusivo a uno del dos posibles enantiómeros. Esta modificación está aplicada en la síntesis total del taxol de Holton .
En la oxidación del enolato de la ciclopentaenona con cualquier enantiómero del alcanfor, el isómero trans está obtenido ya que el acceso para el sustituyente hidroxílico al grupo en la posición cis está limitada.[4] El uso de la oxaziridina estándar no produce en un aciloína.
Reacciones
[editar]- Reducción de aciloínas para formar 1,2-dioles.
- Oxidación de aciloínas para formar 1,2-dionas (diacetilos).
- La tautomería ceto enol de las aciloínas forma enodioles en la transposición de Lobry–de Bruyn–van Ekenstein.
- La aminación de Voigt [5] consiste en la reacción de una aciloína con una amina primaria y pentoxido de fósforo a un α-ceto amina:[6]
- En la síntesis de indoles de Bischler–Möhlau[7]
- Los α-hidroxialdehídos (como el glicolaldehído y el lactaldehído) y los ácidos α-hidroxicarboxílicos (como el ácido glicólico y el ácido láctico) y sus ésteres tienen un comportamiento químico similar.
Referencias
[editar]- ↑ a b Unión Internacional de Química Pura y Aplicada. «acyloins». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ Davis, Franklin A.; Vishwakarma, Lal C.; Billmers, Joanne G.; Finn, John (1984). «Synthesis of α-hydroxycarbonyl compounds (acyloins): direct oxidation of enolates using 2-sulfonyloxaziridines». J. Org. Chem. 49 (17): 3241-3243. doi:10.1021/jo00191a048.
- ↑ Davis, F. A.; Haque, M. S.; Ulatowski, T. G.; Towson, J. C. (1986). «Asymmetric oxidation of ester and amide enolates using new (camphorylsulfonyl)oxaziridines». J. Org. Chem. 51 (12): 2402. doi:10.1021/jo00362a053.
- ↑ a b Hughes, Chambers C.; Miller, Aubry K.; Trauner, Dirk (2005). «An Electrochemical Approach to the Guanacastepenes». Org. Lett. 7 (16): 3425-3428. PMID 16048308. doi:10.1021/ol047387l. Archivado desde el original el 4 de septiembre de 2006.
- ↑ von Meyer, E.; Voigt, Karl (1886). «Ueber die Einwirkung von primären aromatischen Aminen auf Benzoïn» [On the effect of primary aromatic amines on benzoin]. J. Prakt. Chem. (en alemán) 34 (1): 1-27. doi:10.1002/prac.18860340101.
- ↑ Lawrence, Stephen A. (2004). Amines: Synthesis, Properties and Applications. Cambridge University Press. ISBN 978-0-521-78284-5.
- ↑ Roth, Lepke (1972). «Synthese von Indol- und Carbazol-Derivaten aus α-Hydroxyketonen und aromatischen Aminen» [Synthesis of indole and carbazole derivatives from α-hydroxyketones and aromatic amines]. Archiv der Pharmazie (en alemán) 305 (3): 159-171. doi:10.1002/ardp.19723050302.


 French
French Deutsch
Deutsch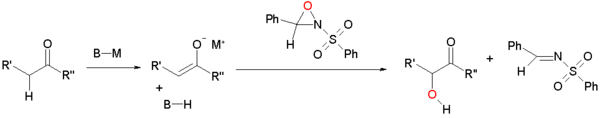

![Enolate Ejemplo de oxidación[4]](http://upload.wikimedia.org/wikipedia/commons/thumb/0/02/Acyloin_example_Hughes.png/500px-Acyloin_example_Hughes.png)
