Espermatogénesis , la enciclopedia libre

La espermatogénesis es el largo proceso por el cual se producen los espermatozoides a partir de las células germinales primordiales del macho (espermatogonias), mediante mecanismos de mitosis y meiosis. Este proceso de formación del espermatozoide (o gametogénesis), se desarrolla en los testículos del macho, pero la maduración final se lleva a cabo en el epidídimo.
Las células implicadas en la espermatogénesis comienzan este proceso con una dotación cromosómica diploide (2n), y terminan con una dotación haploide (n) en el espermatozoide, la célula reproductora masculina (gameto), destinada a la fecundación del óvulo.
Historia
[editar]Los espermatozoides fueron observados por primera vez en el semen por Anton van Leeuwenhoek en el año 1677. Años más tarde, en 1697, Nicolás Hartsocker propuso la teoría del homúnculo, la cual pretendía dar una explicación al origen del ser humano, encontrándose una persona minúscula dentro de la cabeza del espermatozoide. Casi un siglo más tarde, en 1780, Lazzaro Spallanzani sugirió que los espermatozoides eran los responsable del éxito de la inseminación, con base en los experimentos que realizó en perros.
No fue, sin embargo, hasta la llegada de la teoría celular, y por tanto, el descubrimiento de la naturaleza celular de los espermatozoides que se comenzó a estudiar de forma eficaz el desarrollo de las células reproductivas masculinas. El término espermatozoide aparece en 1827 por primera vez, sin embargo, no está del todo claro quién fue el primero en pronunciar la idea de que los espermatozoides provenían de células testiculares. Koelliker (1841), quien colectó la primera evidencia notable acerca de este tema, mantuvo que fue Rudolph Wagner, puesto que él examinó los fluidos frescos provenientes de los túbulos testiculares en mamíferos, y los observó bajo el microscopio evidenciando gránulos peculiares o chimbolicos de formas y tamaños muy variables. Wagner también observó Samenthierchen, o animáculos de esperma, espermatozoides, sintiéndose seguro de que los varios tipos de esférulas vistos con anterioridad eran estados anteriores al espermatozoide. Su trabajo, en el que la palabra célula no ocurre ni una sola vez, es característico del tipo de concepto de formación que precedió inmediatamente a la teoría celular.
Años más tarde, Albert Koelliker presenta un tratado tras varios años de investigación, en el que enseña por primera vez los aspectos fundamentales concernientes a la espermatogénesis:
- En el semen de todos los animales, con algunas excepciones, se hallan partículas con motilidad.
- Los espermatozoides son la parte esencial del semen.
- Los espermatozoides se desarrollan individualmente en paquetes a partir de células que se han formado en momentos de madurez sexual o de actividad testicular a través de procesos análogos al desarrollo celular, pero significativamente diferentes del desarrollo cigótico de los animales.
- Las formas de los espermatozoides son bastante limitadas en variedad. Usualmente son similares dentro de géneros, y frecuentemente también dentro de clases y familias. Cada animal parece poseer solo un tipo de espermatozoide, con solo algunas excepciones.
Bajo estas conclusiones y un par más, Koelliker deja claro que la visión del espermatozoide como condición primaria de un animal en desarrollo, sostenida por Leeuwenhoek y muchos otros, debía ser abandonada.
A partir de ese momento, las investigaciones acerca de la espermatogénesis comenzaron a avanzar con mucha más rapidez y eficiencia.[cita requerida]
Finalmente, el descubrimiento más importante en este campo y el de los tejidos espermatogénicos fue la demostración de las «células de soporte», en los túbulos seminíferos, hecha por Enrico Sertoli en 1865. En 1878 Sertoli establece la estructura del túbulo seminífero y las células que lo componen; así como el origen de los espermatozoides en las células redondas (espermatogonias).[1][2]
Las corrientes de investigación actuales están predominantemente orientadas a la resolución de problemas humanos en el sentido más amplio de la palabra, y es llevada a cabo por especialistas en los campos médicos y paramédicos actuales, aun así, en el presente, es de suma importancia mantener la significancia biológica de este tema de manera firme en mente.[cita requerida]
La espermatogénesis o espermatocitogénesis (meiosis) y la espermiogénesis o espermiohistogénesis (formación estructural del espermatozoide) son los dos procesos que engloba la espermatogénesis. Primero se forman las células haploides y después se forman los espermatozoides. La duración no es regular, es decir, la meiosis tiene una duración mucho menor que la espermiogénesis.[cita requerida]
Ubicación
[editar]
La espermatogénesis se lleva a cabo en las células que forman el epitelio germinativo, dentro de los túbulos seminíferos, pequeños conductos enrollados de 0,2 milímetro (mm) de diámetro. Los dos testículos contienen alrededor de mil túbulos seminíferos.[cita requerida]
Este proceso se activa por la acción de la hormona liberadora de gonadotropina (GnRH) que se libera en el hipotálamo.
La espermatogénesis tiene una duración aproximada de 62 a 75 días en la especie humana y consta de tres fases o etapas: mitosis o espermatocitogénesis, meiosis y espermiogénesis o espermatohistogénesis.
Por tanto, espermatogénesis es el proceso completo y la espermiogénesis es el último paso de esta, en la que se produce la maduración de espermátida a espermatozoide.
Espermatogénesis o espermatocitogénesis
[editar]
Los espermatozoides son células haploides, es decir tienen la mitad de los cromosomas de las células somáticas, ellos son muy diferenciados y son móviles cuando maduran. La reducción de cromosomas en ellos se produce mediante una división celular peculiar, la meiosis, en la cual una célula diploide (2n) llamada gonia, experimentará dos divisiones celulares sucesivas con la capacidad de generar cuatro células haploides (n) llamados zoides. En este proceso es necesario pasar de unas células diploides, inmóviles e indiferenciadas las espermatogonias, a otras haploides, muy diferenciadas y móviles los espermatozoides.
Un importante hecho a resaltar, es que mientras las divisiones reduccionales de la meiosis se conservan en cada reino eucariota, la regulación de la meiosis en mamíferos se diferencia dramáticamente entre machos y hembras; entre estas diferencias, se encuentran seis:
- Meiosis iniciada continuamente a partir de las poblaciones de células madre correspondientes.
- Cuatro gametos producidos por ciclo mientras que en la ovogénesis es solo uno (un óvulo funcional y tres cuerpos polares).
- Meiosis completada en días o incluso semanas
- La meiosis y diferenciación se produce continuamente sin bloqueo del ciclo celular.
- La diferenciación de gametos ocurre bajo un precursor haploide, luego de que la meiosis termina.
- Los cromosomas sexuales son excluidos de recombinación y transcripción durante la primera profase meiótica.


La espermatogénesis, en la especie humana, se produce en ondas a todo lo largo de los túbulos seminíferos, por lo que zonas adyacentes del mismo túbulo muestran espermatocitogénesis y espermiogénesis en diversas fases. Así, el proceso comienza cuando las células indiferenciadas de los túbulos seminíferos de los testículos se multiplican. Para que la espermatogénesis se lleve a cabo de forma sincronizada, se establecen entre las células puentes de citoplasma que permiten que todas las células que se localizan en el mismo corte transversal del túbulo seminífero se desarrollen a la vez y las señales de diferenciación no afecten a células diferentes.
Estas células germinales dan lugar a células madre de los espermatogonios, a partir de las cuales surgen las células que se diferenciarán a espermatocitos primarios tras la mitosis correspondiente de las células de tipo A. Las espermatogonias de tipo A, entonces, a través de repetidos ciclos de mitosis producen nuevas espermatogonias y mantienen así la reserva celular. Estas células se caracterizan por poseer un gran núcleo redondo u oval de cromatina condensada, en el que puede encontrarse el núcleo periférico y una vacuola nuclear. La producción de espermatogonias de tipo A marca el inicio de la espermatogénesis, donde todas estas células son diploides.
Existen varios tipos de espermatogonias tipo A según el aspecto de sus núcleos celulares:
- Espermatogonias oscuras Ad, las cuales solo se dividen cuando tiene lugar una reducción drástica de espermatogonias, y además se cree que estas células representan las células madre del sistema y que su división mitótica produce más células de tipo Ad y algunas de tipo Ap.
- Espermatogonias pálidas Ap, las cuales dan lugar a más espermatogonias del mismo tipo o a espermatogonias de tipo B. Las primeras, dan lugar a células hijas unidas entre sí por puentes citoplasmáticos, mientras que las segundas se originan por maduración de las primeras.
Las espermatogonias de tipo B se dividen por mitosis produciendo más células de su tipo; estas células maduran por grupos de unas 100 espermatogonias produciendo espermatocitos primarios y finalmente espermatozoides; también cabe resaltar que las espermatogonias de este tipo se caracterizan por carecer de una vacuola nuclear. No se conoce aún qué causa que este tipo de espermatogonias siga el camino hacia la diferenciación celular, antes que el de auto-renovación; tampoco es conocido qué estimula a estas células para entrar en división meiótica en vez de división mitótica.
La espermatogénesis o gametogénesis masculina es un proceso que se da cuando el individuo llega a la madurez sexual, es decir, cuando se inicia la etapa de la pubertad. Este proceso está regulado principalmente por la sobre expresión de la proteína BMP8b la cual es necesaria para la iniciación y el mantenimiento de las células madre de la línea germinal. Esta proteína es sintetizada en las espermatogonias. El proceso empieza cuando se da una sobre expresión de BMP8b. Los túbulos seminíferos que hasta el momento se encontraban cerrados, se abren en esta etapa.
En general el proceso de espermatogénesis dura alrededor de dos meses y consta básicamente de 4 etapas.
- La primera se llama fase de proliferación. En esta se da la multiplicación de las células germinales por medio de mitosis y el resultado son las espermatogonias (2n).
- La segunda fase es la de crecimiento. Las espermatogonias de tipo B aumentan de tamaño y se transforman en espermatocitos de primer orden que migran al compartimiento adluminal del túbulo seminífero antes de comenzar la primera división meiótica mientras siguen siendo diploides.
- La tercera fase se conoce como la fase de maduración. Cada espermatocito sufre su primera división meiótica, lo cual da como resultado dos espermatocitos de segundo orden (n). Posteriormente estos sufren la segunda división meiótica a partir de la cual surgen dos espermátidas (n).
- Finalmente, se da la última etapa que se conoce como la espermiogénesis en las que las espermátidas se vuelven espermatozoides. Para que esto ocurra, se da un proceso de diferenciación en el que por un lado, el núcleo se va hacia uno de los polos celulares, y por el otro lado, el centrosoma da lugar por medio de una división a dos centriolos. Uno de estos centriolos que se sitúa cerca al núcleo, forma la placa basal. Mientras que el otro, que se sitúa más lejos del núcleo, da lugar al filamento axial.
Estas células se reconocen fácilmente por sus abundantes citoplasmas y sus grandes núcleos, que contienen grumos gruesos o finas hebras de cromatina; además, también están unidas por un puente citoplasmático conspicuo como se mencionó con anterioridad que regula el proceso de división de forma que todas las células involucradas reciban la señal de hacer meiosis a la vez mediante diferentes iones o moléculas; dichas uniones citoplasmáticas solo se romperán una vez los espermatozoides sean liberados en la luz del túbulo seminífero. Así, es en estas células donde sucede la meiosis por primera vez: La meiosis I dará lugar a dos espermatocitos de segundo orden; estos espermatocitos secundarios son entonces más pequeños, y progresan con rapidez a la segunda división meiótica, por lo que rara vez son visibles. Tras la meiosis II resultarán cuatro espermátidas (gracias a la meiosis de una célula diploide surgen cuatro células haploides (gametos)).

En los túbulos seminíferos podemos encontrar grupos de células en los distintos estadios de maduración descritos. Estos grupos pueden alcanzar hasta las 100 células en sincronía, distribuyéndose helicoidalmente a lo largo de túbulo. No obstante, nunca podremos observar todos los estadios al mismo tiempo. Este fenómeno se conoce como onda espermatogénica.
Espermiogénesis o espermiohistogénesis
[editar]Los gametos así producidos siguen el proceso de maduración conocido como espermiogénesis, donde en dicha fase las espermátidas se convierten en espermatozoides; para ello, se reduce el citoplasma, el núcleo de la célula se alarga, queda en la cabeza del espermatozoide generando la forma puntiaguda característica de este tipo de células y finalmente se forma el flagelo que permite el movimiento.
Por tanto, se trata de la última fase de la espermatogénesis, en la que tiene lugar la maduración de las espermátidas hasta adquirir las estructuras morfológicas del espermatozoide. Este proceso se lleva a cabo en cuatro eventos que ocurren simultáneamente:
- Condensación del núcleo: Se hace pequeño, denso y con forma aplastada. El ADN se compacta en esta etapa por la acción de unas proteínas denominadas protaminas.
- Formación del acrosoma: Se posiciona en el extremo apical, y aparece rodeado por dos membranas, una externa y otra interna. El acrosoma es un lisosoma especializado que contiene principalmente hialuronidasa. Esta enzima se encarga de degradar el ácido hialurónico que aparece como miembro integrante de las células de la granulosa, permitiendo por tanto eliminar las capas celulares por disgregación de las mismas que rodean al ovocito. Esta enzima es de vital importancia en ICSIs en los que es necesario acceder al ovocito a través de las capas de la granulosa para inyectar intracitoplasmáticamente el pronúcleo masculino.
La capa de células de la granulosa es una masa que rodea al ovocito y puede ser eliminada con hialuronidasa (proceso de decumulación). Con ello se puede determinar el estado de maduración en el que se encuentra el ovocito. No obstante, este a su vez presenta una capa pelúcida que lo rodea.
Podemos saber si el ovocito es maduro o no en función de si presenta corpúsculo polar. Si es maduro, la ovogonia ha completado la metafase II, lo que implica la formación del corpúsculo polar y del ovocito maduro; en cambio si el corpúsculo polar no aparece es porque la ovogonia se encuentra todavía retenida en la metafase II y por tanto el ovocito todavía es inmaduro y no se puede fecundar. Posteriormente se produce la atresia (degradación del corpúsculo polar).
- Formación del flagelo: Se desarrolla a partir del centriolo distal y constituye un cilindro de 9 microtúbulos dobles que rodea dos únicos centrales (estructura 9+2). Durante la rotación del núcleo se dispone en la base de la cabeza. El flagelo completo consta de cuello, pieza media, pieza principal y pieza final. Los centriolos del espermatozoide cumplen un papel esencial en la fecundación. Esto se debe a que el ovocito carece de centriolos. Por tanto, cuando tiene lugar la fecundación, en primer lugar el cigoto presenta un pronúcleo masculino paterno y un pronúcleo femenino materno. Posteriormente ambos pronúcleos se fusionan y se genera una célula diploide que se divide inmediatamente. Para que esta división pueda tener lugar es necesario un posicionamiento de los cromosomas tanto materno como paterno de forma ordenada en lo que se denomina la placa metafásica. Este posicionamiento solamente puede tener lugar si están presentes los centriolos y además funcionan correctamente. Cuando los centriolos no son capaces de polimerizar los microtúbulos, o estos son inestables se generan alteraciones cromosómicas estructurales, dando lugar a aneuploidías.
- Reducción del citoplasma: El citoplasma de la espermátida es fagocitado por las células de Sertoli o se abandona en el interior de los túbulos. Puede permanecer unido al espermatozoide cierto tiempo. Además, dichas células de Sertoli forman la barrera hematotesticular (que no deja pasar ningún tipo de célula inmunogénica).
Así, los espermatozoides presentan tres zonas bien diferenciadas: la cabeza, el cuello y la cola. La primera es la de mayor tamaño, contiene los cromosomas de la herencia y lleva en su parte anterior un pequeño saliente o acrosoma cuya misión es perforar las envolturas del óvulo. En el cuello se localiza el centrosoma y las mitocondrias, y el flagelo, que se origina a partir de los centriolos, es el filamento que se encarga de generar la motilidad que le permite al espermatozoide «nadar» hasta el óvulo para fecundarlo.
El examen de los distintos cortes de los túbulos de un testículo normal demuestra que alrededor de la mitad de las células espermatogénicas se encuentra en estadio de espermátide tardía.
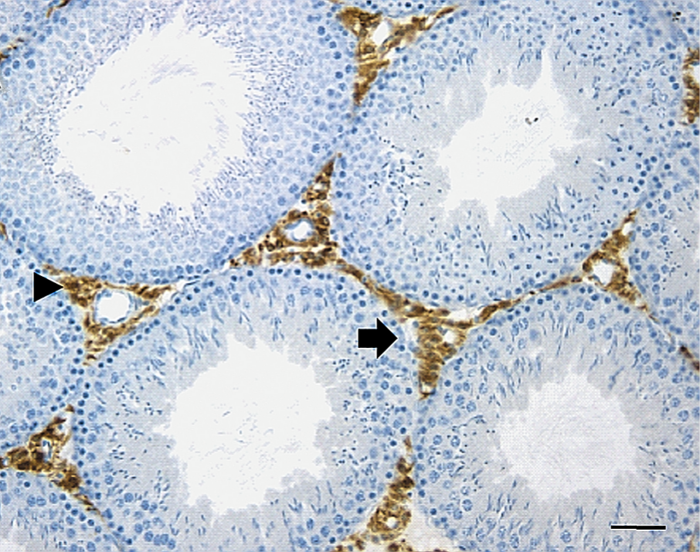
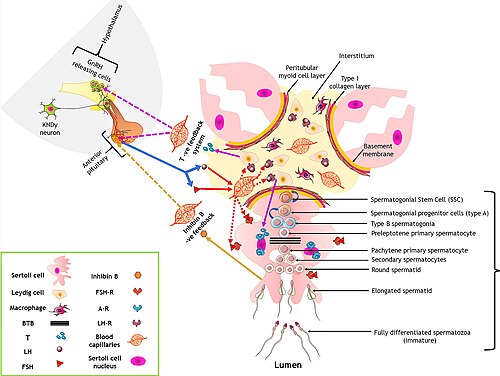
Las células de Sertoli representan un componente de gran importancia en la regulación de la espermatogénesis. Durante el proceso de desarrollo, estas células cuyos núcleos suelen encontrarse desde la membrana basal hasta la luz de los túbulos seminíferos forman la barrera hematotesticular. El núcleo de las células tiene una forma triangular u oval típica, con un núcleo prominente y cromatina dispersa.
La capa basal de las células germinales se adosa a la membrana basal, rodeada por una lámina propia en la que existen varias capas de miofibroblastos y fibroblastos fusiformes. Se forman uniones íntimas, tanto entre las mismas células, como estas con las células germinales en desarrollo. Se sabe que para la producción y maduración de las células espermatogénicas es esencial que existan concentraciones elevadas de hormonas androgénicas secretadas por las células de Leydig del mesotelio reticular. Las células de Sertoli secretan una proteína captadora de andrógenos que transporta la testosterona y la dihidrotestosterona hacia la luz del túbulo seminífero. Dichas hormonas son también necesarias para la función del epitelio de la rete testis y del epidídimo; la producción de esta proteína de unión parece depender de una gonadotropina hipofisaria, la hormona estimulante del folículo (FSH).
Un ciclo espermatogénico tiene una duración aproximada de 2 meses. Las espermatogonias están en mitosis durante 16 días, dando lugar a los espermatocitos primarios. Estos tardan 24 días en completar la primera meiosis y dar lugar a los espermatocitos secundarios, los cuales tardarán horas en convertirse en espermátides. Las espermátides tienen que diferenciarse, como se ha comentado anteriormente, tardando otros 24 días para ese proceso.
Onda de espermatogénesis
[editar]La diferenciación de espermátida a espermatozoide ocurre dentro de los testículos. Durante su maduración en el testículo, los espermatozoides sufren un proceso de producción continuo conocido como oleada de producción espermática u oleada u onda de producción espermatogénica (spermatogenic wave). Los espermatozoides van adquiriendo distintos grados de maduración y estos grados van por oleadas, es decir, en grupos que tienen las mismas etapas de maduración. No obstante, en una misma sección del túbulo no se verán todas las etapas de maduración. Ocurre de forma helicoidal, de modo que en el borde del túbulo y al comienzo de la espiral se encuentra la espermatogonia; y, al final de la espiral, los espermatozoides completamente desarrollados se encuentran en el lumen.
La Onda del tejido germinal representa la evolución topográfica a lo largo del túbulo seminífero. En el hombre, cada uno de los seis estados del ciclo espermatogénesis ocupa un pequeño segmento de la pared del túbulo. En las secciones transversales de los túbulos es frecuente la aparición de 3 o más estados del ciclo.[3][4]
Una vez que salen del testículo, los espermatozoides se quedan en el epidídimo. Respecto al epidídimo, es el responsable del proceso de maduración y activación de la motilidad, así como de la acumulación de la mayor parte de espermatozoides en su porción final. Posteriormente, estos se acumulan en los conductos deferentes, antes de la eyaculación.
Si sumamos todo obtenemos unos 64 días desde el paso de espermatogonias hasta espermatozoides.
Obtienen el acrosoma, un estilo de casco en el espermatozoide que contiene enzimas, y una glicolema (capa), que la protege del pH ácido existente en la vagina.
Efecto de la temperatura en la espermatogénesis
[editar]El testículo es una glándula secretora suspendida en una bolsa suelta de piel, denominada bolsa escrotal. Esta bolsa tiene su superficie en contacto con el exterior del cuerpo, en lugar de estar rodeado por otros órganos. La desventaja de su desprotección se ve compensada por una temperatura aproximadamente 3 °C inferior que el caso contrario. Esto es importante porque la actividad enzimática de las polimerasas que participan en la espermatogénesis es óptima a una temperatura de aproximadamente 34 °C. Por este motivo, patologías que impidan el correcto descenso de los testículos (por ejemplo, criptoquidia o una hernia inguinal) afectarán a la espermatogénesis y, por tanto, supondrán un factor de riesgo de sufrir infertilidad.
Por tanto, se concluye que en la mayoría de los mamíferos la temperatura corporal interna, tiene un efecto inhibitorio sobre la espermatogénesis, al afectar a los siguientes factores:
- Bloqueo de la maduración de las espermatogonias a la temperatura corporal.
- La β-polimerasa y la recombinasa espermatogénica tienen una temperatura óptima de funcionamiento ligeramente inferior (1-3 °C) a la temperatura corporal. Temperaturas superiores a la óptima inhibe su actividad notablemente.
- El escroto no contiene grasa y sus músculos reaccionan a la temperatura extendiéndose o contrayéndose gracias al sistema venoso-arterial. Así por ejemplo, una temperatura externa sumamente fría activa mecanismos de vasoconstricción, permitiendo que los testículos se peguen al cuerpo y así entren en calor.
Debido a este efecto inhibitorio, procesos fisiopatológicos como la fiebre, que aumentan la temperatura corporal, van a afectar a todo el proceso de la espermatogénesis. Al ser la duración de la espermatogénesis de unos 72 días, las consecuencias del efecto inhibitorio se van a alargar durante todo este periodo de tiempo.[cita requerida]
Los procesos reproductivos son de elevada actividad metabólica, por lo que pueden verse afectados por las condiciones climáticas. El estrés calórico produce efectos negativos sobre la gametogénesis y sobre la función del eje neuroendocrino.[5]
Periodo embrionario
[editar]Una vez las células germinales llegan a la cresta germinal del embrión masculino, se incorporan a los cordones sexuales, donde se mantendrán hasta la madurez, y perforarán a fin de formar un orificio pasante que corresponderá a los tubulos seminiferos, y el epitelio de dichos túbulos se diferenciará en células de Sertoli.
La formación de espermatogonias comienza alrededor del día 24 del desarrollo embrionario en la capa endodérmica del saco vitelino. Aquí se producen unas 100 células germinales que migran hacia los esbozos de los órganos genitales. Alrededor de la cuarta semana ya se acumulan alrededor de 4000 de estas células, y el gen SRY determina que formen los testículos para poder producir espermatozoides, aunque este proceso no empezará hasta la pubertad. Hasta entonces, las células germinales se dividen por mitosis.[cita requerida]
Regulación hormonal
[editar]La regulación hormonal de la espermatogénesis se lleva a cabo por el eje hipotálamo-hipofisario-gonadal. Es un evento altamente coordinado, regulado por las células somáticas del testículo, células de Sertoli (Sc), células de Leydig (Lc) y células mioides peritubulares (PTc).[6]
La regulación hormonal se controla por un mecanismo de retroalimentación negativa, lo que quiere decir que el producto hormonal sintetizado por el tejido diana inhibe la liberación de los productos iniciales o intermedios del eje.
Las hormonas responsables de la regulación de la espermatogénesis son:
- GnRH u hormona liberadora de gonadotropina. Se libera en el hipotálamo y estimula la secreción de gonadotropinas (LH y FSH) por parte de la hipófisis.
- LH u hormona luteinizante. Se libera por la hipófisis en respuesta a la GnRH y actúa en las células de Leydig para que secreten testosterona.
- FSH u hormona estimulante de folículos. Se libera por la hipófisis en respuesta a la GnRH. Actúa en las células de Sertoli para que produzcan inhibina y en los túbulos seminíferos para estimular la producción de espermatozoides.[6]
- Testosterona Se sintetiza de manera pulsátil por las células de Leydig en respuesta a la LH. Se dirige a los túbulos seminíferos para ayudar en la síntesis de espermatozoides. Esta hormona es secretada además por la médula de la corteza suprarrenal, pero en menores cantidades, en comparación al testículo.
Además, el pico máximo de esta hormona se consigue a las 8 de la mañana, para después ir decayendo hasta la concentración mínima, lo que explica que los hombres sufran frecuentemente erección matutina.
En los hombres más jóvenes, los picos de testosterona son mayores que en los hombres de edad avanzada, por lo que sus niveles de testosterona varían más a lo largo del día.
Por un mecanismo de retroalimentación negativa, la testosterona inhibe la síntesis de gonadotropinas en la hipófisis y de GnRH en el hipotálamo.
- Inhibina. Es liberada por las células de Sertoli en respuesta a la FSH. Por un mecanismo de retroalimentación negativa, inhibe la liberación de gonadotrofinas en la hipófisis.[7]
- Estrógenos. Formados localmente por conversión de una parte de la testosterona en estradiol por acción de las aromatasas de las células de Sertoli, cuando son estimuladas por la hormona FSH.[7]
- Hormona del crecimiento. Es necesaria para controlar las funciones metabólicas básicas de los testículos. Promueve la división temprana de las espermatogonias. En su ausencia, como ocurre en el enanismo hipofisario, la espermatogénesis es muy deficiente o nula provocando esterilidad.
Eficiencia
[editar]El hecho de que tras la eyaculación se produzca una elevada pérdida de espermatozoides, junto con un número bastante elevado de espermatozoides malformados, convierte este mecanismo en un proceso redundante e ineficaz: de toda la capacidad espermatogénica potencial del testículo, tan sólo un 25 % consigue evitar la pérdida por apoptosis o degeneración. A su vez, la mayoría son malformados, motivo por el cual únicamente un 12 % de las células iniciales son potencialmente útiles.
A pesar de todo lo anterior, un varón fértil es capaz de producir eyaculados alrededor de 150 millones de espermatozoides varias veces por semana.
La ineficacia de la espermatogénesis es debida fundamentalmente a la ausencia de presión selectiva en la especie humana, y por ello los factores externos afectan mucho los parámetros seminales. La evolución ha impuesto que a mayor presión selectiva mayor eficacia presenta la espermatogénesis.[8]
Transporte del esperma
[editar]Los espermatozoides formados se transportan a través del testículo gracias a:
- Contracciones de los túbulos seminíferos.
- Aumento de la cantidad de líquido luminal y de la presión.
- Contracciones de la cápsula del testículo.
Véase también
[editar]Referencias
[editar]- ↑ Enrico Sertoli (2018). «The structure of seminiferous tubules and the development of [spermatids] in rats.». Biology of Reproduction (en inglés) (Oxford Academic) 99 (3): 482-503.
- ↑ Christopher B Geyer (2018). «A historical perspective on some “new” discoveries on spermatogenesis from the laboratory of Enrico Sertoli in 1878». Biology of Reproduction (en inglés) (Oxford Academic) 99 (3): 479-481. Consultado el 23 de abril de 2022.
- ↑ «Módulo 3: Spermatogenesis. 3.3: Local course of spermatogenesis -the spermatogenesis wave.». Embryology.ch. Consultado el 18 de enero de 2022.
- ↑ «Ciclo del Epitelio Seminífero». Histologia.uchile.cl. Consultado el 19 de enero de 2022.
- ↑ Castaño F.A.; Rugeles C.C.; Betancur C.A.; Ramirez-López C.J. (2014). «Impacto del Estrés Calórico sobre la actividad reproductiva en Bovinos y Consideraciones para Mitigar sus Efectos Sobre la Reproducción». Biosalud (Manizales) 13 (2). Consultado el 12 de mayo de 2024.
- ↑ a b Bhattacharya I.; Dey S.; Banerjee A. (2023). «Revisiting the gonadotropic regulation of mammalian spermatogenesis: evolving lessons during the past decade.». Frontiers in Endocrinology (Lausanne) (REVISIÓN). Sec. Reproduction 14: 1110572. PMC 10140312. PMID 37124741. doi:10.3389/fendo.2023.1110572. Consultado el 3 de junio de 2023.
- ↑ a b Guyton A.C. (2008). «80:Funciones reproductoras y hormonales masculinas (y función de la glándula pineal)». Tratado de fisiología médica (12a. edición). Elsevier. p. 979.
- ↑ Gilbert S.F. «19 Spermatogenesis». Developmental Biology (6th edición).
Bibliografía
[editar]- Scott F. Gilbert, Developmental Biology (6th Edition), cap 19 Spermatogenesis.
- Arthur C. Guyton, Tratado de fisiología médica, 12 edición, Ed. Elsevier, 2008.
- Human Embriology: Embryogenesis. Spermatogenesis: Local course of spermatogenesis - the spermatogenesis wave Archivado el 16 de septiembre de 2018 en Wayback Machine.
- Barbara Young, Wheater's Histología Funcional: Texto y Atlas en Color, Elsevier España, (2000)
- Alan Stevens, James Steven Lowe, Histología humana, Elsevier España, 2006
- Edward C. Roosen-Runge, Process of Spermatogenesis in Animal, CUP Archive, 1977


 French
French Deutsch
Deutsch