Hidrogel , la enciclopedia libre

El hidrogel se define como una red tridimensional de cadenas flexibles, constituida por unos elementos conectados de una determinada manera e hinchada por un líquido. Un organogel es aquel que contiene un disolvente orgánico y un hidrogel es un gel que contiene agua. Los hidrogeles son polímeros que poseen unas características particulares. Son hidrófilos, es decir afines al agua, así como blandos, elásticos y en presencia de agua se hinchan, aumentando considerablemente su volumen, pero manteniendo su forma hasta alcanzar un equilibrio físico-químico, mientras que en estado deshidratado (xerogel) son cristalinos. Los hidrogeles son sistemas en estado coloidal con apariencia sólida como la albúmina coagulada por el calor, la gelatina gelificada por enfriamiento, la agarosa, etc. Son muy absorbentes pero mantienen estructuras bien definidas. Estas propiedades sustentan varias aplicaciones, especialmente en el área biomédica. Muchos hidrogeles son sintéticos, pero algunos se derivan de la naturaleza.[1] El término "hidrogel" se acuñó en 1894.[2] Las características particulares de los hidrogeles son consecuencia de muchos factores, entre ellos, cabe destacar la presencia de grupos funcionales hidrófilos (como OH, COOH, CONH2, CONH, SO3H…) en su estructura molecular. Las fuerzas cohesivas que producen el entrecruzamiento del polímero no son sólo de carácter covalente; también intervienen otras fuerzas (las fuerzas intermoleculares), como por ejemplo, las electrostáticas, hidrófobas, interacciones dipolo-dipolo o enlaces de hidrógeno. Se ha comprobado que tanto el grado como naturaleza del entrecruzamiento, la tacticidad y la cristalinidad del polímero, son los responsables de las características que aparecen en el hinchamiento del hidrogel.[3] Los hidrogeles, debido a su biocompatibilidad, su estructura y propiedades, son cada vez más utilizados como biomateriales.[4]
Usos y aplicaciones
[editar]
La capacidad que poseen los hidrogeles de absorber de forma reversible grandes cantidades de agua proporciona la posibilidad de ser utilizados en un gran número de aplicaciones científicas y tecnológicas prácticas. Además de las aplicaciones en las que los hidrogeles sirven para mantener la humedad de la tierra cultivada, como materiales absorbentes, membranas, microcápsulas, soporte para catalizadores, recubrimientos, productos auxiliares para la industria del papel, ligantes de productos farmacéuticos, aislamiento y fragmentación de biopolímeros y análisis, destacan aquellas que podemos enmarcar dentro del campo de la biomedicina. Este uso implica una serie de requisitos adicionales como son biocompatibilidad con los tejidos, inalterabilidad frente a procesos degradativos, y obviamente, que presenten propiedades mecánicas adecuadas para cada uso.[5]
Aplicaciones biomédicas
[editar]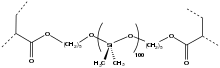
- Lentes de contacto: Para esta aplicación son precisos tres requisitos: la lente debe permitir la adecuada oxigenación de la córnea, es decir, debe ser permeable al oxígeno; además, el fluido lacrimal tiene que formar una película entre la córnea y la lente. Por último, dicha lente deberá resistir la fuerza del párpado para así evitar posibles inestabilidades visuales. Para la fabricación de las lentes de contacto se utilizó el polimetacrilato de metilo (PMMA) por sus excelentes propiedades ópticas, fácil manejo, mecanización y pulido, y su excelente biocompatibilidad con los tejidos del ojo humano. Sin embargo, este polímero no permite el paso de la cantidad de oxígeno necesaria para la córnea, lo que hace que esta sufra una degradación de sus propiedades y transaparencia. En la actualidad, se emplean metacrilatos modificados con alquilsiloxanos, resinas de silicona polibutilestireno, etc; cada cual con sus ventajas e inconvenientes.[7] Una de sus propiedades más atractivas es la permeabilidad al oxígeno, que se requiere ya que la córnea carece de vasculatura.
- Liberación controlada de fármacos: Esta tecnología es relativamente nueva. Con los métodos tradicionales de liberación de medicamentos se obtienen controles muy pobres sobre los niveles de fármaco óptimos terapéuticos que demandan los tratamientos. Estas imprecisiones provocan que el medicamento, que en principio puede ser efectivo para tratar la enfermedad, no se administre ni en la cantidad ni el tiempo ni el lugar esperado para que el tratamiento sea eficaz. Por otro lado, el avance creciente en los últimos años sobre hidrogeles con facultades de liberadores trae nuevas alternativas para que un control preciso pueda ser aplicado en la administración de medicamentos.[8] Su fundamento reside en que una determinada fracción liberada de fármaco provoca una acción farmacológica específica. Se ha demostrado que existe una relación directa entre la porción de fármaco liberada y su acción farmacológica. Así, cuando se desea un efecto en particular el grado de liberación debe ser controlado en un entorno muy específico, ya que dosis más elevadas pueden producir efectos farmacológicos no deseados además de la acción terapéutica. En la actualidad, los hidrogeles han demostrado ser la base de unos de los mejores sistemas para obtener una liberación controlada de fármacos; se han estudiado sistemas de liberación de antibióticos, analgésicos, antineoplásticos, etc.[9][10]
- Vendajes para heridas: El proceso de curación de una herida es muy complejo: diferentes factores coordinan el cierre y formación de piel nueva. Ciertas condiciones para cada etapa favorecen una buena y rápida cicatrización. Uno de los factores claves es mantener un ambiente húmedo fisiológico. Gracias a la capacidad de los hidrogeles de absorber y mantener grandes cantidades de agua (en relación con la cantidad de polímero), y a la posibilidad de encapsular, proteger, y liberar proteínas u otras moléculas los hacen excelentes candidatos para esta aplicación.[11]
- Biotintas para impresión 3D: Debido a su similitud mecánica con la matriz extracelular, los hidrogeles han sido usados exitosamente junto con células para hacer impresiones en 3D de tejidos y mini-órganos, los cuales son útiles para regenerar órganos dañados, así como imprimir mini órganos para ser utilizados en la industria farmacéutica.
Aplicaciones en agricultura
[editar]- Liberación controlada de agua y estructurador de suelos: Como ya se ha comentado, los hidrogeles se hinchan con el agua, y este hinchamiento es reversible, de tal manera que ciertos hidrogeles pueden ser aplicados en el suelo y cuando llueve se hinchan absorbiendo parte del agua de lluvia, y cuando hay época de sequía, éstos liberan poco a poco el agua absorbida. Suelen emplearse con esta aplicación 3 tipos de hidrogeles: poliacrilamida, poliacrilato de sodio y un copolímero de poliacrilamida y acrilato de sodio.[12] A menudo, para no usar el término científico del hidrogel (o por no revelar la fórmula química del hidrogel) se suele usar la abreviatura PAM para designar cualquiera de estos 3 polímeros tan distintos.[13]
- La PAM reduce la erosión del suelo, favorece la regeneración de la materia orgánica y la aireación del suelo, evita la acumulación de sales en la superficie y la excesiva pérdida de agua, aumenta la retención de los nutrientes de las plantas, etc.[14][15]
Investigación en laboratorios
[editar]- Andamios en ingeniería de tejidos.[16] Cuando se utilizan como andamios, los hidrogeles pueden contener células humanas para estudiar el tanto el comportamiento de las mismas, así como su interacción con los diferentes componentes de la matriz extracelular. De esta forma se consigue representar en 3D el microambiente celular.[17] Algunos de los materiales más utilizados son agar, metilcelulosa, hialuronano, polipéptidos similares a la elastina y otros polímeros de origen natural.[18]
- Se han utilizado pocillos recubiertos de hidrogel para cultivo celular.[19]
- Investigación de funciones biomecánicas en células cuando se combina con microscopía holotomográfica.

- Hidrogeles ambientalmente sensibles (también conocidos como 'Smart Gels' o 'Intelligent Gels'). Estos hidrogeles tienen la capacidad de detectar cambios de pH, temperatura o concentración de metabolitos y liberar su carga como resultado de dicho cambio.[20][21]
- Hidrogeles inyectables que se pueden usar como portadores de fármacos para el tratamiento de enfermedades o como portadores de células con fines regenerativos o ingeniería de tejidos.[22][23][24]
- Sistemas de administración de fármacos de liberación sostenida. La fuerza iónica, el pH y la temperatura se pueden utilizar como factor desencadenante para controlar la liberación del fármaco.[25]
- Proporciona absorción, desbridamiento y desbridamiento de tejido necrótico y fibrótico.
- Los hidrogeles que responden a moléculas específicas,[26] como la glucosa o los antígenos, pueden usarse como biosensores, así como en DDS.[27]
- Pañales desechables donde absorben la orina o en toallas sanitarias[28]
- Lentes de contacto (hidrogeles de silicona , poliacrilamidas, polimacon )
- Electrodos médicos de EEG y ECG que utilizan hidrogeles compuestos de polímeros reticulados (óxido de polietileno, polyAMPS y polivinilpirrolidona )
- Explosivos de gel de agua
- Administración y diagnóstico de fármacos por vía rectal
- Encapsulación de puntos cuánticos
- Implantes de pecho
- Pegamento
- Gránulos para retener la humedad del suelo en áreas áridas.
- Apósitos para curar quemaduras u otras heridas difíciles de curar. Los geles para heridas son excelentes para ayudar a crear o mantener un ambiente húmedo.
- Reservorios en la administración de fármacos tópicos ; particularmente fármacos iónicos, administrados por iontoforesis (ver resina de intercambio iónico ).
- Materiales que imitan los tejidos de la mucosa animal que se utilizarán para probar las propiedades mucoadhesivas de los sistemas de administración de fármacos.[29][30]
- Generación de electricidad termodinámica. Cuando se combina con iones permite la disipación de calor para dispositivos electrónicos y baterías y convierte el intercambio de calor en una carga eléctrica.[31]
- Fibras.
Química
[editar]Los hidrogeles se preparan utilizando una variedad de materiales poliméricos, que se pueden dividir ampliamente en dos categorías según su origen: polímeros naturales o sintéticos. Los polímeros naturales para la preparación de hidrogel incluyen ácido hialurónico, quitosano, heparina, alginato y fibrina .[32] Los polímeros sintéticos comunes incluyen poli (alcohol vinílico), polietilenglicol, poliacrilato de sodio, polímeros de acrilato y copolímeros.[1]
Las reticulaciones que unen los polímeros de un hidrogel se clasifican en dos categorías generales: físicas y químicas. Los enlaces cruzados físicos consisten en enlaces de hidrógeno, interacciones hidrofóbicas y entrelazamientos de cadenas (entre otros). Un hidrogel generado mediante el uso de enlaces cruzados físicos a veces se denomina hidrogel "reversible". Los enlaces cruzados químicos consisten en enlaces covalentes entre hebras de polímero. Los hidrogeles generados de esta manera a veces se denominan hidrogeles "permanentes".
Un método notable para iniciar una reacción de polimerización implica el uso de luz como estímulo. En este método, los fotoiniciadores, compuestos que se escinden de la absorción de fotones, se agregan a la solución precursora que se convertirá en el hidrogel. Cuando la solución precursora se expone a una fuente de luz concentrada, los fotoiniciadores se escindirán y formarán radicales libres, que comenzarán una reacción de polimerización que forma enlaces cruzados entre las hebras de polímero. Esta reacción cesará si se elimina la fuente de luz, lo que permite controlar la cantidad de enlaces cruzados formados en el hidrogel.[33] Las propiedades de un hidrogel dependen en gran medida del tipo y la cantidad de sus enlaces cruzados, lo que hace que la fotopolimerización sea una opción popular para perfeccionar los hidrogeles. Esta técnica ha tenido un uso considerable en aplicaciones de ingeniería de células y tejidos debido a la capacidad de inyectar o moldear una solución precursora cargada con células en el sitio de la herida y luego solidificarla in situ.[28][33]
Los hidrogeles también poseen un grado de flexibilidad muy similar al tejido natural debido a su importante contenido de agua. Como "materiales inteligentes" sensibles, los hidrogeles pueden encapsular sistemas químicos que, al ser estimulados por factores externos, como un cambio de pH, pueden hacer que compuestos específicos como la glucosa se liberen al medio ambiente, en la mayoría de los casos mediante una transición de gel-sol al líquido. estado. Los polímeros quimiomecánicos son en su mayoría también hidrogeles, que tras la estimulación cambian su volumen y pueden servir como actuadores o sensores.
Propiedades mecánicas
[editar]Los hidrogeles se han investigado para diversas aplicaciones. Modificando la concentración de polímero de un hidrogel (o viceversa, la concentración de agua), el módulo de Young, el módulo de cizallamiento y el módulo de almacenamiento pueden variar de 10 Pa a 3 MPa, un rango de aproximadamente cinco órdenes de magnitud.[34] Se puede ver un efecto similar al alterar la concentración de reticulación.[34] Esta gran variabilidad de la rigidez mecánica es la razón por la que los hidrogeles son tan atractivos para aplicaciones biomédicas, donde es vital que los implantes coincidan con las propiedades mecánicas de los tejidos circundantes.[35] Caracterizar las propiedades mecánicas de los hidrogeles puede ser difícil, especialmente debido a las diferencias en el comportamiento mecánico que tienen los hidrogeles en comparación con otros materiales de ingeniería tradicionales. Además de su elasticidad de caucho y viscoelasticidad, los hidrogeles tienen un mecanismo de deformación adicional dependiente del tiempo que depende del flujo de fluido llamado poroelasticidad . Es muy importante tener en cuenta estas propiedades al realizar experimentos mecánicos. Algunos experimentos de pruebas mecánicas comunes para hidrogeles son tensión, compresión (confinada o no confinada), indentación, reometría de cizallamiento o análisis mecánico dinámico .[34]
Los hidrogeles tienen dos regímenes principales de propiedades mecánicas: elasticidad del caucho y viscoelasticidad.
Elasticidad de caucho
[editar]En el estado no hinchado, los hidrogeles pueden modelarse como geles químicos altamente reticulados, en los que el sistema puede describirse como una red continua de polímeros. En este caso:
donde G es el módulo de corte, k es la constante de Boltzmann, T es la temperatura, N p es el número de cadenas de polímero por unidad de volumen, ρ es la densidad, R es la constante del gas ideal y es el (número) peso molecular medio entre dos puntos de reticulación adyacentes. se puede calcular a partir de la relación de oleaje, Q, que es relativamente fácil de probar y medir.[34]
Para el estado hinchado, una red de gel perfecta se puede modelar como:[34]
En una prueba de compresión o extensión uniaxial simple, la tensión verdadera, y estrés de ingeniería, , se puede calcular como:
dónde es el tramo.[36]
Viscoelasticidad
[editar]En el caso de los hidrogeles, su elasticidad proviene de la matriz polimérica sólida, mientras que la viscosidad se origina en la movilidad de la red polimérica y el agua y otros componentes que forman la fase acuosa.[37] Las propiedades viscoelásticas de un hidrogel dependen en gran medida de la naturaleza del movimiento mecánico aplicado. Por tanto, la dependencia del tiempo de estas fuerzas aplicadas es extremadamente importante para evaluar la viscoelasticidad del material.[38]
Los modelos físicos de viscoelasticidad intentan capturar las propiedades de material elástico y viscoso de un material. En un material elástico, la tensión es proporcional a la deformación, mientras que en un material viscoso, la tensión es proporcional a la tasa de deformación. El modelo de Maxwell es un modelo matemático desarrollado para la respuesta viscoelástica lineal. En este modelo, la viscoelasticidad se modela de forma análoga a un circuito eléctrico con un resorte Hookean, que representa el módulo de Young, y un dashpot newtoniano que representa la viscosidad. Un material que exhibe las propiedades descritas en este modelo es un material Maxwell. Otro modelo físico utilizado se llama modelo de Kelvin-Voigt y un material que sigue este modelo se llama material de Kelvin-Voigt.[39] Para describir la fluencia dependiente del tiempo y el comportamiento de relajación de la tensión del hidrogel, se pueden utilizar una variedad de modelos de parámetros físicos agrupados.[34] Estos métodos de modelado varían mucho y son extremadamente complejos, por lo que la descripción empírica de la serie Prony se usa comúnmente para describir el comportamiento viscoelástico en hidrogeles.[34]
Con el fin de medir el comportamiento viscoelástico dependiente del tiempo de los polímeros, a menudo se realiza un análisis mecánico dinámico. Normalmente, en estas mediciones, un lado del hidrogel se somete a una carga sinusoidal en modo de cizallamiento mientras que la tensión aplicada se mide con un transductor de tensión y el cambio en la longitud de la muestra se mide con un transductor de deformación.[38] Una notación utilizada para modelar la respuesta sinusoidal al esfuerzo o deformación periódica es:
donde G′ es el módulo real (elástico o de almacenamiento), G″ es el módulo imaginario (viscoso o de pérdida).
Poroelasticidad
[editar]La poroelasticidad es una característica de los materiales relacionada con la migración de disolvente a través de un material poroso y la deformación concurrente que se produce.[34] La poroelasticidad en materiales hidratados como los hidrogeles se produce debido a la fricción entre el polímero y el agua a medida que el agua se mueve a través de la matriz porosa tras la compresión. Esto provoca una disminución de la presión del agua, lo que añade estrés adicional a la compresión. Similar a la viscoelasticidad, este comportamiento depende del tiempo, por lo que la poroelasticidad depende de la velocidad de compresión: un hidrogel muestra suavidad tras una compresión lenta, pero la compresión rápida hace que el hidrogel sea más rígido. Este fenómeno se debe a que la fricción entre el agua y la matriz porosa es proporcional al flujo de agua, que a su vez depende de la tasa de compresión. Por lo tanto, una forma común de medir la poroelasticidad es realizar pruebas de compresión a diferentes velocidades de compresión.[40] El tamaño de los poros es un factor importante que influye en la poroelasticidad. La ecuación de Kozeny-Carman se ha utilizado para predecir el tamaño de los poros relacionando la caída de presión con la diferencia de tensión entre dos velocidades de compresión.[40]
La poroelasticidad se describe mediante varias ecuaciones acopladas, por lo que existen pocas pruebas mecánicas que se relacionen directamente con el comportamiento poroelástico del material, por lo que se utilizan pruebas más complicadas como pruebas de indentación, modelos numéricos o computacionales. Los métodos numéricos o computacionales intentan simular la permeabilidad tridimensional de la red de hidrogel.
Respuesta ambiental
[editar]La sensibilidad ambiental más común en los hidrogeles es una respuesta a la temperatura.[41] Muchos polímeros / hidrogeles exhiben una transición de fase dependiente de la temperatura, que se puede clasificar como temperatura de solución crítica superior (UCST) o temperatura de solución crítica inferior (LCST). Los polímeros UCST aumentan su solubilidad en agua a temperaturas más altas, lo que lleva a que los hidrogeles UCST pasen de un gel (sólido) a una solución (líquido) a medida que aumenta la temperatura (similar al comportamiento del punto de fusión de los materiales puros). Este fenómeno también hace que los hidrogeles UCST se expandan (aumenten su proporción de hinchamiento) a medida que aumenta la temperatura mientras están por debajo de su UCST.[41] Sin embargo, los polímeros con LCST muestran una dependencia de la temperatura inversa (o negativa), donde su solubilidad en agua disminuye a temperaturas más altas. Los hidrogeles LCST pasan de una solución líquida a un gel sólido a medida que aumenta la temperatura, y también se encogen (disminuyen su relación de hinchamiento) a medida que aumenta la temperatura mientras están por encima de su LCST.[41]
Las aplicaciones pueden dictar diversas respuestas térmicas. Por ejemplo, en el campo biomédico, los hidrogeles LCST se están investigando como sistemas de administración de fármacos debido a que son inyectables (líquidos) a temperatura ambiente y luego se solidifican en un gel rígido al exponerlos a las temperaturas más altas del cuerpo humano.[41] Hay muchos otros estímulos a los que los hidrogeles pueden responder, incluidos: pH, glucosa, señales eléctricas, luz, presión, iones, antígenos y más.[41]
Aditivos
[editar]Las propiedades mecánicas de los hidrogeles se pueden ajustar de muchas maneras, comenzando con la atención a sus propiedades hidrófobas.[41][42] Otro método para modificar la fuerza o la elasticidad de los hidrogeles es injertarlos o recubrirlos sobre un soporte más fuerte / rígido, o haciendo compuestos de hidrogel superporoso (SPH), en los que se agrega un aditivo de hinchamiento de matriz reticulable.[43] Se ha demostrado que otros aditivos, como nanopartículas y micropartículas, modifican significativamente la rigidez y la temperatura de gelificación de ciertos hidrogeles utilizados en aplicaciones biomédicas.[44][45][46]
Técnicas de procesamiento
[editar]Si bien las propiedades mecánicas de un hidrogel se pueden ajustar y modificar mediante la concentración de reticulación y los aditivos, estas propiedades también se pueden mejorar u optimizar para diversas aplicaciones mediante técnicas de procesamiento específicas. Estas técnicas incluyen electrohilado, impresión 3D / 4D, autoensamblaje y fundición por congelación. Una técnica de procesamiento única es mediante la formación de hidrogeles de varias capas para crear una composición de matriz que varía espacialmente y, por extensión, propiedades mecánicas. Esto se puede hacer polimerizando las matrices de hidrogel capa por capa mediante polimerización UV. Esta técnica puede ser útil para crear hidrogeles que imitan el cartílago articular, lo que permite un material con tres zonas separadas de propiedades mecánicas distintas.[47]
Otra técnica emergente para optimizar las propiedades mecánicas del hidrogel es aprovechar la serie Hofmeister . Debido a este fenómeno, mediante la adición de solución salina, las cadenas de polímero de un hidrogel se agregan y cristalizan, lo que aumenta la tenacidad del hidrogel. Este método, llamado "salado", se ha aplicado a los hidrogeles de poli (alcohol vinílico) mediante la adición de una solución de sal de sulfato de sodio.[48] Algunas de estas técnicas de procesamiento se pueden utilizar de forma sinérgica entre sí para producir propiedades mecánicas óptimas. La congelación direccional o la fundición por congelación es otro método en el que se aplica un gradiente de temperatura direccional al hidrogel y es otra forma de formar materiales con propiedades mecánicas anisotrópicas. Utilizando las técnicas de procesamiento de fundición por congelación y de salado en hidrogeles de poli (alcohol vinílico) para inducir morfologías jerárquicas y propiedades mecánicas anisotrópicas.[49] La congelación direccional de los hidrogeles ayuda a alinear y fusionar las cadenas de polímero, creando estructuras anisotrópicas en forma de panal en forma de tubo, mientras que la salazón del hidrogel produjo una red de nano-fibrillas en la superficie de estas estructuras en forma de panal. Mientras mantienen un contenido de agua de más del 70%, los valores de tenacidad de estos hidrogeles están muy por encima de los de los polímeros libres de agua como el polidimetilsiloxano (PDMS), el kevlar y el caucho sintético. Los valores también superan la tenacidad del tendón natural y la seda de araña.[49]
Síntesis de hidrogeles
[editar]La síntesis de un hidrogel es, en esencia, un proceso de polimerización con una serie de peculiaridades que dependen de las características específicas de dichos materiales. Además del disolvente, monómero, mecanismo de iniciación… habrá que introducir otros elementos nuevos como son el agente entrecruzante y, eventualmente, un desmoldeante que evite la adhesión del hidrogel a las paredes del recipiente donde se lleve a cabo la reacción. Dada la definición de un hidrogel como la de un gel que contiene agua, está claro que éste será el medio disolvente más habitual en su síntesis, lo que no impide que en algunos casos se utilicen otros disolventes (puros o mezclas binarias) que posteriormente serán eliminados hasta formar el xerogel (red polimérica sin ningún líquido en su interior) para, finalmente, volver a ser solvatado, esta vez con agua.[50]
Monómeros
[editar]Cuando se sintetizan hidrogeles, puede elegirse un gran número de monómeros: con sustituyentes laterales no ionizables (N-metilol acrilamida, N-vinil-2-pirrolidona, metracrilato de 2-hidroxietilo…), con grupos funcionales ionizables (los ácidos metracrílico, acrílico, estiren sulfónico, vinil sulfónico, itacónico… Derivados de 2-vinilpiridina, 4-vinilpiridina, vinilamina, etilamina…), con grupos laterales cargados zwiterionicos (la parte activa o liófila tiene simultáneamente carga positiva y negativa).[51]
Iniciación
[editar]Independientemente del tipo de polimerización y de los monómeros que se utilicen, es necesario emplear un agente desencadenante de la reacción de polimerización o iniciador. Los sistemas de iniciación que pueden emplearse son los habituales en la síntesis de polímeros:
- Iniciadores formadores de radicales libres: son sustancias que producen la formación de radicales libres que reaccionan en cadena si las condiciones son las adecuadas. Se requieren concentraciones de iniciador muy pequeñas, ya que una sola molécula de iniciador es capaz de producir una o dos largas cadenas macromoleculares. Uno de los iniciadores de esta familia más comúnmente utilizado es el 2,2´-azobiisobutironitrilo (AIBN).
- Iniciadores iónicos: cuando la estructura del monómero no permite emplear iniciación por radicales libres, se utilizan iniciadores iónicos. Dichos iniciadores suelen ser compuestos organometálicos como el n-butil-litio, o bases fuertes, como el terc-butóxido de litio. Con estos iniciadores puede aumentarse sensiblemente la velocidad de reacción.
- Radiación gamma: es una de las técnicas más utilizadas para obtener hidrogeles en el caso de los polímeros hidrosolubles como, por ejemplo, poli(óxido de etileno), poli(vinil alcohol), poliacrilamida… Así mismo, también es una técnica eficaz para entrecruzar mezclas de polímeros. Una fuente de radiación ϒ es la causante de la formación de radicales polímeros en el sistema. Obviamente, esta vía no requiere de la incorporación de ninguna sustancia química, al contrario del resto de casos.[51]
Síntesis del hidrogel
[editar]Los métodos de síntesis que aparecen en la literatura se basan fundamentalmente en reacciones de copolimerización, en las cuales uno de los monómeros tiene carácter hidrófobo y el otro hidrófilo. Las técnicas empleadas pueden englobarse en 2 grandes grupos:
- Polimerización en bloque: se añade el iniciador y el agente entrecruzante a los monómeros. Se obtiene, de esta forma, el polímero sólido (en fase cristalina).
- Polimerización en disolución: en este caso el proceso se realiza en presencia de un disolvente. Si no se utiliza agente entrecruzante, se obtiene una disolución del polímero que más tarde puede precipitarse y entrecruzarse. Si se emplea un agente entrecruzante, el resultado final no es una disolución, sino un gel solvatado.[51]
Agente entrecruzante
[editar]Es preciso señalar que en la síntesis de hidrogeles, la elección del agente entrecruzante es fundamental a la hora de optimizar las propiedades del material a sintetizar. Generalmente el agente entrecruzante se utiliza en un porcentaje muy bajo en comparación con la del total de monómero o comonómeros que se utiliza en la reacción de polimerización. Estos agentes entrecruzantes han de poseer de varios grupos reactivos en su estructura molecular, para así poder entrecruzar distintas cadenas poliméricas, siendo habituales las tetra- y hexafuncionales. Entre los destacables está el dimetilacrilato de etilenglicol (EGDMA), muy utilizado en la síntesis de hidrogeles de Poli(2-hidroxietil metacrilato) (PHEMA). No hay que olvidar, que un elevado grado de entrecruzamiento (número de entrecruzamientos que existen por unidad de volumen) hace que el polímero presente poca elasticidad, mientras que en el caso contrario, permite desplazamientos entre las distintas cadenas poliméricas y conduce a altas elasticidades.[51]
Desmoldante
[editar]Cuando se prepara un hidrogel es preciso asegurarse que tras la polimerización, éste podrá ser extraído del recipiente en el que se ha obtenido. Para ello es necesario impregnar la superficie del recipiente utilizado con un compuesto que evite la adhesión del hidrogel a dicha superficie (desmoldante). Un ejemplo: el diclorometilsilano, que al ser volátil se puede eliminar fácilmente.[51]
Caracterización
[editar]La caracterización de hidrogeles dependerá de su aplicación final. En general, consiste ambas caracterizaciones física y química. El objetivo de la caracterización física es cuantificar la rigidez (Reología) y/o fluidez así como el contenido en agua, y su degradación. En cuanto a la caracterización química, se busca conocer la composición del polímero, y productos finales en caso de que haya degradación del hidrogel durante o después de su aplicación. En el caso de hidrogeles para fines biomédicos, habrá que incluir estudios in vitro para evaluar su biocompatibilidad (e in vivo en caso positivo).
Investigación
[editar]Se están investigando materiales de hidrogel natural para la ingeniería de tejidos; estos materiales incluyen agarosa, metilcelulosa, hialuronano, polipéptidos similares a elastina y otros polímeros de origen natural. Los hidrogeles son prometedores para su uso en agricultura, ya que pueden liberar productos agroquímicos, incluidos pesticidas y fertilizantes fosfatados, lentamente, aumentando la eficiencia y reduciendo la escorrentía, y al mismo tiempo mejoran la retención de agua en suelos más secos como los margosos arenosos.
Se han investigado los hidrogeles para la administración de fármacos. Los sistemas de administración de fármacos poliméricos han superado el desafío debido a su biodegradabilidad, biocompatibilidad y antitoxicidad.[52][53] Materiales como colágeno, quitosano, celulosa y poli (ácido láctico-co-glicólico) se han implementado ampliamente para la administración de fármacos a diversos órganos del cuerpo humano como: el ojo,[54] nariz, riñones,[55] pulmones.,[56] intestinos,[57] piel,[58] y cerebro. El trabajo futuro se centra en una mejor anti-toxicidad de los hidrogeles, variando las técnicas de ensamblaje de los hidrogeles haciéndolos más biocompatibles[59] y la entrega de sistemas complejos como el uso de hidrogeles para administrar células terapéuticas.[60]
Otras lecturas
[editar]- Warren, David S.; Sutherland, Sam P. H.; Kao, Jacqueline Y.; Weal, Geoffrey R.; Mackay, Sean M. (20 de abril de 2017). «The Preparation and Simple Analysis of a Clay Nanoparticle Composite Hydrogel». Journal of Chemical Education 94 (11): 1772-1779. Bibcode:2017JChEd..94.1772W. ISSN 0021-9584. doi:10.1021/acs.jchemed.6b00389.
Referencias
[editar]- ↑ a b Cai, Wensheng; Gupta, Ram B. (2012). «Hydrogels». Kirk-Othmer Encyclopedia of Chemical Technology. ISBN 978-0471238966. doi:10.1002/0471238961.0825041807211620.a01.pub2.
- ↑ «Der Hydrogel und das kristallinische Hydrat des Kupferoxydes». Zeitschrift für Chemie und Industrie der Kolloide 1 (7): 213-214. 1907. doi:10.1007/BF01830147.
- ↑ Elisseeff, Jennifer (2008). «Hydrogels: Structure starts to gel». Nature Materials 7.
- ↑ Kopeček, Jindřich (2007). «Hydrogel Biomaterials: A Smart Future?». Biomaterials 28. doi:10.1016/j.biomaterials.2007.07.044.
- ↑ Hoffman, AS (2002). «Hydrogels for biomedical applications». Adv Drug Deliv Rev 54: 3-12.
- ↑ Lai, Yu-Chin; Wilson, Alan C.; Zantos, Steve G. (2000). «Contact Lenses». En John Wiley & Sons, Inc, ed. Kirk‐Othmer Encyclopedia of Chemical Technology. ISBN 9780471484943. doi:10.1002/0471238961.
- ↑ Nicolson, PC; Vogt J (2001). «Soft contact lens polymers: an evolution.». Biomaterials 22: 3273-83.
- ↑ Alejandro Arredondo Peñaranda, Marta Elena Londoño López (2009). «Hidrogeles. Potenciales biomateriales para la liberación controlada de medicamentos». Revista Ingeniería Biomédica 3 (5): 83-94. Archivado desde el original el 29 de abril de 2014. Consultado el 6 de febrero de 2013.
- ↑ Saima Amin*, Saeid Rajabnezhad and Kanchan Kohli (noviembre de 2009). «Hidrógel PDF». Scientific Research and Essay 3 (11): 1175-1183. Archivado desde el original el 12 de mayo de 2013. Consultado el 6 de febrero de 2013.
- ↑ Faccia, Paula Andrea (03 de 2013). Síntesis y caracterización de materiales poliméricos para sistemas de transporte y liberación de fármacos con potenciales aplicaciones en terapias oftalmológicas. p. 306. Consultado el 29 de abril de 2014.
- ↑ Gupta, B.; Agarwal, R.; Alam, M.S. (2011). Biomedical Hydrogels. Elsevier. pp. 184-227. ISBN 9781845695903. Consultado el 23 de abril de 2019.
- ↑ M. Dragusin; D. Martin; M. Radoiu; R. Moraru; C. Oproiu; S. Marghitu; T. Dumitrica (1996). «Hydrogels used for medicine and agriculture». Progress in Colloid & Polymer Science 12: 123-125. doi:10.1007/BFb0114400.
- ↑ «A brief story of polyacrylamide». Archivado desde el original el 20 de enero de 2014.
- ↑ William J. Orts; Aicardo Roa-Espinosa; Robert E. Sojka; Gregory M. Glenn; Syed H. Imams; Kurt Erlacher and Jan Skov Pedersen (2007). «Use of Synthetic Polymers and Biopolymers for Soil Stabilization in Agricultural, Construction, and Military Applications». Journal of materials in civil engineering 19: 58-66. doi:10.1061/(ASCE)0899-1561(2007)19:1(58).
- ↑ V. Steven Green; D.E. Stott (1999). «Polyacrylamide: A Review of the Use Effectiveness and Cost of a Soil Erosion Control Amendment». The 10th International Soil Conservation Organization Meeting: 384-389.
- ↑ Talebian, Sepehr; Mehrali, Mehdi; Taebnia, Nayere; Pennisi, Cristian Pablo; Kadumudi, Firoz Babu; Foroughi, Javad; Hasany, Masoud; Nikkhah, Mehdi et al. (2019). «Self-Healing Hydrogels: The Next Paradigm Shift in Tissue Engineering?». Advanced Science 6 (16): 1801664. ISSN 2198-3844. PMC 6702654. PMID 31453048. doi:10.1002/advs.201801664.
- ↑ Mellati, Amir; Dai, Sheng; Bi, Jingxiu; Jin, Bo; Zhang, Hu (2014). «A biodegradable thermosensitive hydrogel with tuneable properties for mimicking three-dimensional microenvironments of stem cells». RSC Adv. 4 (109): 63951-63961. Bibcode:2014RSCAd...463951M. ISSN 2046-2069. doi:10.1039/C4RA12215A.
- ↑ O'Brien, Fergal J. (1 de marzo de 2011). «Biomaterials & scaffolds for tissue engineering». Materials Today (en inglés) 14 (3): 88-95. ISSN 1369-7021. doi:10.1016/S1369-7021(11)70058-X. Consultado el 20 de marzo de 2023.
- ↑ Discher, D. E.; Janmey, P.; Wang, Y.L. (2005). «Tissue Cells Feel and Respond to the Stiffness of Their Substrate». Science 310 (5751): 1139-43. Bibcode:2005Sci...310.1139D. PMID 16293750. doi:10.1126/science.1116995.
- ↑ Brudno, Yevgeny (10 de diciembre de 2015). «On-demand drug delivery from local depots». Journal of Controlled Release 219: 8-17. PMID 26374941. doi:10.1016/j.jconrel.2015.09.011.
- ↑ Blacklow, S.; Li, J.; Freedman, B; Zeidi, Mahdi; Chen, C.; Mooney, D.J. (2019). «Bioinspired mechanically active adhesive dressings to accelerate wound closure». Science Advances 5 (7): eaaw3963. Bibcode:2019SciA....5.3963B. ISSN 2375-2548. PMC 6656537. PMID 31355332. doi:10.1126/sciadv.aaw3963.
- ↑ Lee, Jin Hyun (December 2018). «Injectable hydrogels delivering therapeutic agents for disease treatment and tissue engineering». Biomaterials Research 22 (1): 27. ISSN 2055-7124. PMC 6158836. PMID 30275970. doi:10.1186/s40824-018-0138-6.
- ↑ Liu, Mei; Zeng, Xin; Ma, Chao; Yi, Huan; Ali, Zeeshan; Mou, Xianbo; Li, Song; Deng, Yan et al. (December 2017). «Injectable hydrogels for cartilage and bone tissue engineering». Bone Research 5 (1): 17014. ISSN 2095-6231. PMC 5448314. PMID 28584674. doi:10.1038/boneres.2017.14.
- ↑ Pupkaite, Justina; Rosenquist, Jenny; Hilborn, Jöns; Samanta, Ayan (9 de septiembre de 2019). «Injectable Shape-Holding Collagen Hydrogel for Cell Encapsulation and Delivery Cross-linked Using Thiol-Michael Addition Click Reaction». Biomacromolecules 20 (9): 3475-3484. ISSN 1525-7797. PMID 31408340. doi:10.1021/acs.biomac.9b00769.
- ↑ Malmsten, Martin; Bysell, Helena; Hansson, Per (1 de diciembre de 2010). «Biomacromolecules in microgels — Opportunities and challenges for drug delivery». Current Opinion in Colloid & Interface Science 15 (6): 435-444. ISSN 1359-0294. doi:10.1016/j.cocis.2010.05.016.
- ↑ Chemoresponsive Materials, Editor: Hans-Jörg Schneider, Royal Society of Chemistry, Cambridge 2015, https://pubs.rsc.org/en/content/ebook/978-1-78262-242-0
- ↑ Yetisen, A. K.; Naydenova, I; Da Cruz Vasconcellos, F; Blyth, J; Lowe, C. R. (2014). «Holographic Sensors: Three-Dimensional Analyte-Sensitive Nanostructures and their Applications». Chemical Reviews 114 (20): 10654-96. PMID 25211200. doi:10.1021/cr500116a.
- ↑ a b Caló, Enrica; Khutoryanskiy, Vitaliy V. (2015). «Biomedical applications of hydrogels: A review of patents and commercial products». European Polymer Journal 65: 252-267. doi:10.1016/j.eurpolymj.2014.11.024.
- ↑ Cook, Michael T.; Smith, Sarah L.; Khutoryanskiy, Vitaliy V. (2015). «Novel glycopolymer hydrogels as mucosa-mimetic materials to reduce animal testing». Chem. Commun. 51 (77): 14447-14450. PMID 26221632. doi:10.1039/C5CC02428E.
- ↑ Cook, Michael T.; Khutoryanskiy, Vitaliy V. (2015). «Mucoadhesion and mucosa-mimetic materials—A mini-review». International Journal of Pharmaceutics 495 (2): 991-8. PMID 26440734. doi:10.1016/j.ijpharm.2015.09.064.
- ↑ «A new way to cool down electronic devices, recover waste heat». Phys.org. 22 de abril de 2020. Consultado el 23 de abril de 2020.
- ↑ Kharkar, Prathamesh M.; Kiick, Kristi L.; Kloxin, April M. (5 de agosto de 2013). «Designing degradable hydrogels for orthogonal control of cell microenvironments». Chemical Society Reviews 42 (17): 7335-7372. PMC 3762890. PMID 23609001. doi:10.1039/C3CS60040H.
- ↑ a b Choi, J. R.; Yong, K. W.; Choi, J. Y.; Cowie, A. C. (2019). «Recent advances in photo-crosslinkable hydrogels for biomedical applications». BioTechniques 66 (1): 40-53. PMID 30730212. doi:10.2144/btn-2018-0083.
- ↑ a b c d e f g h Oyen, M. L. (January 2014). «Mechanical characterisation of hydrogel materials». International Materials Reviews (en inglés) 59 (1): 44-59. ISSN 0950-6608. doi:10.1179/1743280413Y.0000000022.
- ↑ Los, Marek J.; Hudecki, Andrzej; Wiechec, Emilia (7 de noviembre de 2018). Stem Cells and Biomaterials for Regenerative Medicine (en inglés). Academic Press. ISBN 978-0-12-812278-5.
- ↑ Oyen, M. L. (January 2014). «Mechanical characterisation of hydrogel materials». International Materials Reviews (en inglés) 59 (1): 44-59. ISSN 0950-6608. doi:10.1179/1743280413Y.0000000022.
- ↑ Tirella, A.; Mattei, G.; Ahluwalia, A. (14 de agosto de 2013). «Strain rate viscoelastic analysis of soft and highly hydrated biomaterials». Journal of Biomedical Materials Research 102 (10): 3353-3360. PMC 4304325. PMID 23946054. doi:10.1002/jbm.a.34914.
- ↑ a b Anseth, K. S.; Bowman, C.N.; Brannon-Peppas, L. (1996). «Review: Mechanical Properties of Hydrogels and their Experimental Determination». Biomaterials 17 (17): 1647-1657. PMID 8866026. doi:10.1016/0142-9612(96)87644-7.
- ↑ Roylance, D. «"Engineering viscoelasticity"». Modules in Mechanics of Materials. Massachusetts Institute of Technology. Consultado el 11 de mayo de 2021.
- ↑ a b Isobe, Noriyuki; Kimura, Satoshi; Wada, Masahisa; Deguchi, Shigeru (November 2018). «Poroelasticity of cellulose hydrogel». Journal of the Taiwan Institute of Chemical Engineers 92: 118-122. doi:10.1016/j.jtice.2018.02.017.
- ↑ a b c d e f Qiu, Yong; Park, Kinam (December 2001). «Environment-sensitive hydrogels for drug delivery». Advanced Drug Delivery Reviews (en inglés) 53 (3): 321-339. PMID 11744175. doi:10.1016/S0169-409X(01)00203-4.
- ↑ Zaragoza, J; Chang, A; Asuri, P (January 2017). «Effect of crosslinker length on the elastic and compression modulus of poly(acrylamide) nanocomposite hydrogels». Journal of Physics: Conference Series (en inglés) 790 (1): 012037. Bibcode:2017JPhCS.790a2037Z. ISSN 1742-6588. doi:10.1088/1742-6596/790/1/012037.
- ↑ Ahmed, Enas M. (March 2015). «Hydrogel: Preparation, characterization, and applications: A review». Journal of Advanced Research (en inglés) 6 (2): 105-121. PMC 4348459. PMID 25750745. doi:10.1016/j.jare.2013.07.006.
- ↑ Cidade, M.; Ramos, D.; Santos, J.; Carrelo, H.; Calero, N.; Borges, J. (2 de abril de 2019). «Injectable Hydrogels Based on Pluronic/Water Systems Filled with Alginate Microparticles for Biomedical Applications». Materials (en inglés) 12 (7): 1083. Bibcode:2019Mate...12.1083C. ISSN 1996-1944. PMC 6479463. PMID 30986948. doi:10.3390/ma12071083.
- ↑ Rose, Séverine; Prevoteau, Alexandre; Elzière, Paul; Hourdet, Dominique; Marcellan, Alba; Leibler, Ludwik (January 2014). «Nanoparticle solutions as adhesives for gels and biological tissues». Nature (en inglés) 505 (7483): 382-385. Bibcode:2014Natur.505..382R. ISSN 1476-4687. PMID 24336207. doi:10.1038/nature12806.
- ↑ Zaragoza, Josergio; Fukuoka, Scott; Kraus, Marcus; Thomin, James; Asuri, Prashanth (November 2018). «Exploring the Role of Nanoparticles in Enhancing Mechanical Properties of Hydrogel Nanocomposites». Nanomaterials (en inglés) 8 (11): 882. PMC 6265757. PMID 30380606. doi:10.3390/nano8110882.
- ↑ Nguyen, Lonnissa H.; Kudva, Abhijith K.; Saxena, Neha S.; Roy, Krishnendu (October 2011). «Engineering articular cartilage with spatially-varying matrix composition and mechanical properties from a single stem cell population using a multi-layered hydrogel». Biomaterials 32 (29): 6946-6952. PMID 21723599. doi:10.1016/j.biomaterials.2011.06.014.
- ↑ Hua, Mutian; Wu, Dong; Wu, Shuwang; Ma, Yanfei; Alsaid, Yousif; He, Ximin (12 de febrero de 2021). «4D Printable Tough and Thermoresponsive Hydrogels». ACS Applied Materials & Interfaces 13 (11): 12689-12697. PMID 33263991. doi:10.1021/acsami.0c17532.
- ↑ a b Hua, Martian; Wu, Shuwang; Ma, Yanfei; Zhao, Yusen; Chen, Zilin; Frenkel, Imri; Strzalka, Joseph; Zhou, Hua et al. (24 de febrero de 2021). «Strong tough hydrogels via the synergy of freeze-casting and salting out». Nature 590 (7847): 594-599. Bibcode:2021Natur.590..594H. PMID 33627812. doi:10.1038/s41586-021-03212-z.
- ↑ «Methods for Synthesis of Hydrogel Networks: A Review». Journal of Macromolecular Science, Part C: Polymer Reviews 36: 405-430. 1996. doi:10.1080/15321799608015226.
- ↑ a b c d e Issa Katime, Óscar Katime Trabanca, Daniel Katime Trabanca (2004). Los materiales inteligentes de este milenio: los hidrogeles macromoleculares : síntesis, propiedades y aplicaciones. ISBN 8483736373.
- ↑ Tang, Yiqing; Heaysman, Clare L.; Willis, Sean; Lewis, Andrew L. (1 de septiembre de 2011). «Physical hydrogels with self-assembled nanostructures as drug delivery systems». Expert Opinion on Drug Delivery 8 (9): 1141-1159. ISSN 1742-5247. PMID 21619469. doi:10.1517/17425247.2011.588205.
- ↑ Aurand, Emily R.; Lampe, Kyle J.; Bjugstad, Kimberly B. (March 2012). «Defining and designing polymers and hydrogels for neural tissue engineering». Neuroscience Research (en inglés) 72 (3): 199-213. PMC 3408056. PMID 22192467. doi:10.1016/j.neures.2011.12.005.
- ↑ Ozcelik, Berkay; Brown, Karl D.; Blencowe, Anton; Daniell, Mark; Stevens, Geoff W.; Qiao, Greg G. (May 2013). «Ultrathin chitosan–poly(ethylene glycol) hydrogel films for corneal tissue engineering». Acta Biomaterialia (en inglés) 9 (5): 6594-6605. PMID 23376126. doi:10.1016/j.actbio.2013.01.020.
- ↑ Gao, Jiasheng; Liu, Rongfu; Wu, Jie; Liu, Zhiqiang; Li, Junjie; Zhou, Jin; Hao, Tong; Wang, Yan et al. (May 2012). «The use of chitosan based hydrogel for enhancing the therapeutic benefits of adipose-derived MSCs for acute kidney injury». Biomaterials (en inglés) 33 (14): 3673-3681. PMID 22361096. doi:10.1016/j.biomaterials.2012.01.061.
- ↑ Otani, Yuto; Tabata, Yasuhiko; Ikada, Yoshito (April 1999). «Sealing effect of rapidly curable gelatin-poly (l-glutamic acid) hydrogel glue on lung air leak». The Annals of Thoracic Surgery (en inglés) 67 (4): 922-926. PMID 10320229. doi:10.1016/S0003-4975(99)00153-8.
- ↑ Ramdas, M.; Dileep, K. J.; Anitha, Y.; Paul, Willi; Sharma, Chandra P. (April 1999). «Alginate Encapsulated Bioadhesive Chitosan Microspheres for Intestinal Drug Delivery». Journal of Biomaterials Applications (en inglés) 13 (4): 290-296. ISSN 0885-3282. PMID 10340211. doi:10.1177/088532829901300402.
- ↑ Liu, Xing; Ma, Lie; Mao, Zhengwei; Gao, Changyou (2011), «Chitosan-Based Biomaterials for Tissue Repair and Regeneration», en Jayakumar, Rangasamy; Prabaharan, M.; Muzzarelli, eds., Chitosan for Biomaterials II, Advances in Polymer Science (en inglés) (Springer Berlin Heidelberg): 81-127, ISBN 978-3-642-24061-4, doi:10.1007/12_2011_118.
- ↑ Wu, Zi Liang; Gong, Jian Ping (June 2011). «Hydrogels with self-assembling ordered structures and their functions». NPG Asia Materials (en inglés) 3 (6): 57-64. ISSN 1884-4057. doi:10.1038/asiamat.2010.200.
- ↑ Kim, Jinku; Yaszemski, Michael J.; Lu, Lichun (December 2009). «Three-dimensional porous biodegradable polymeric scaffolds fabricated with biodegradable hydrogel porogens». Tissue Engineering. Part C, Methods 15 (4): 583-594. ISSN 1937-3392. PMC 2819712. PMID 19216632. doi:10.1089/ten.TEC.2008.0642.


 French
French Deutsch
Deutsch







