Progeria , la enciclopedia libre
| Progeria | ||
|---|---|---|
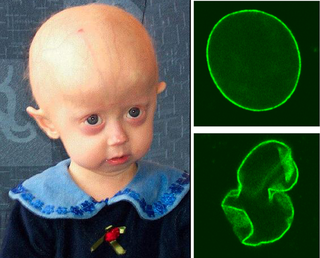 Niño con síndrome de progeria. Arriba a la derecha: Núcleo celular sano; Abajo a la derecha: Núcleo celular progérico. | ||
| Especialidad | endocrinología | |
| Sinónimos | ||
| Síndrome de Werner. Envejecimiento prematuro o algunos casos de extrema rareza de envejecimiento prematuro en un periodo de 6 años de vida. Envejecimiento precoz. Progeria del adulto. Síndrome de Joseph. | ||
La progeria (del griego pro, 'hacia, a favor de' y geron, 'viejo') es una enfermedad genética extremadamente rara que acelera el envejecimiento en niños,[1] entre su primer y segundo año de vida. La padece uno de cada 20 millones de recién nacidos. No existe evidencia de propensión entre algún sexo en particular, pero es notoriamente más frecuente en pacientes de etnia blanca (97 %). La progeria daña diversos órganos y tejidos: hueso, músculos, piel, tejido subcutáneo y vasos. Los niños presentan estatura baja, cráneo de gran tamaño, alopecia, piel seca y arrugada, ausencia de grasa subcutánea y rigidez articular. Al no existir cura ni tratamiento, el pronóstico de vida alcanza un promedio de trece años, aunque algunos pacientes logran vivir poco más allá de los veinte.[2][3]
Su variante más severa se conoce como «síndrome de Hutchinson-Gilford», en honor a Jonathan Hutchinson, quien fue el primero en descubrirla en 1886, y a Hastings Gilford, quien realizó diferentes estudios acerca de su desarrollo y características en 1904.
Características clínicas
[editar]- Estatura baja.
- Piel seca y arrugada.
- Calvicie prematura.
- Canas en la infancia de un niño.
- Ojos prominentes.
- Cráneo de gran tamaño.
- Venas craneales sobresalientes.
- Ausencia de cejas y pestañas.
- Nariz grande y aguileña.
- Mentón retraído.
- Problemas cardíacos.
- Pecho angosto, con costillas marcadas.
- Extremidades finas y esqueléticas.
- Estrechamiento de las arterias coronarias.
- Articulaciones grandes y rígidas.
- Manchas en la piel semejantes a las de la vejez por mal metabolismo de la melanina.
- Presencia de enfermedades degenerativas como la artritis o cataratas, propias de la vejez.
- Alteración en la dentición.
- Osteólisis del tercio distal de las clavículas.
- Osteólisis de falanges distales en manos y pies.
- Osteoporosis.
- Aterosclerosis.
- Muerte natural antes de los 20 años.
Causa
[editar]La progeria puede encuadrarse dentro de las laminopatías, enfermedades genéticas debidas a mutaciones en el gen LMNA, que codifica para las laminas A y C, proteínas que componen la lámina nuclear, una estructura asociada internamente a la envoltura nuclear. La mutación más frecuente es una mutación puntual en la posición 1824 en el exón 11, que altera el codón 608, y activa el sitio críptico de procesamiento llevando a una lamina A truncada. Como consecuencia, se produce la pérdida de 50 aminoácidos en el extremo C-terminal del polipéptido, dando lugar a la forma alterada de la proteína conocida como progerina, o lamina AD50. Esto lleva a la disrupción del ensamblaje normal de la envoltura nuclear, la función nuclear y la funcionalidad de la lamina A. Afecta específicamente a la maduración de la prelamina A a lamina A; por lo tanto, la progeria es un desorden que tiene un efecto profundo en la integridad del tejido conectivo. Esto es crítico para el soporte nuclear y para la organización de la cromatina.
Teniendo en cuenta lo anterior, los estudios se han basado en fibroblastos, ya que la enfermedad se manifiesta en el tejido conectivo. Se han encontrado cambios en la glicosilación de los fibroblastos, pero aún no se sabe si esto se debe a algún estado de la enfermedad, o a la adquisición de mutaciones genómicas.
Las células presentan un núcleo con alteraciones estructurales (herniaciones y lóbulos) así como defectos en la organización de la heterocromatina.
Molecularmente presentan un defecto en el mecanismo que repara el ADN cuando se rompe la doble hélice.
Mitocondria
[editar]La presencia de progerina también conduce a la acumulación de mitocondrias disfuncionales dentro de la célula. Estas mitocondrias se caracterizan por una morfología hinchada, causada por una condensación de ADNmt y de la proteína TFAM en las mitocondrias, que es impulsada por una disfunción mitocondrial grave (potencial de membrana mitocondrial bajo, producción de ATP baja, capacidad de respiración baja y producción alta de especies reactivas de oxígeno).[4][5][6] Con lo cual, contribuye sustancialmente al fenotipo de senescencia. Aunque la explicación de esta acumulación de mitocondrias defectuosas en la progeria está aún en estudio, se ha propuesto que la baja expresión de PGC1-α[4][6][7] (importante para la biogénesis, el mantenimiento y la función mitocondrial) junto con una disminución de la proteína LAMP2 y el número de lisosomas[4] (ambos importantes para la mitofagia: la degradación de la ruta mitocondrial defectuosa), como posibles participantes.
Diagnóstico
[editar]Al nacer, en los niños con progeria no se aprecian características especiales, aunque en algunos casos pueden percibirse: forma esculpida de la nariz, esclerodermas y cianosis facial. Los síntomas se manifiestan durante el primer año, con una o varias de las siguientes anomalías: retardo en el crecimiento, alopecia y anomalías en la piel, debido a la disminución de la producción de sudor por parte de las glándulas sudoríparas. Hacia el segundo año se añaden otros síntomas, como la caída del cabello.
Las manifestaciones clínicas de la progeria se clasifican en criterios mayores y signos que usualmente están presentes. Los criterios mayores incluyen facies delgadas o finas, alopecia, venas prominentes en la calota, ojos grandes, micrognatia, dentición anormal y retardada, tórax "acampanado" en apariencia de pera, clavículas cortas, piernas arqueadas como jinete, extremidades superiores delgadas con articulaciones prominentes, talla baja, peso bajo para la talla, maduración sexual incompleta y disminución de la grasa subcutánea. Los signos que usualmente están presentes son piel esclerodérmica, alopecia generalizada, orejas prominentes con ausencia de lóbulos, nariz ganchuda, labios delgados con cianosis periodal, paladar alto, fontanela anterior permeable, voz de tono alto y uñas distróficas. En conclusión, el diagnóstico de la progeria es fundamentalmente clínico y se declara en niños que presentan los signos iniciales de la enfermedad mencionados al comienzo y que manifiesten todos los criterios mayores.
Cabe mencionar que no existe un examen concluyente que certifique el diagnóstico de la progeria.
El diagnóstico diferencial debe plantearse con los síndromes progeroides entre los cuales se encuentran:
- El síndrome de Werner, también conocido como "progeria de los adultos", teniendo una incidencia de 1 de cada 100 000 habitantes en el mundo.
- El síndrome de Mulvill-Smith: en el cual existe retardo de crecimiento intrauterino, talla baja, microcefalia, hipodontia, entre otros.
- El síndrome de Cockayne: sus características clínicas se presentan en la segunda década de la vida, con fotosensibilidad cutánea, defectos oculares entre otros.
Pronóstico
[editar]El promedio de vida en niños enfermos es de 13 años, pero puede estar entre 7-27 años, aunque la supervivencia más allá de la adolescencia es inusual, se ha descrito un paciente que falleció a los 47 años por un infarto del miocardio. En más del 80 % de los casos la muerte se debe a complicaciones que surgen, como la arterioesclerosis, fallos en el corazón, infarto de miocardio y trombosis coronaria.
No existe cura ni medicamento para este tipo de enfermedad, tampoco un tratamiento de probada eficacia; sin embargo, en recientes estudios,[cita requerida] se comprobó que la progerina, responsable de la degeneración celular, podía ser reducida, aunque el medicamento usado es aún un prototipo, se espera que ayude no solo a curar la aneuploidía, sino también ralentizar el proceso de "envejecimiento", e incluso detener el envejecimiento, aumentando así increíblemente la esperanza de vida.
La mayoría de los tratamientos se limitan a prevenir o frenar las complicaciones que puedan surgir de esta enfermedad, como son las complicaciones cardiológicas. Se utilizan aspirina en dosis bajas y dietas hipercalóricas; también se han intentado tratamientos con hormona de crecimiento humano.
Después de descubrir el gen causante de la enfermedad y su funcionamiento, se ha propuesto un tratamiento con un tipo de fármaco anticancerígeno, inhibidor de la farnesiltransferasa (FTIs), probándose su eficacia en modelos con ratones.
A partir de mayo de 2007 se inició un período de pruebas clínicas con pacientes utilizando FTI Lonafarnib.
Recientemente, se ha demostrado que la proteína CRM1 (un componente clave de la maquinaria de exportación nuclear en los mamíferos) está regulada al alza en las células HGPS, lo que conduce a la localización anormal de las proteínas que contienen NES nucleares desde el núcleo hasta el citoplasma.[8] Además, la inhibición de CRM1 en HGPS alivia el fenotipo de senescencia asociada[8] , así como la función mitocondrial (un determinante importante en la senescencia) y el contenido de lisosomas.[4] Estos resultados están en fase de validación in vivo con selinexor[9] (un inhibidor de CRM1 más adecuado para uso humano).
Aunque recientemente se ha descubierto específicamente el gen causante de la progeria, aún no existe cura.
El factor de que los pacientes mueren jóvenes, casi siempre en la segunda década de vida, no ayuda en el descubrimiento de la cura, ya que no se pueden llevar a cabo estudios más completos y especializados, los cuales llevarían años.
Casos famosos
[editar]En 1981 el programa That's Incredible! presentó el caso del niño sudafricano Fransie Geringer de 8 años de edad y que tenía progeria, quien en Texas fue a visitar a Mickey Hays, otro niño con el mismo síndrome, y juntos fueron de paseo a Disneylandia en Anaheim (California).
También está el caso de Hayley Okines, una niña que apareció en un documental de National Geographic Channel a la edad de 13 años.
Motivado por el caso de Sam Berns, el documental Life According to Sam (La vida según Sam, 2013), de Sean Fine y Andrea Nix, explicó qué era la progeria, el proceso de descubrir las anomalías en las proteínas que la causaban e intentar obtener la aceptación de la primera medicina para tratar esta enfermedad o sus síntomas, llamada Lonafarnib.[10]
En octubre de 2024, falleció un caso emblemático, Sammy Basso, a los 28 años de edad, de notable capacidad académica y que ayudó a levantar conciencia social sobre la progeria en múltiples apariciones, en especial en un documental de National Geographic. En 2018 se licenció con un doctorado en Ciencias Naturales en la Universidad de Padua del norte, donde desarrolló una tesis sobre probables terapias para ralentizar el desarrollo de la progeria. Fue galardonado como Caballero de la Orden del Mérito por la República de Italia en 2019 por sus contribuciones científicas.[11]
Véase también
[editar]Referencias
[editar]- ↑ Real Academia Española. «progeria». Diccionario de la lengua española (23.ª edición).
- ↑ «progeria». Real Academia Nacional de Medicina.
- ↑ Progeria - Enciclopedia MedlinePlus
- ↑ a b c d
- ↑ Feric, Marina; Demarest, Tyler G; Tian, Jane; Croteau, Deborah L; Bohr, Vilhelm A; Misteli, Tom (15 de marzo de 2021). «Self‐assembly of multi‐component mitochondrial nucleoids via phase separation». The EMBO Journal (en inglés) 40 (6). ISSN 0261-4189. PMC 7957436. PMID 33619770. doi:10.15252/embj.2020107165. Consultado el 20 de enero de 2023.
- ↑ a b Xiong, Zheng‐Mei; Choi, Ji Young; Wang, Kun; Zhang, Haoyue; Tariq, Zeshan; Wu, Di; Ko, Eunae; LaDana, Christina et al. (2016-04). «Methylene blue alleviates nuclear and mitochondrial abnormalities in progeria». Aging Cell (en inglés) 15 (2): 279-290. ISSN 1474-9718. PMC 4783354. PMID 26663466. doi:10.1111/acel.12434. Consultado el 20 de enero de 2023.
- ↑ Maynard, Scott; Hall, Arnaldur; Galanos, Panagiotis; Rizza, Salvatore; Yamamoto, Tatsuro; Gram, Helena Hagner; Munk, Sebastian H N; Shoaib, Muhammad et al. (13 de septiembre de 2022). «Lamin A/C impairments cause mitochondrial dysfunction by attenuating PGC1α and the NAMPT-NAD+ pathway». Nucleic Acids Research 50 (17): 9948-9965. ISSN 0305-1048. PMC 9508839. PMID 36099415. doi:10.1093/nar/gkac741. Consultado el 20 de enero de 2023.
- ↑ a b García‐Aguirre, Ian; Alamillo‐Iniesta, Alma; Rodríguez‐Pérez, Ruth; Vélez‐Aguilera, Griselda; Amaro‐Encarnación, Elianeth; Jiménez‐Gutiérrez, Elizabeth; Vásquez‐Limeta, Alejandra; Samuel Laredo‐Cisneros, Marco et al. (2019-10). «Enhanced nuclear protein export in premature aging and rescue of the progeria phenotype by modulation of CRM1 activity». Aging Cell (en inglés) 18 (5). ISSN 1474-9718. PMC 6718587. PMID 31305018. doi:10.1111/acel.13002. Consultado el 20 de enero de 2023.
- ↑ Ferreira, Bibiana I.; Cautain, Bastien; Grenho, Inês; Link, Wolfgang (2020). «Small Molecule Inhibitors of CRM1». Frontiers in Pharmacology 11. ISSN 1663-9812. PMC 7221118. PMID 32574233. doi:10.3389/fphar.2020.00625. Consultado el 20 de enero de 2023.
- ↑ Progeria Research Foundation
- ↑ El caso Sammy Basso
Bibliografía
[editar]- O´Brien, Martin; Jensen, Sacha; Weiss, Anthony (1998). «Hutchinson-Gilford progeria: faithful DNA maintenance, inheritance and allelic trancription of b(1-4) galactosyltransferase». Mechanisms of Aging and Development 101. 43-56.
- Pilarczyka, Agnieszka; Kmiec, Tomasz; et al (2008). «Progeria caused by rare LMNA mutation p.S143F associated with mild myopathy and atrial fibrillation». European Journal of Pediatric Neurology 12. 427-430.
- Lemire, Joan; Patis, Carris; et al (2006). «Aggrecan expression is substantially and abnormally upregulated in Hutchinson-Gilford Progeria Syndrome dermal fibroblasts». Mechanisms of Aging and Development 127. 660-669.
- McKusick VA. (1983). «Mendelian inheritance in man.». Catalog. 6 ed.Baltimore:Jonh Hopkins 454.
- Smith DW. (1982). «Recognizable patterns of human malformation.». Philadelphia:W.B. Saunders 3. 112-3.
- Rosa Andrea Pardo V., Silvia Castillo T. (2002). «Progeria». Revista chilena de pediatría 73.
- Luna Ceballos E., Domínguez Pérez ME., Álvarez Núñez R. (1999). «Presentación de un caso.». Revista cubana de Ortopedia y Traumatología 13.
Enlaces externos
[editar]- Genoma (en inglés)


 French
French Deutsch
Deutsch