Sulfato , la enciclopedia libre
Los sulfatos son las sales o los ésteres provenientes del ácido sulfúrico.[1] Contienen como unidad común un átomo de azufre en el centro de un tetraedro con cuatro átomos de oxígeno ocupando los vértices. Sales, ácidos derivados y peróxidos de sulfato se usan habitualmente en distintas industrias.
Estructura
[editar]El anión sulfato está formado por un átomo central de azufre rodeado por cuatro átomos equivalentes de oxígeno en una disposición tetraédrica. La simetría es la misma que la del metano. El átomo de azufre se encuentra en el estado de oxidación +6 mientras que los cuatro átomos de oxígeno se encuentran cada uno en el estado -2. El ion sulfato lleva una carga global de -2 y es la base conjugada del ion bisulfato (o hidrogensulfato), HSO−
4, que es a su vez la base conjugada de H
2SO
4, ácido sulfúrico. Los ésteres de sulfato orgánicos, como el sulfato de dimetilo, son compuestos covalentes y ésteres del ácido sulfúrico. La geometría molecular tetraédrica del ion sulfato es la predicha por la teoría VSEPR.
Los sulfatos inorgánicos y orgánicos
[editar]Los sulfatos inorgánicos son las sales del ácido sulfúrico. En la naturaleza se encuentran en forma de yeso, o aljez, (sulfato de calcio dihidratado CaSO4·2 H2O), baritina (sulfato de bario) o sulfato de sodio (Na2SO4). Cuando entran en contacto con el oxígeno del aire, por oxidación, se forman partir de sulfuros de otros elementos.
Síntesis
[editar]La mayor parte de los sulfatos son generados a partir de una base y del ácido sulfúrico o por reacción del ácido sulfúrico con el metal esto puede generar trasplantes en el átomo de oxígeno.
Aplicaciones
[editar]Las aplicaciones de los sulfatos suelen variar enormemente según el metal al que están unidos. Así el sulfato sódico, por ejemplo, se utiliza en la fabricación del vidrio, como aditivo en los detergentes, etc.; el sulfato de cobre se aprovecha en la fabricación de la viscosa según un determinado proceso, en la fabricación de fertilizantes, se usa también como pesticida, etc.
Yeso y Barita se utilizan en la construcción y como aditivos en la fabricación de papel y cartulina. El sulfato de bario también se utiliza en medicina para realizar radiografías de contraste.
Los sulfatos son parte esencial de unas sales dobles como los alumbres de fórmula general AB(SO4)2 · 12 H2O, siendo A y B cationes con carga +1 y +3 respectivamente. La más conocida es la alumbre de sodio formada con Sodio y Aluminio.
Analítica
[editar]Los sulfatos solubles precipitan en presencia de cloruro de bario, incluso en medio ácido, formando sulfato de bario (BaSO4) como sólido blanco que queda en suspensión. Si al mismo tiempo hay permanganato presente este puede ser incluido en el precipitado dándole un color ligeramente rosáceo.
Con sodio metálico es reducido al sulfuro (Cuidado: reacción muy violenta) y puede ser determinado como tal.
Sulfatos orgánicos
[editar]Los sulfatos orgánicos son ésteres del ácido sulfúrico con la fórmula genérica R–O–SO2–O–R'. Se pueden formar directamente del alcohol correspondiente y del ácido sulfúrico o del trióxido de azufre o a partir del alcohol y el cloruro de sulfurilo (Cl2SO2) en presencia de una base.[1]
Se trata de sustancias probablemente cancerígenas.
El sulfato orgánico más conocido es el sulfato de dimetilo (CH3)2SO4 que se utiliza en algunas reacciones de metilación.
Propiedades
[editar]
Existen numerosos ejemplos de sulfatos iónicos, muchos de los cuales son altamente solubles en agua. Las excepciones incluyen sulfato de calcio, sulfato de estroncio, sulfato de plomo(II), sulfato de bario, sulfato de plata, y sulfato de mercurio, que son poco solubles. El sulfato de radio es el sulfato más insoluble conocido. El derivado de bario es útil en el análisis gravimétrico del sulfato: si se añade una solución de la mayoría de las sales de bario, por ejemplo cloruro de bario, a una solución que contenga iones sulfato, el sulfato de bario precipitará fuera de la solución como un polvo blanquecino. Esta es una prueba de laboratorio común para determinar si los aniones sulfato están presentes.
El ion sulfato puede actuar como ligando uniéndose ya sea por un oxígeno (monodentado) o por dos oxígenos ya sea como un quelato o un puente.[2] Un ejemplo es el complejo Co(en)
2(SO
4)]+
Br−
[2] o el complejo metálico neutro PtSO
4(PPh
3)
2] donde el ion sulfato actúa como ligando bidentado. Los enlaces metal-oxígeno en los complejos de sulfato pueden tener un carácter covalente significativo.
Preparación
[editar]La preparación de los sulfatos metálicos puede llevarse a cabo de diferentes maneras:[2]
- Empleando ácido sulfúrico, mediante reacciones de disolución del metal correspondiente, como por ejemplo:
- por neutralización del hidróxido o del óxido correspondiente:
- o por reacción de sustitución de otra sal:
Enlaces
[editar]
1 solo con los enlaces polares covalentes; 2 con un enlace iónico

La primera descripción de los enlaces en términos modernos fue realizada por Gilbert Lewis es su trabajo seminal de 1916 donde describió los enlaces en función de octetos de electrones alrededor de cada átomo, o sea no enlaces dobles y carga formal de +2 en el átomo de azufre.[3][4]
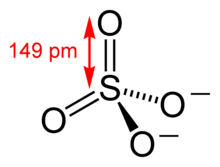
Posteriormente, Linus Pauling utilizó la teoría de enlaces de valencia para proponer que los canónicos de resonancia más significativos tenían dos enlaces π que utilizaban orbitales d. Su razonamiento era que la carga del azufre era pequeña, de acuerdo a su principio de electroneutralidad.[5] La longitud del enlace S−O es 149 pm y es menor que la longitud de los enlaces en el ácido sulfúrico que es 157 pm para S−OH. El doble enlace fue tomado por Pauling para explicar la brevedad del enlace S-O. El uso de Pauling de los orbitales d provocó un debate sobre la importancia relativa del enlace Pi y la polaridad del enlace (atracción electrostática) en la causa del acortamiento del enlace S-O. El resultado fue un amplio consenso de que los orbitales d desempeñan un papel, pero no son tan importantes como Pauling había creído.[6][7]
Una descripción ampliamente aceptada que involucra el enlace pπ - dπ fue propuesta inicialmente por Durward William John Cruickshank. En este modelo, los orbitales p completamente ocupados en el oxígeno se solapan con los orbitales d vacíos del azufre (principalmente el dz2 y dx2-y2).[8] Sin embargo, en esta descripción, a pesar de haber algún carácter π en los enlaces S-O, el enlace tiene un carácter iónico significativo. Para el ácido sulfúrico, el análisis computacional (con orbital de enlace natural) confirma una clara carga positiva en el azufre (teóricamente +2,45) y una baja ocupación 3d. Por lo tanto, la representación con cuatro enlaces simples es la estructura de Lewis óptima en lugar de la que tiene dos enlaces dobles (por lo tanto, el modelo de Lewis, no el modelo de Pauling).[9] En este modelo, la estructura obedece la regla del octeto y la distribución de la carga concuerda con la electronegatividad de los átomos. La discrepancia entre la longitud del enlace S-O en el ion sulfato y la longitud del enlace S-OH en el ácido sulfúrico se explica por la donación de electrones del orbital p de los enlaces terminales S=O en el ácido sulfúrico a los orbitales antienlazantes S-OH, debilitándolos y dando como resultado la mayor longitud de enlace de estos últimos.
Sin embargo, la representación del enlace de Pauling para el sulfato y otros compuestos del grupo principal con oxígeno sigue siendo una forma común de representar el enlace en muchos libros de texto.[8][2] La aparente contradicción puede aclararse si uno se da cuenta de que los covalente dobles enlaces en la estructura de Lewis en realidad representan enlaces que están fuertemente polarizados en más de un 90% hacia el átomo de oxígeno. En cambio, en la estructura con un enlace dipolar, la carga se localiza como un par solitario en el oxígeno.[9]
Usos
[editar]Aplicaciones comerciales
[editar]
Los sulfatos son ampliamente utilizados industrialmente. Entre los principales compuestos se encuentran:
- Yeso, la forma mineral natural del sulfato de calcio hidratado, se utiliza para producir yeso. La industria de la construcción utiliza unos 100 millones de toneladas al año.
- Sulfato de cobre, un alguicida común, la forma más estable (CuSO
4) se utiliza para células galvánicas como electrolito. - Sulfato de hierro(II), una forma común de hierro en suplementos minerales para humanos, animales y suelo para plantas
- Sulfato de magnesio (comúnmente conocido como sales de Epsom), utilizado en baños terapéuticos
- Sulfato de plomo(II), producido en ambas placas durante la descarga de una batería de plomo-ácido
- Lauril éter sulfato sódico, o SLES, un detergente común en formulaciones de champú [10]
- Polihalita, K
2Ca
2Mg(SO
4)
4·2H2O, utilizada como fertilizante.
Presencia en la naturaleza
[editar]Las bacterias reductoras de sulfatos, algunos microorganismos anaerobios, como los que viven en los sedimentos o cerca de los respiraderos térmicos de las profundidades marinas, utilizan la reducción de los sulfatos unida a la oxidación de los compuestos orgánicos o del hidrógeno como fuente de energía para quimiosíntesis.
Historia
[editar]Los alquimistas ya conocían algunos sulfatos. Las sales de vitriolo, del latín vitreolum, vidrioso, fueron llamadas así porque fueron algunos de los primeros cristales transparentes conocidos.[11] El vitriolo verde es el sulfato de hierro(II) heptahidratado, FeSO4-7H2O; el vitriolo azul es el sulfato de cobre(II) pentahidratado, CuSO4-5H2O y el vitriolo blanco es el sulfato de zinc heptahidratado, ZnSO4-7H2O. El alumbre, un sulfato doble de potasio y aluminio con la fórmula K2Al2(SO4)4-24H2O, figuró en el desarrollo de la industria química.
Efectos en el medio ambiente
[editar]Los sulfatos se presentan como partículas microscópicas (aerosoles) resultantes de la combustión de combustibles fósiles y biomasa. Aumentan la acidez de la atmósfera y forman la lluvia ácida. Las bacterias anaerobias reductoras de sulfato Desulfovibrio desulfuricans y D. vulgaris pueden eliminar la costra negra de sulfato que a veces empaña la superficie de ciertos edificios.[12]
Efectos principales sobre el clima
[editar]El principal efecto directo de los sulfatos sobre el clima es la dispersión de la luz, lo que aumenta el albedo de la Tierra. Este efecto se conoce medianamente bien y conduce a un enfriamiento del forzamiento radiativo negativo de unos 0,4 W/m2 en relación con los valores preindustriales,[13] compensando parcialmente el mayor efecto de calentamiento (unos 2,4 W/m2) de los gases de efecto invernadero. El efecto es muy poco uniforme desde el punto de vista espacial, y es mayor en las grandes zonas industriales.[14]


.
El primer efecto indirecto también se conoce como efecto Twomey. Los aerosoles de sulfato pueden actuar como núcleos de condensación de las nubes, lo que da lugar a un mayor número de gotas de agua más pequeñas. Muchas gotas más pequeñas pueden difundir la luz de forma más eficaz que unas pocas gotas más grandes. El segundo efecto indirecto son los efectos secundarios de tener más núcleos de condensación de nubes. Se ha propuesto que estos efectos incluyen la supresión de la llovizna, el aumento de la altura de las nubes, para facilitar la formación de nubes a bajas humedades y una mayor duración de las mismas. El sulfato también puede dar lugar a cambios en la distribución del tamaño de las partículas, lo que puede afectar a las propiedades radiativas de las nubes de formas que no se comprenden completamente. Los efectos químicos como la disolución de gases solubles y sustancias poco solubles, la depresión de la tensión superficial por sustancias orgánicas y los cambios en el coeficiente de acomodación también se incluyen en el segundo efecto indirecto.[15]
Los efectos indirectos consisten en probablemente un efecto de enfriamiento, quizás de hasta 2 W/m2, aunque la incertidumbre es muy grande. Los sulfatos están por tanto implicados en el oscurecimiento global. El sulfato es también el principal contribuyente al aerosol estratosférico formado por la oxidación del dióxido de azufre inyectado en la estratosfera por volcanes impulsivos como la erupción del Monte Pinatubo en Filipinas en 1991. Este aerosol ejerce un efecto de enfriamiento sobre el clima durante su vida de 1 a 2 años sobre la estratosfera.
En los años ochenta, investigaciones llevadas a cabo en Israel y los Países Bajos revelaron una aparente reducción de la cantidad de luz solar,[16] y Atsumu Ohmura, investigador de geografía de la Escuela Politécnica Federal de Suiza, descubrió que la radiación solar que incidía sobre la superficie de la Tierra había disminuido más de un 10% en las tres décadas anteriores, a pesar de que la temperatura global había aumentado en general desde los años setenta.[17] En los años noventa, se publicaron artículos que describían descensos de varias décadas en Estonia,[18] Alemania[19] y en la antigua Unión Soviética,[20] lo que llevó al investigador Gerry Stanhill a acuñar el término "oscurecimiento global"[21] Investigaciones posteriores estimaron una reducción media de la luz solar que incide sobre la superficie terrestre de alrededor del 4-5% por década a finales de los años 1950-1980, y del 2-3% por década si se incluía la década de los 90[22][23] Cabe destacar que la radiación solar en la parte superior de la atmósfera no varió más de un 0. Además, sólo se atenuaron la luz visible y la radiación infrarroja, y no la parte ultravioleta del espectro.[24]
Referencias
[editar]- ↑ a b Perry's Chemical Engineer's Handbook 8th Edition. Robert H. Perry (Editor), Don W. Green (Editor). 2400 páginas, ISBN 0071422943, ISBN 978-0071422949
- ↑ a b c d Greenwood&Earnshaw
- ↑ Lewis, Gilbert N. (1916). «The Atom and the Molecule». J. Am. Chem. Soc. 38 (4): 762-785. doi:10.1021/ja02261a002. (Ver pag 778.)
- ↑ Lewis assigned to sulfur a negative charge of two, starting from six own valence electrons and ending up with eight electrons shared with the oxygen atoms. In fact, sulfur donates two electrons to the oxygen atoms.
- ↑ Pauling, Linus (1948). «The modern theory of valency». J. Chem. Soc. 17: 1461-1467. PMID 18893624. doi:10.1039/JR9480001461.
- ↑ Coulson, C. A. (1969). «electrones d y enlace molecular». Nature 221 (5186): 1106. Bibcode:.1106C 1969Natur.221 .1106C. S2CID 4162835. doi:10.1038/2211106a0.
- ↑ Mitchell, K. A. R. (1969). «Uso de los orbitales d externos en los enlaces». Chem. Rev. 69 (2): 157. doi:10.1021/cr60258a001.
- ↑ a b Cotton, F. Albert; Wilkinson, Geoffrey (1966). Química inorgánica avanzada (2ª edición edición). New York, NY: Wiley.
- ↑ a b Stefan, Thorsten; Janoschek, Rudolf (Feb 2000). «¿Qué importancia tienen los dobles enlaces S=O y P=O para la descripción de las moléculas ácidas H2SO3, H2SO4, y H3PO4, respectivamente?». J. Mol. Modeling 6 (2): 282-288. S2CID 96291857. doi:10.1007/PL00010730.
- ↑ «Sodium Laureth Sulfate (SLES)». SilviaEsparza.
- ↑ Taylor, F. Sherwood (1942). Inorganic and Theoretical Chemistry (6th edición). William Heinemann.
- ↑ Andrea Rinaldi (Nov 2006). «Saving a fragile legacy. Biotechnology and microbiology are increasingly used to preserve and restore the worlds cultural heritage». EMBO Reports 7 (11): 1075-1079. PMC 1679785. PMID 17077862. doi:10.1038/sj.embor.7400844.
- ↑ Intergovernmental Panel on Climate Change (2007). «Chapter 2: Changes in Atmospheric Constituents and Radiative Forcing». Working Group I: The Scientific Basis.
- ↑ «Current sulfate distribution in the atmosphere».
- ↑ Rissman, T. A.; Nenes, A.; Seinfeld, J. H. (2004). «Chemical Amplification (Or Dampening) of the Twomey Effect: Conditions Derived from Droplet Activation Theory». Journal of the Atmospheric Sciences (en inglés) 61 (8): 919. Bibcode:2004JAtS...61..919R. ISSN 1520-0469. doi:10.1175/1520-0469(2004)061<0919:CAODOT>2.0.CO;2.
- ↑ "Earth lightens up". Pacific Northwest National Laboratory. Retrieved 8 May 2005.
- ↑ Ohmura, A.; Lang, H. (June 1989). Lenoble, J.; Geleyn, J.-F. (eds.). Secular variation of global radiation in Europe. In IRS '88: Current Problems in Atmospheric Radiation, A. Deepak Publ., Hampton, VA. Hampton, VA: Deepak Publ. pp. (635) pp. 298–301. ISBN 978-0-937194-16-4.
- ↑ Russak, V. (1990). "Trends of solar radiation, cloudiness and atmospheric transparency during recent decades in Estonia". Tellus B. 42 (2): 206–210. Bibcode:1990TellB..42..206R. doi:10.1034/j.1600-0889.1990.t01-1-00006.x. 1990TellB..42..206R.
- ↑ Liepert, B. G.; Fabian, P.; et al. (1994). "Solar radiation in Germany – Observed trends and an assessment of their causes. Part 1. Regional approach". Contributions to Atmospheric Physics. 67: 15–29.
- ↑ Abakumova, G.M.; et al. (1996). "Evaluation of long-term changes in radiation, cloudiness and surface temperature on the territory of the former Soviet Union" (PDF). Journal of Climate. 9 (6): 1319–1327. Bibcode:1996JCli....9.1319A. doi:10.1175/1520-0442(1996)009<1319:EOLTCI>2.0.CO;2.
- ↑ Stanhill, G.; Moreshet, S. (6 November 2004). "Global radiation climate changes in Israel". Climatic Change. 22 (2): 121–138. Bibcode:1992ClCh...22..121S. doi:10.1007/BF00142962. S2CID 154006620.
- ↑ H. Gilgen; M. Wild; A. Ohmura (1998). "Means and trends of shortwave irradiance at the surface estimated from global energy balance archive data" (PDF). Journal of Climate. 11 (8): 2042–2061. Bibcode:1998JCli...11.2042G. doi:10.1175/1520-0442-11.8.2042.
- ↑ Stanhill, G.; Moreshet, S. (6 November 2004). "Global radiation climate changes in Israel". Climatic Change. 22 (2): 121–138. Bibcode:1992ClCh...22..121S. doi:10.1007/BF00142962. S2CID 154006620.
- ↑ Adam, David (18 December 2003). "Goodbye sunshine". The Guardian. Retrieved 26 August 2009.


 French
French Deutsch
Deutsch



