Tinción de Giemsa , la enciclopedia libre
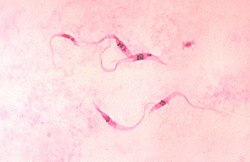

La tinción de Giemsa (pr. guímsa), ideada por el alemán Gustav Giemsa, es un método habitual para el examen de frotis sanguíneos, cortes histológicos y otro tipo de muestras biológicas. Este método tiene utilidad sobre todo para poner de manifiesto las rickettsias localizadas dentro de las células hospedadoras. La coloración de Giemsa se emplea también para teñir frotis de sangre en el examen para protozoos. Se pueden emplear, como variaciones, otras coloraciones como es la técnica de citoconcentración para parásitos sanguíneos, la cual tiene un bajo coste y ofrece la posibilidad de aislar e identificar en el mismo sedimento el parásito principal, con excepción de los trofozoítos jóvenes y el Plasmodium falciparum; también se emplea la tinción de Wright.
Este método de tinción permite también la tinción diferencial de zonas con un alto contenido de ADN, y concretamente de uniones A-T. Esto permite distinguir perfectamente en microscopio óptico el núcleo celular, los cromosomas durante la mitosis, y en algunos casos, incluso el ADN mitocondrial (cinetoplasto de algunos protozoos, como Trypanosoma).
Los cromosomas pueden ser tratados con varios compuestos químicos que producen la alternancia de bandas claras y oscuras a lo largo de los cromosomas. Cada cromosoma tiene un patrón de bandas característico, permitiendo que aberraciones estructurales como borrados, duplicaciones o sutiles translocaciones sean detectadas, al igual que permite la identificación de cromosomas marcadores.
Fundamento
[editar]Estos poliorganismos adquieren una coloración diferencial y se ven dentro del citoplasma de la célula hospedadora. La técnica de Giemsa está formada por varios colorantes: los tintes neutros utilizados combinan el azul de metileno, Azure A y Azure B como tintes básicos, y la eosina como tinte ácido, lo que da una amplia gama de colores. El azul de metileno y el Azure son colorantes metacromático, de ahí que muchas estructuras se tiñan de púrpura y no de azul. El pH de la solución de coloración es crítico y se debe ajustar idealmente según diversos fijadores. La gama del pH debe estar entre 6.4 y 6.9.
Preparación de la muestra
[editar]Para muestras histológicas, los mejores resultados se obtienen en muestras fijadas con formol, incluidas en parafina y cortadas entre 3 y 6 micras. Los términos colorante metacromático y su propiedad denominada metacromasia se refieren a un colorante que al entrar en contacto con la muestra a teñir cambia su propio color original; los ejemplos clásicos de esta característica son el azul de metileno —como bien dice la bibliografía— y el azul de toluidina. Su aspecto en el corte histológico da un púrpura-rojizo. Es usado, además de los extendidos de sangre, en los cortes de cartílago hialino debido a la gran carga de glucosaminoglucanos ácidos.
Procedimiento
[editar]- Se aplica Giemsa en la muestra y encima solución buffer (solución amortiguadora)
- Por 30 minutos
- Secar
Resultados
[editar]- Citoplasma: morado
- Núcleos: azul
- Eritrocitos: rosa - naranja
- Gránulos de las células cebadas: púrpura
- Bacterias: azul
- Parásitos: azul
Variantes
[editar]Esta técnica presenta multitud de variantes, pero las diferencias se basan en el empleo o no de diferenciador, el tiempo de permanencia del colorante, el uso de alcoholes en diferente graduación, etc.
Véase también
[editar]- Tinción de Leishman (Wikipedia inglesa).
- Tinción de Wright
Bibliografía
[editar]- ARP, ed. (1992). Métodos Histotecnológicos. Instituto de patología de las Fuerzas Armadas de los EEUU (AFIP).
- Sheehan, Dezna; Hrapchak, Barbara (1980). Theory and practice of Histotechnology (2 Ed. edición). The C.V. Mosby Company.
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre tinciones de Giemsa.
Wikimedia Commons alberga una categoría multimedia sobre tinciones de Giemsa.- El atlas digital de histología de la Facultad de medicina de la UNAM contiene preparaciones histológicas teñidas con Giemsa.
- Revistaaquatic.com
- Imagenmed.com
- Library.med.utah.edu
- Conganat.org


 French
French Deutsch
Deutsch