Toxoplasmosis , la enciclopedia libre
| Toxoplasmosis | ||
|---|---|---|
 | ||
| Especialidad | infectología obstetricia y ginecología | |
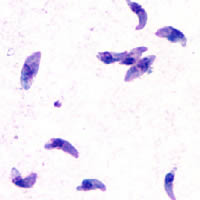
La toxoplasmosis es una enfermedad parasitaria ocasionada por el protozoo Toxoplasma gondii,[1] un parásito intracelular obligado.[2] T. gondii es un parásito intracelular con una enorme capacidad para invadir células del anfitrión gracias a la forma invasora móvil (taquizoíto o trofozoítos) caracterizada por un complejo apical exclusivo, desde el punto de vista evolutivo, y un mecanismo de motilidad basado en actina.
La toxoplasmosis puede causar infecciones leves y asintomáticas, así como infecciones mortales que afectan mayormente al feto, ocasionando la llamada toxoplasmosis congénita. También puede revestir gravedad cuando afecta a inmunosuprimidos tales como infectados por el VIH sin tratamiento antirretroviral efectivo y con los CD4 por debajo de 200 células por mililitro.
El término toxoplasmosis se reserva para el proceso patológico en el cual hay manifestaciones clínicas presentes, mientras que infección por Toxoplasma es la denominación que mejor describe la presencia asintomática del parásito.
Se considera la enfermedad como una zoonosis, lo cual significa que, de modo habitual, se transmite desde los animales a los seres humanos a través de diferentes vías de contagio. Los hospedadores definitivos son el gato y otras seis especies de felinos.
Las medidas de prevención son particularmente importantes en las mujeres embarazadas y consisten en normas generales de higiene para evitar la transmisión por alimentos o agua contaminada, no consumir carne cruda o mal cocida y evitar contacto con heces de gato.[3]
Epidemiología
[editar]La toxoplasmosis está presente en todo el mundo. El porcentaje de adultos que han pasado la enfermedad a lo largo de su vida es muy elevado, en torno al 50 %, dependiendo de la región, los hábitos higiénicos y las condiciones sanitarias.[4] En la mayoría de los casos, apenas aparecen síntomas o estos son leves, por lo cual la población generalmente no es consciente de haber padecido la infección, que solo se puede comprobar mediante un análisis de sangre que demuestre positividad para anticuerpos específicos de tipo IgG o IgM.
En Estados Unidos, cerca del 23 % de la población está afectada[5] y en algunas áreas del mundo es superior al 95 %.[1] Cerca de 200 000 casos de toxoplasmosis congénita ocurren por año.[6] Charles Nicolle y Louis Manceaux describieron por primera vez el organismo en 1908,[7] y en 1941 se confirmó su transmisión durante el embarazo de madre a hijo.[7]
En Europa prevalece mucho la toxoplasmosis, probablemente por el gran consumo de carne cruda.[8] La gran incidencia en el África Occidental es conocida por estudios epidemiológicos de inmigrantes de esa zona del continente.[9]
Se ha encontrado una elevada prevalencia en Hispanoamérica: México, América Central y América del Sur con la excepción de las islas del Caribe por razón de la cantidad de adultos que presentan seropositividad, es decir, que presenta en su sangre anticuerpos que prueban que el individuo tuvo contacto con el parásito.[10] Existe, incluso en estas grandes áreas geográficas, una considerable variación de seroprevalencia, dependiendo de la región, la edad, el sexo, el grupo étnico y las condiciones socioeconómicas y sanitarias, en especial el contacto con gatos y la tierra. Por ejemplo, en comunidades de baja salubridad pública en la región andina de Cuzco, Perú, criadores de camélidos, se encontró una seroprevalencia de Toxoplasma gondii en alpacas del 35 %, cuando la enfermedad en humanos en esa región es escasa.[11]
En Colombia según el Estudio Nacional de Salud realizado en 1982, la prevalencia en la población general es de 47 %. Asimismo, según estudios realizados en diferentes regiones de ese país, las frecuencias en el embarazo van de 0,6 a 3 %. Actualmente, el Ministerio de Protección Social en Colombia no tiene reglamentación para la realización de pruebas durante el embarazo para la toxoplasmosis e igual situación ocurre en otros países de América Latina. En la ciudad de Armenia (Quindío) se ha instaurado un programa de la Secretaria de Salud de Armenia para la población vinculada que cubre alrededor de 900 gestantes y se detectan entre dos a cinco casos cada año. En esta ciudad se ha encontrado que se presenta mortalidad neonatal en la población no cubierta por el programa pero no en los hijos de madres detectadas y tratadas. En el resto del país en ausencia de intervención terapéutica entre 800 a 3000 recién nacidos nacen infectados cada año, así en Sincelejo (departamento de Sucre, Colombia) en 100 gestantes se encontraron dos seroconversiones y entre los hijos de estas madres se presentó un mortinato.[12]
En Brasil, se han encontrado prevalencias en población general de 50 a 76 %. La frecuencia de toxoplasmosis congénita varía de 0,2 a 2 %.
Las formas más graves pueden llevar a la muerte intrauterina o causar secuelas graves si la infección de la madre ocurre en la primera mitad de la gestación. Un estudio en una población en Brasil demostró una mayor cantidad (13,9 %) de mujeres embarazadas con toxoplasmosis activa (por la presencia de anticuerpos IgM) que con sífilis y la enfermedad de Chagas.[13]
Fuentes de infección
[editar]La fuente de infección puede variar de un país a otro e incluso de una región a otra dentro de un mismo país.[14] En Sudamérica por ejemplo, la principal fuente es el agua, incluso tratada con cloro, tal como lo han demostrado estudios en Brasil y Colombia.[15] En Europa, la convivencia con gatos no aumenta el riesgo de infección.[16] Otra fuente son los alimentos contaminados, principalmente la carne (cuando está poco cocinada, ya que un gran porcentaje está contaminada) y las frutas y verduras mal lavadas.[14]
Por otro lado, una persona que consume con la necesaria frecuencia verduras y frutas, puede consumirlas sin el adecuado lavado para eliminar el parásito en algún momento. También puede consumir alimentos que han sido manipulados por terceros sin poder supervisar si el lavado es suficiente (por ejemplo, en restaurantes).
La última vía de contagio suele producirse entre personas que trabajan la tierra con las manos, bien agricultores, bien en labores de jardinería. En los suelos suele estar presente el parásito en gran cantidad. Una persona que manipule la tierra con las manos desnudas puede introducir restos de tierra bajo las uñas. Pese a un lavado de manos con agua y jabón, siempre puede quedar tierra bajo las uñas. Después, si se lleva las manos a la boca, es fácil infectarse de este y/o de otros parásitos. Si es una persona que trabaja en el campo, no tiene por qué lavarse las manos cada vez que manipula esa tierra y en un descuido (o por mala costumbre) puede llevarse las manos sin lavar a la boca.[17][18]
Para que un gato pueda producir heces infecciosas tiene que contagiarse. Es decir, un gato que no está infectado y vive en una casa sin acceso al exterior y comiendo pienso o carne cocinada, no puede infectarse y por tanto no puede infectar a otros.
Si el gato tiene acceso al exterior o es silvestre, o come carne cruda, o caza pájaros o ratones y se los come, entonces sí puede infectarse.
Una vez infectado, incuba el parásito durante un periodo de entre 3 y 20 días (según la forma en la que lo ingiere, que determina la fase en la que se encuentra el parásito). Después y durante sólo un periodo de un mes, libera los ooquistes en las heces. Después de eso, aunque se vuelva a infectar, nunca más liberará ooquistes.
Para que esas heces con ooquistes (oocitos) sean a su vez infecciosas, necesitan un tiempo de exposición al medio de entre 24 y 48 horas. Es necesario limpiar al arenero con frecuencia, impidiendo que esos ooquistes maduren y sean infecciosos. Hay que evitar manipular las heces con las manos desnudas, y al terminar de limpiar el arenero, se deben lavar las manos inmediatamente, pues pudiera accidentalmente llevarse las manos a la boca. No sólo se puede introducir el Toxoplasma gondii en el organismo de esta manera, también otros parásitos, bacterias y virus, mucho más peligrosos e incluso letales como la Escherichia coli.
Por tanto, cualquier persona que conviva con un gato o varios como mascotas, incluso con acceso al exterior y hasta que coman a veces animales crudos cazados por ellos (es decir, gatos con riesgo de infectarse del parásito), con la más simple medida de higiene posible (el lavado de manos después de limpiar el arenero o usando guantes), evita infectarse del parásito.
Se sabe que el parásito cruza la placenta pudiendo transmitirse al feto, si la madre se infecta por primera vez durante el embarazo. Si la infección ocurrió antes de quedar embarazada, el nuevo bebé no puede ser infectado.[19] El riesgo es menor si la infección ocurrió en las últimas semanas de gestación. Con muchísima menos frecuencia, el parásito puede ser transmitido por transfusión de sangre, o trasplante de órganos.
En los casos en que se detecta que una mujer gestante se ha infectado del parásito, existen medicamentos que pueden ayudar a detener la infección para evitar daños al feto.
Ciclo de vida
[editar]La toxoplasmosis es una zoonosis de distribución mundial. Se infectan animales herbívoros, omnívoros o carnívoros, incluyendo casi todos los mamíferos. En la carne destinada a consumo humano es frecuente la presencia de quistes tisulares. Los invertebrados como moscas y cucarachas pueden contribuir a la difusión de los ooquistes, que acompañan a la defecación de los gatos. Los ooquistes que salen con las heces no son de inmediato infectantes, deben pasar por un proceso de diferenciación en la tierra que dura hasta tres semanas y pueden mantenerse infecciosos durante mucho tiempo en la tierra húmeda (aproximadamente un año).[20]

El parásito se presenta bajo tres distintas formas: taquizoito (un trofozoíto que puede encontrarse en casi cualquier órgano, principalmente el cerebro y músculos), quistes tisulares y ooquistes. Estos últimos sólo se producen en los intestinos del huésped definitivo.[21]
El ciclo vital de Toxoplasma tiene como huésped definitivo al gato o miembros de su familia, que tras ingerir alguna de las formas del parásito sufre una ciclo asexual en las células epiteliales de su intestino, luego un ciclo sexual, eliminándose en sus heces millones de ooquistes. Cuando estos esporulan se vuelven infecciosos pudiéndose infectar otros animales por su ingestión. Por debajo de 4 °C (grados Celsius), o por encima de 37 °C, no se produce la esporulación y los quistes no son infecciosos.
Los humanos sufren la transmisión del parásito fundamentalmente por vía oral a través de la ingesta de carnes, verduras, el agua, huevos, leche, u otros alimentos contaminados por ooquistes o que contienen quistes tisulares.
De hecho, hasta un 25 % de las muestras de carnes de cordero y cerdo presentan ooquistes, siendo menos frecuentes en la carne de vaca.[cita requerida]
Los gatos, sobre todo si se manipulan sus excreciones, pueden infectar al ingerir los ooquistes por las manos contaminadas.
Se ha estudiado con cierto detalle el importante papel que juegan los gatos en la eliminación de los ooquistes en la tierra como parte de la transmisión de la enfermedad. En algunas islas del Pacífico, se ha demostrado que la ausencia de gatos está asociada a la ausencia de anticuerpos humanos en contra de Toxoplasma y, al contrario, en regiones con prevalencia de anticuerpos están en proporción directa con la población de gatos o el contacto con la tierra contaminada por heces felinas.[2]
Los gatos se infectan al consumir roedores y aves, que son huéspedes intermediarios que contienen los quistes (con bradizoítos) que mantienen una infección crónica en estos animales.[2]
Los gatos son huéspedes definitivos de estos parásitos. Un huésped definitivo es un animal que el parásito necesita para madurar.
El perro, al igual que el ser humano, es un huésped intermediario cuyo contagio[22] se suele dar a través de las heces infectadas del gato. El perro suele infectarse por ingerir estas heces o por frotarse en ellas.
Además, el perro[23] también puede contagiarse por la ingestión de carne cruda contaminada con los huevos del parásito.
La segunda vía de transmisión humana es la materno-fetal o congénita dando origen a la toxoplasmosis congénita. Más rara es la transmisión por transfusiones o por recepción de órganos. El contagio interhumano de toxoplasmosis solo se ve en casos de la transmisión trasplacentaria.[20]
Cuadro clínico
[editar]Más del 80 % de las infecciones son asintomáticas. La toxoplasmosis puede ser aguda o crónica, sintomática o asintomática. La infección aguda recientemente adquirida suele ser asintomática en niños mayores y adultos; y en caso de presentar síntomas y signos (enfermedad aguda) estos suelen ser de corta duración y autolimitados, como una gripe o mononucleosis: dolor de cabeza, dolores musculares, inflamación de los ganglios linfáticos, e incluso presenta inflamación del hígado y mayoritariamente del bazo, etc.[19] En la mayoría de los casos persiste como quistes en los tejidos pero la persona no suele tener manifestaciones clínicas (infección crónica), pero en otros casos se presenta con formas clínicas persistentes o recurrentes (enfermedad crónica).
Se suelen diferenciar cuatro grandes categorías clínicas en el estudio de la toxoplasmosis:
- Toxoplasmosis aguda adquirida en el paciente inmunocompetente, pudiendo cursar con un cuadro subclínico y por lo tanto sin síntomas, haciendo que el paciente no tenga conocimiento de la infección. Cuando aparecen síntomas son generales, confundiéndose con una gran gama de posibles infecciones benignas y de rápido curso, pudiendo provocar: linfadenopatía, fiebre, mialgia y malestar general.
- Toxoplasmosis aguda adquirida o reactivada en el paciente inmunodeficiente, las formas clínicas más graves, incluyendo leucemia, enfermedades del tejido conectivo, los cuales pueden manifestarse en un 40 % de pacientes con sida, por ejemplo.[20] Los pacientes con terapias inmunosupresoras (glucocorticoides, por ejemplo) como para prevenir el rechazo de un órgano trasplantado o el tratamiento de una enfermedad autoinmunitaria, pertenecen a este grupo de alto riesgo.
- Toxoplasmosis ocular, como resultado de una infección congénita (aunque los signos aparezcan al cabo de varios años) con retinitis necrosante, uveítis y muy frecuentemente retinocoroiditis.
- Toxoplasmosis congénita. Las formas más graves pueden llevar a la muerte intra-uterina o causar secuelas graves si la infección de la madre ocurre en la primera mitad de la gestación.
Dentro de cualquiera de ellas las manifestaciones clínicas no son específicas y los métodos diagnósticos pueden prestarse a diferentes interpretaciones.
Diagnóstico
[editar]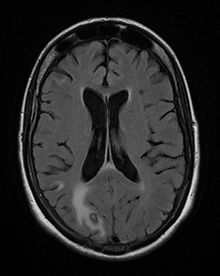
La toxoplasmosis puede ser diagnosticada al aislar el parásito por medio de inoculación de animales de laboratorio o cultivo celular o con un perfil serológico, el cual puede no ser confiable en inmunodeficientes y en el feto.[24] Existen sin embargo pruebas capaces de detectar los anticuerpos serológicos o en orina, creados por el sistema inmunitario para combatir el parásito, especialmente un incremento en los niveles de IgG y/o la presencia de anticuerpos específicos de IgM.[25] La evaluación clínica de recién nacidos durante el primer año de vida es, sin duda, necesaria en madres seropositivas o de alto riesgo.
Otros métodos indirectos incluyen reacciones de fijación de complemento, reacción con colorantes de Sabin y Feldman, pruebas de ELISA y la reacción de hemaglutinación indirecta. Es posible también demostrar la presencia del genoma del parásito con la técnica de PCR, un método importante debido a su alta sensibilidad y especificidad,[24] pues siempre que es positivo confirma el diagnóstico pero si es negativo no siempre lo excluye. El método de detección por PCR se utiliza en el diagnóstico de toxoplasmosis en el líquido amniótico, en el humor acuoso en toxoplasmosis ocular y en inmunosuprimidos.[26] La detección directa del parásito en tejidos infectados puede también resultar difícil, por ejemplo, de placenta o cerebro, incluyendo la fijación de anticuerpos fluorescentes.
Esto sumado a que la toxoplasmosis puede ser asintomática implica que un análisis puede indicar únicamente que el individuo nunca ha sido infectado por el parásito, o bien que el individuo ha tenido o está presentemente infectado con el parásito (sin distinción de uno u otro caso).
Una vez que un organismo tiene anticuerpos contra la toxoplasmosis, queda inmunizado contra la enfermedad. Por ello se recomienda a las mujeres que estén planeando quedar embarazadas, se hagan con anterioridad una prueba de anticuerpos de toxoplasmosis.
Demostración de Toxoplasma en LCR, humor acuoso, sangre, biopsias, esputo, placenta. Se usa reacción de Sabin y Feldman. También inmunofluorescencia indirecta, ELISA, hemaglutinación indirecta. Y una intradermorreacción con toxoplasmina.
Diagnóstico diferencial
[editar]De importancia en los casos más graves donde se ven los síntomas más notables, la toxoplasmosis puede confundirse con la leptospirosis,[27] enfermedad de Hodgkin y otros linfomas,[28] encefalitis, mononucleosis, miocarditis, pulmonía (tuberculosis) en inmunocomprometidos y sarcoidosis.[20]
Tratamiento
[editar]El parásito Toxoplasma gondii es sensible a los fármacos pirimetamina y las sulfamidas, las que se usan en combinación para el tratamiento de la toxoplasmosis incrementando más de seis veces el efecto de ellos individualmente.[29] Debido a que la pirimetamina bloquea el uso del ácido fólico, se debe añadir al tratamiento el ácido folínico, el cual puede ser usado por la médula ósea del paciente, mas no por el parásito. Los corticosteroides están contraindicados excepto en casos de toxoplasmosis con sintomatología ocular, en cuyo caso se usan en concentraciones bajas.[3] Aquellos pacientes alérgicos o que no toleran las sulfamidas deben consultar con sus profesionales de salud en busca de otras opciones como la Clindamicina.[30] Las madres embarazadas deben ser también tratadas al ser diagnosticadas con certeza y, a través de ellas, al feto, balanceando los posibles efectos secundarios del tratamiento sobre el feto y su madre.[31] Una de las secuelas de hipersensibilidad asociado a medicamentos durante el tratamiento de la toxoplasmosis es el síndrome de Stevens-Johnson, el cual es una reacción febril con lesiones en la piel y conjuntivitis purulenta, potencialmente letal.[32]
Para pacientes inmunosuprimidos, en especial pacientes con sida, el tratamiento debe continuarse de por vida para evitar la seria y frecuente posibilidad de reinfecciones o reactivación de una enfermedad latente.[29][33] Otra alternativa es la atovaquona, un antibiótico del grupo de las naftoquinolonas, pero que tiene el inconveniente del costo. En personas con toxoplasmosis latente, los quistes son inmunes a estos tratamientos, debido a que los antibióticos no llegan a los bradizoítos en suficiente concentración.
Profilaxis
[editar]La transmisión de la toxoplasmosis se puede prevenir evitando comer carne poco cocida o cruda, la carne debe cocinarse hasta que alcance una temperatura interna de 73 a 76 °C (grados Celsius); en la práctica, esto ocurre cuando el centro de la carne cocida ha perdido su color rosa. No manipular o tener contacto con las heces de gatos que interactúen con otros animales infectados (lo que significa que no todos los gatos están sujetos a riesgo), contaminación de cuchillos, y otros utensilios al preparar carne infectada, beber agua contaminada, ingerir la leche no pasteurizada; especialmente de cabra, aceptar la donación de órganos infectados (caso que es muy poco frecuente fuera del mercado negro).
Un brote epidémico en marzo de 1995 en Vancouver, Canadá, fue relacionado con la contaminación de la reserva de agua de la ciudad por un félido salvaje. En Brasil en 2004 una encuesta epidemiológica relacionó también el consumo de agua no filtrada con infección en estratos socioeconómicos desfavorecidos. Es posible que, como en el caso de Giardia o Cryptosporidium, la cloración no sea suficiente para eliminar el Toxoplasma en aguas tratadas y se requiera la filtración para reducir la transmisión. Estos nuevos datos colocan a la toxoplasmosis como enfermedad de transmisión hídrica lo que puede explicar su gran diseminación y la gran cantidad de casos que no se pueden relacionar con factores de riesgo conocidos.
En un estudio en Colombia[34] se encontró que en las gestantes del Quindío el 25 % de los casos con toxoplasmosis en el embarazo se atribuyó a tener gatos menores de 6 meses en la casa, 25 % a consumo de carne poco cocida y el tomar agua de bolsa o botella redujo el riesgo en un 50 %. Esto implica que hasta el 50 % de los casos pueden ser debidos en algunas zonas al consumo de agua contaminada. Estos datos indican que la toxoplasmosis transmitida por agua puede estar provocando la mayoría de casos, y por consiguiente, se requieren sistemas de monitoreo para la misma. Las mujeres embarazadas deben evitar consumir carne cruda o mal cocida, incluyendo embutidos, jamón serrano, chorizo, sushi, entre otros; lavar adecuadamente las verduras y hortalizas; evitar realizar tareas de jardinería, o llevarlas a cabo con guantes adecuados; como también tener especial cuidado e higiene con los animales domésticos, especialmente los gatos.
Hasta en el 50 % de los individuos infectados de forma aguda por T. gondii no es posible identificar la presencia de un factor de riesgo conocido para la infección aguda. Así pues, el intento por establecer si un paciente está expuesto al riesgo de padecer toxoplasmosis, únicamente según los antecedentes epidemiológicos, es una tarea inútil. Los pacientes pueden haberse infectado por T. gondii aunque no tuvieran gatos ni contacto con ellos, aunque no hubieran ingerido carne o mariscos poco cocidos, y aunque no hubieran bebido agua no tratada.
Consejos para la prevención en mujeres embarazadas
[editar]La prevención se basa en la evitar las fuentes de infección.
Aunque el acceso a información fiable sobre fuentes de infección es indudablemente importante, las revisiones sistemáticas no han encontrado evidencia de alta calidad de que dicha información cambie el comportamiento de las mujeres durante el embarazo.[35]
La evidencia de los estudios de control de casos de factores de riesgo en Europa ha identificado las siguientes fuentes principales de infección:[36]
- Los viajes a países menos desarrollados constituyen un importante factor de riesgo, especialmente en Sudamérica, donde predominan los genotipos parasitarios más virulentos.
- Las mujeres deben evitar beber agua sin filtrar en cualquier ambiente.
- Evite tener contacto con material contaminado con tierra. Debe tener una estricta higiene de las manos después de tocar el suelo. Las frutas y verduras deben lavarse antes de comer.
- La carne cruda o poco cocida es una fuente importante de infección. Las tablas de cortar, los cuchillos, los contadores y el fregadero se deben lavar después de la preparación de la comida. Evite el contacto con la boca al manipular la carne cruda. Las mujeres también deben evitar degustar la carne mientras cocina.
- La carne debe cocerse a 66° o superior, o congelada durante 24 horas en un congelador doméstico (a menos de −12 °C), ambos letales para los taquizoítos y los bradizoítos. La congelación de la carne antes del consumo parece ser la intervención más eficaz para prevenir la toxoplasmosis transmitida por la carne.
- La carne cocinada en estrictas condiciones de interior es menos probable que se contamine que la carne al aire libre.
- Hay evidencia débil de que la carne ahumada o curada en salmuera no es segura. El riesgo de infección es probable que aumente cuando los productos curados implican carne de más de un animal y el secado y el curado limitados, como en algunos métodos de producción locales.
- Existe alguna evidencia de que los mariscos pueden ser infectados con quistes de Toxoplasma.
- Ser propietario de un gato sólo está débilmente asociado con una infección aguda. Esto es probablemente porque los gatos sólo excretan ooquistes durante tres semanas de su vida, y las personas son tan probables de estar expuestos a oocistos excretados por el gato de otra persona. Sin embargo, parece razonable para las mujeres embarazadas con gatos a pedir a otra persona para cambiar la caja de arena a diario (heces de gato frescas no son infecciosas).
- El lavado de manos es la medida más importante para reducir la transmisión de microorganismos de un sitio a otro en el mismo paciente. Por lo tanto, el lavado de manos es importante después de actividades como la preparación de alimentos o jardinería.
Véase también
[editar]Referencias
[editar]- ↑ a b «Parasites - Toxoplasmosis (Toxoplasma infection) Epidemiology & Risk Factors». 26 de marzo de 2015. Consultado el 22 de agosto de 2015.
- ↑ a b c Dubey, J. P., Lindsay, D. S., Speer, C. A. «Structures of Toxoplasma gondii tachyzoites, bradyzoites, and sporozoites and biology and development of tissue cysts.» Clin Microbiol Rev. 1998; 11:267-299 En [1]. ISSN 0893-8512.
- ↑ a b Farreras Rozman: Medicina Interna, duodécima edición, 1992, ISBN 84-7592-439-5
- ↑ Flegr, J., Prandota, J., Sovičková, M., Israili, Z. H. (marzo de 2014). «Toxoplasmosis--a global threat. Correlation of latent toxoplasmosis with specific disease burden in a set of 88 countries». PLoS ONE 9 (3): e90203. PMC 3963851. PMID 24662942. doi:10.1371/journal.pone.0090203. «Toxoplasmosis is becoming a global health hazard as it infects 30-50% of the world human population.»
- ↑ Jones, J. L., Parise, M. E., Fiore, A. E. (2014). «Neglected parasitic infections in the United States: toxoplasmosis». Am. J. Trop. Med. Hyg. 90 (5): 794-9. PMC 4015566. PMID 24808246. doi:10.4269/ajtmh.13-0722.
- ↑ Torgerson, PR; Mastroiacovo, P (1 de julio de 2013). «The global burden of congenital toxoplasmosis: a systematic review.». Bulletin of the World Health Organization 91 (7): 501-8. PMID 23825877. doi:10.2471/blt.12.111732.
- ↑ a b Ferguson DJ (2009). «Toxoplasma gondii: 1908-2008, homage to Nicolle, Manceaux and Splendore». Memórias Do Instituto Oswaldo Cruz 104 (2): 133-48. PMID 19430635. doi:10.1590/S0074-02762009000200003.
- ↑ OTISpregnancy.org - Especialistas en Información de la Organización de Teratología. [2] Archivado el 6 de febrero de 2009 en Wayback Machine. Último acceso: 26 de octubre de 2007.
- ↑ Chesterton, J. R. y E. S. Perkins. «Ocular toxoplasmosis among Negro immigrants in London.» Br J Ophthalmol. 1967 September; 51(9): 617-621. [3]
- ↑ CHACIN-BONILLA, Leonor, SÁNCHEZ-CHÁVEZ, Yulaicy, ESTÉVEZ, Jesús et al. «Prevalence of human toxoplasmosis in San Carlos Island, Venezuela.» INCI. [online] ago. 2003, v. 28, n.º 8 [citado el 26 de octubre de 2007], pp. 457-462. Disponible en [4]. ISSN 0378-1844.
- ↑ RAMÍREZ R., Julia, CHÁVEZ V., Amanda, CASAS A. Eva et al. «Seroprevalencia de Toxoplasma gondii en alpacas de comunidades de la provincia de Canchis, Cusco.» Rev. investig. vet. Perú. [en línea]. julio/diciembre de 2005, v. 16, n.º 2 [citado el 26 de octubre de 2007], pp. 169-174. En [5]. ISSN 1609-9117.
- ↑ Gómez Marín, J. E., Castaño, J. C., Montoya, M. T. «Toxoplasmosis congénita en Colombia: Un problema subestimado de salud pública.» Colombia Médica 26: 66-70, 1995 en [6]ISSN 1657-9534.
- ↑ VAZ, Adelaide José, GUERRA, Elvira Maria, FERRATTO, Luzia Cristina Contim et al. «Positive sorology of syphilis, toxoplasmosis and Chagas' disease in pregnant women on their first visit to State Health Centes in a metropolitan area, Brazil.» Rev. Saúde Pública [en línea]. 1990, v. 24, n.º 5 [citado el 26 de octubre de 2007], pp. 373-379. En [7]. ISSN 0034-8910.
- ↑ a b Eskild Petersen. «What Do We Know About Risk Factors for Infection in Humans with Toxoplasma gondii and How Can We Prevent Infections?». Consultado el 10 de septiembre de 2016.
- ↑ «Toxoplasma gondii | Global Water Pathogen Project». www.waterpathogens.org. Consultado el 10 de septiembre de 2016.
- ↑ Cook, A. J. C.; Holliman, Richard; Gilbert, R. E.; Buffolano, W.; Zufferey, J.; Petersen, E.; Jenum, P. A.; Foulon, W. et al. (15 de julio de 2000). «Sources of toxoplasma infection in pregnant women: European multicentre case-control studyCommentary: Congenital toxoplasmosis—further thought for food». BMJ (en inglés) 321 (7254): 142-147. ISSN 0959-8138. PMID 10894691. doi:10.1136/bmj.321.7254.142. Consultado el 10 de septiembre de 2016.
- ↑ «Parasites - Toxoplasmosis (Toxoplasma infection) Biology». 17 de marzo de 2015. Consultado el 22 de agosto de 2015.
- ↑ «Parasites - Toxoplasmosis (Toxoplasma infection) Diagnosis». 10 de enero de 2013. Consultado el 22 de agosto de 2015.
- ↑ a b American Academy of Family Physicians (15 de mayo de 2003). «Toxoplasmosis» (en inglés). Consultado el 12 de diciembre de 2009.
- ↑ a b c d Enfermedades infecciosas: toxoplasmosis, en eMedicine.com. Último acceso: 26 de octubre de 2007.
- ↑ Sánchez Amador, Samuel (2020). «Toxoplasmosis: causas, síntomas y tratamiento».
- ↑ «Contagio de la toxoplasmosis en perros».
- ↑ «Síntomas de toxoplasmosis en perros».
- ↑ a b VIDIGAL, Paula Vieira Teixeira, SANTOS, Daniel Vítor Vasconcelos, CASTRO, Flávia Cipriano et al. «Prenatal toxoplasmosis diagnosis from amniotic fluid by PCR.» Rev. Soc. Bras. Med. Trop. [online] 2002, v. 35, n.º 1 [citado el 31 de octubre de 2007], pp. 1-6. En [8]. ISSN 0037-8682.
- ↑ FACHADO, Alberto, FONTE, Luis, ALBERTI, Esteban et al. «Usefulness of the detection of Toxoplasma gondii antigens in AIDS patients.» Rev. Inst. Med. trop. S. Paulo [online] 1994, v. 36, n.º 6 [citado el 26 de octubre de 2007], pp. 525-529. En [9]. ISSN 0036-4665.
- ↑ Ponce, N., Gómez, J. E. «Estandarización y validación clínica de la prueba de reacción en cadena de la polimerasa (PCR) para diagnóstico de toxoplasmosis cerebral en pacientes infectados por el VIH.» Infectio 2003; 7: 8-14. Disponible en: [10].
- ↑ Velasco-Castrejón, Oscar; Guadalupe Tenorio y Beatriz Rivas-Sánchez. «Diagnóstico diferencial entre toxoplasmosis y leptospirosis de 26 casos mexicanos de uveitis posterior.» REV CUBANA MED TROP 2005;57(1):77-8. [11]
- ↑ Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. [12] Archivado el 16 de octubre de 2007 en Wayback Machine.
- ↑ a b Gómez, J. E., Ruiz, B., Silva, P., Beltrán, S., Cortés, J., Montoya, J., Agudelo, A. «Guía de práctica clínica para toxoplasmosis durante el embarazo y toxoplasmosis congénita en Colombia.» Infectio 2007; 11: 129-141. En [13]. ISSN 0123-9392.
- ↑ Toxoplasmosis, en aidsMeds.com. Último acceso: 26 de octubre de 2007.
- ↑ Diagnóstico y tratamiento de la toxoplasmosis, en guiaInfantil.com. Último acceso: 26 de octubre de 2007.
- ↑ RAMOS CASTRILLO, A. I. y TEJADA DE PALACIOS. «Síndrome de Stevens-Johnson tras tratamiento por toxoplasmosis ocular.» Arch Soc Esp Oftalmol [en línea], 2004, v. 79, n.º 11 [citado el 27 de octubre de 2007], pp. 569-572. En [14]. ISSN 0365-6691.
- ↑ Gómez, J. E., Alvarado, F., Hernández, C., Cuervo, S., Saravia, J. «Tratamiento de la fase aguda de la toxoplasmosis cerebral con Clindamicina-Falcidar (pirimetamina-sulfadoxina) en pacientes infectados por VIH.» Infectio 5 (3): 163-169; 2001. En [15]. ISSN 0123-9392.
- ↑ [16]
- ↑ Gollub EL, Leroy V, Gilbert R, et al. Effectiveness of health education on Toxoplasma-related knowledge, behaviour, and risk of seroconversion in pregnancy. Eur J Obstet Gynecol Reprod Biol 2008; 136:137.
- ↑ Opsteegh, M.; Kortbeek, T. M.; Havelaar, A. H.; Giessen, J. W. B. van der. «Intervention Strategies to Reduce Human Toxoplasma gondii Disease Burden». Clinical Infectious Diseases 60 (1): 101-107. doi:10.1093/cid/ciu721.
Enlaces externos
[editar]- Toxoplasmosis, en cdc.gov (en inglés).
- "La toxoplasmosis en perros"
- https://web.archive.org/web/20071108223025/http://www.seimc.org/documentos/protocolos/microbiologia/
- Toxoplasmosis. Avances recientes, acceso abierto en libro publicado en septiembre de 2012 (en inglés).


 French
French Deutsch
Deutsch