Antagoniste de la vitamine K — Wikipédia

Les anti-vitamine K ou AVK (en anglais VKA Vitamin K antagonist) forment une classe d'anticoagulants. Ils réduisent la coagulation du sang en inhibant l'action de la vitamine K.
Types
[modifier | modifier le code]Coumarines
[modifier | modifier le code]Les coumarines sont les AVK les plus couramment utilisés aux États-Unis et en Grande-Bretagne, à tel point que parfois les termes sont synonymes.
En médecine, le plus couramment utilisé des AVK est la warfarine[1]. Le mécanisme primaire de la warfarine est l'inhibition de la vitamine K époxyde réductase (en).
L'acénocoumarol (Sintrom) est l'un des plus vendus en Espagne, à tel point que les centres anticoagulation sont appelés Sintrom
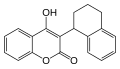
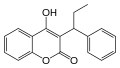
- Coumaphène ou warfarine
Autres AVK
[modifier | modifier le code]Tous les AVK ne sont pas des coumarines. Par exemple, la fluindione est un antagoniste de la vitamine K[2] sans être une coumarine. C'est l'anti-vitamine K le plus vendu en France sous la marque Previscan.
Un autre exemple est la phénindione[3].
Beaucoup de AVK non-coumariniques sont des dérivés de l'indane-1,3-dione.
Historique
[modifier | modifier le code]Les anti-vitamine K ont été découverts par hasard dans les années 1920, à la suite de l'étude d'une épidémie d'hémorragies observée chez des troupeaux de bétail ayant consommé du foin de mélilot gâté[4]. Ils sont ainsi employés originellement dans la composition de la « mort-aux-rats », provoquant des hémorragies intestinales globales conduisant à la mort de l'animal.
Modalité d'action des anti-vitamines K
[modifier | modifier le code]L'inhibition par anti-vitamine K est due à un effet de compétition avec la vitamine K sur la vitamine K-époxyde réductase, une enzyme qui permet la régénération de la vitamine K (KH2) à partir de la vitamine K oxydée sous forme d'époxyde KO.
La synthèse des protéines vitamines K-dépendantes actives diminue alors plus ou moins rapidement (selon leur demi-vie notamment) et fortement du plasma sanguin. Le sang coagule alors plus difficilement et des troubles métaboliques apparaissent (ex. : défaut de formation d'ostéocalcine par l'os).
Ce mécanisme explique trois caractéristiques médicalement et toxicologiquement importantes des AVK :
- l'effet anti-VK (ou AVK) ne se manifeste qu'in vivo (un ajout d'anti-vitamine K dans le sang in vitro est sans effet sur la coagulation ;
- l'effet n'apparaît qu'après 24 heures environ (y compris en cas d'administration intraveineuse). Il est maximal vers le deuxième jour ;
- il perdure quelques jours après arrêt du traitement.
Les AVK traversent la barrière placentaire, ce qui n'est pas le cas de l'héparine[5]. Si des AVK sont administrés à la mère en début de grossesse, ils sont tératogènes (source d'hydrocéphalies, d'hypoplasies nasales, d'atteintes osseuses (chondrodysplasies), peut-être en inhibant la formation de l'ostéocalcine[5]. Administrés en fin de grossesse, les AVK risquent de provoquer des hémorragies chez le nouveau-né[5].
Prescription
[modifier | modifier le code]Ces médicaments sont donnés par voie orale et sont donc plus pratiques d'utilisation que l'héparine en injection, quelle que soit sa forme.
Les AVK sont prescrits dans les situations où un risque de caillot sanguin est majeur : obturation d'artères coronaires (infarctus du myocarde ou angine de poitrine), sténose carotidienne, phlébite, fibrillation auriculaire, prothèses valvulaires artificielles, etc. Ils peuvent être donnés soit en préventif, soit en curatif, une fois le caillot constitué, pour en éviter l'extension, comme lors d'une embolie pulmonaire.
L'usage d'AVK se fait sous surveillance régulière du temps de Quick (ou taux de prothrombine), ou plus souvent aujourd'hui de l'INR (International Normalized Ratio) et nécessite donc des prélèvements sanguins réguliers pour ces analyses. L'INR, de 1 chez le sujet sain, doit être maintenu entre 2 et 4 le plus souvent, variable selon la situation traitée (entre 2 et 3 pour la prévention des maladies thrombo-emboliques veineuses et en cas de fibrillation auriculaire[6], entre 2,5 et 3,5 pour les porteurs de certaines prothèses valvulaires et les malades cardiaques, et entre 3 et 4,5 dans le cas des prothèses cardiaques de type mécanique (et non biologique)). La modification de la dose d'un AVK a un effet retardé sur l'INR, à cause de sa très longue demi-vie due à sa fixation aux protéines plasmatiques. Cela complique quelque peu la stabilisation de l'INR. L'utilisation de boîtiers électroniques miniaturisés permettant la mesure quasi instantanée de l'INR sur une goutte de sang, permet un pilotage plus aisé des doses d'AVK. Ces boîtiers sont apparus depuis les années 1990 et améliorent sensiblement l'efficacité de ces médicaments en diminuant notamment le nombre d'événements de type thrombo-embolique[7].
Risques
[modifier | modifier le code]Risques hémorragiques
[modifier | modifier le code]Les AVK exposent à des phénomènes hémorragiques : hématomes, saignements divers (nez, gencives, etc. ), hémorragies cérébrales, etc., particulièrement en cas de surdosage dont témoigne un INR supérieur à 5. Ces effets sont lentement réversibles, l'INR restant élevé plusieurs jours après leur arrêt, ce qui fait préférer les anticoagulants injectables en cas de situation à haut risque hémorragique (opération chirurgicale par exemple). En cas d'urgence, il peut être prescrit de la vitamine K, voire la transfusion de facteurs de la coagulation sous forme de fractions de plasma.
Il existe de nombreuses interactions alimentaires et médicamenteuse conduisant soit à une diminution de son efficacité, soit à une majoration du risque hémorragique. Cela explique la nécessité d'un contrôle régulier des INR. Par exemple, les aliments riches en vitamine K (légumes à feuilles vertes, certaines huiles, foie, etc.) diminuent leur efficacité.
Les AVK sont métabolisés par le cytochrome P450 de type CYP2C9 en des métabolites inactifs[8]. Tout ce qui modifie le fonctionnement de ce cytochrome peut donc modifier l'INR. Ce sont essentiellement la coprescription de médicaments passant par ce même cytochrome qui en sont responsables (anti-inflammatoires non stéroïdiens, antidiabétiques oraux, phénytoïne (anticonvulsant) et losartan).
Calcification de l'athérome
[modifier | modifier le code]Leur utilisation est associée à une accélération de la calcification de l'athérome ainsi qu'à une fragilisation de celui-ci[9].
Autres
[modifier | modifier le code]Les AVK peuvent causer des malformations congénitales (tératogènes)[10].
La vitamine K intervient également dans le métabolisme osseux, facilitant l'incorporation de l'ostéocalcine dans l'os. Il existe ainsi un risque de fragilisation osseuse[11] conduisant à une augmentation du risque de fractures, en particulier vertébrales et costales[12].
Prévention, formation, communication
[modifier | modifier le code]En France, la conférence nationale de santé de visait à réduire les accidents iatrogènes évitables, médicamenteux et non médicamenteux. Dès 1999, les autorités sanitaires, via notamment l'Afssaps ont poussé l'évaluation et des risques iatrogènes médicamenteux. Leur première action de sensibilisation a porté sur les risques d'accidents hémorragiques provoqués par les anticoagulants de la classe des antivitamine K (AVK), qui en France arrivaient au premier rang des accidents iatrogènes entraînant une hospitalisation[13]
Utilisations autres
[modifier | modifier le code]Les AVK sont aussi utilisés comme rodenticides[14]. Cependant apparaissent aussi des résistance aux rodenticides.
Notes
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Vitamin K antagonist » (voir la liste des auteurs).
- (en) Ansell J, Hirsh J, Hylek E, Jacobson A, Crowther M, Palareti G, « Pharmacology and management of the vitamin K antagonists: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition) », Chest, vol. 133, no 6 Suppl, , p. 160S–198S (PMID 18574265, DOI 10.1378/chest.08-0670, lire en ligne)
- (en) Mentré F, Pousset F, Comets E, et al., « Population pharmacokinetic-pharmacodynamic analysis of fluindione in patients », Clin. Pharmacol. Ther., vol. 63, no 1, , p. 64–78 (PMID 9465843, DOI 10.1016/S0009-9236(98)90122-9)
- (en) « Foreword: contemporary issues in the management and treatment of atrial fibrillation -- Agnelli 7 (2005): C3 -- European Heart Journal Supplements » (consulté le )
- Mueller RL, Scheidt S, History of drugs for thrombotic disease: discovery, development, and directions for the future, Circulation, 1994;89:432–449
- Pharmacorama, Médicaments modifiant la synthèse de facteurs de la coagulation, sur pharmacorama.com (consulté le 21 novembre 2012)
- Singer DE, Chang Y, Fang MC et al. Should patient characteristics influence target anticoagulation intensity for stroke prevention in nonvalvular atrial fibrillation?, Circ Cardiovasc Qual Outcomes, 2009;2:297-304
- Garcia-Alamino JM, Ward AM, Alonso-Coello P, Perera R, Bankhead C, Fitzmaurice D, Heneghan CJ, Self-monitoring and self-management of oral anticoagulation, Cochrane Database of Systematic Reviews, 2010, Issue 4. Art. No.: CD003839
- Rettie AE, Korzekwa KR, Kunze KL et al. Hydroxylation of warfarin by human cDNA-expressed cytochrome P-450: a role for P-450 2C9 in the etiology of (S)-warfarin-drug interactions, Chem Res Toxicol, 1992;5:54–59
- Schurgers LJ et al., Vitamin K-antagonists accelerate atherosclerotic calcification and induce a vulnerable plaque phenotype, Department of Biochemistry, Cardiovascular Research Institute Maastricht, Maastricht University Medical Centre, 2012
- (en) Schaefer C, Hannemann D, Meister R, et al., « Vitamin K antagonists and pregnancy outcome. A multi-centre prospective study », Thromb. Haemost., vol. 95, no 6, , p. 949–57 (PMID 16732373, DOI 10.1160/TH06-02-0108, lire en ligne)
- Sugiyama T, Kugimiya F, Kono S, Kim YT, Oda H, Warfarin use and fracture risk: an evidence-based mechanistic insight, Osteoporos Int, 2015;26:1231-1232
- Caraballo PJ, Heit JA, Atkinson EJ et al. Long-term use of oral anticoagulants and the risk of fracture, Arch Intern Med, 1999;159:1750-1756
- Dossier AFSSAPS, consulté 2010/12/13
- (en) Griminger P, « Vitamin K antagonists: the first 50 years », J. Nutr., vol. 117, no 7, , p. 1325–9 (PMID 3302140, lire en ligne)


 French
French Deutsch
Deutsch