Facilitation de l'infection par des anticorps — Wikipédia
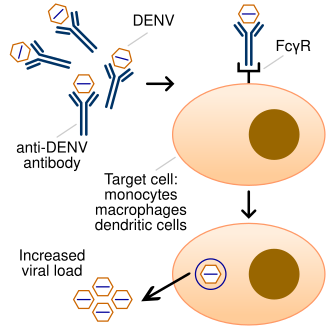
La facilitation de l'infection par des anticorps (Antibody-dependant enhancement ou ADE en anglais) est un phénomène se produisant lors d'une infection virale, quand des anticorps non neutralisants de l'hôte facilitent l'entrée du virus dans certaines cellules hôtes, et parfois aussi sa réplication[1].
Les anticorps ont normalement trois fonctions immunitaires principales : se lier à l'antigène (virus notamment), activer le système du complément et recruter des cellules immunocompétentes. Il y a facilitation de l'infection par des anticorps quand des anticorps qui se lient aux particules virales puis aux récepteurs gamma Fc (FcγR) exprimés sur les cellules immunitaires, augmentent ce faisant la probabilité que les virus infectent ces cellules (normalement chargées de défendre l'organisme contre les infections). Ce phénomène permet à certains virus d'infecter des cellules ne possédant pas le récepteur permettant l'entrée du virus. Il confère à certains virus une infectiosité et une virulence accrues.
L'existence du phénomène de facilitation de l'infection par des anticorps (d'abord très controversée[2]) a été observée et démontrée dans les années 2010, d'abord en médecine tropicale, sur des flavivirus sources de maladies vectorielles transmises par des moustiques (virus de la dengue, virus de la fièvre jaune et virus Zika[3],[4]) puis sur le virus de l'immunodéficience humaine, et il est soupçonné chez d'autres virus. La question porte également, dans le cadre de la pandémie de Covid-19, sur certaines formes graves de la maladie que l'on suppose induites par une ou plusieurs infections antérieures par d'autres coronavirus[5].
Dans le cas de maladies virales « facilitées » par un ADE, ce phénomène peut entraver le développement d'un vaccin, car ce dernier peut justement provoquer la production d'anticorps qui, via l'ADE, aggraveraient ensuite la maladie contre laquelle le vaccin a été conçu. L'hypothèse de la facilitation implique, par exemple dans le cas de la dengue, que l'industrie pharmaceutique produise un vaccin tétravalent[6], beaucoup plus difficile à concevoir[7]. Ainsi les candidats vaccins contre le virus de la dengue et contre le virus de la péritonite infectieuse féline (un coronavirus qui infecte le chat) ont dû être abandonnés parce qu'ils provoquaient une telle réaction[8].
Mécanismes
[modifier | modifier le code]Les mécanismes de la facilitation de l'infection par des anticorps ne sont pas encore totalement élucidés, mais plusieurs hypothèses ont été émises, probablement complémentaires et s'appuyant sur plus d'un mécanisme.
L'hypothèse générale est que certaines cellules du système immunitaire (monocytes/macrophages) ne disposent pas sur leur surface des récepteurs habituels que le virus utilise pour entrer dans ces cellules, mais qu'elles ont des « récepteurs Fc » qui se lient à une extrémité des anticorps. Un virus capable de se lier à l'autre extrémité de l'anticorps pourrait ainsi utiliser cet anticorps comme une « clé » pour pénétrer et infecter la cellule immunitaire. Habituellement, le processus de phagocytose s'accompagne d'une dégradation du virus, cependant, si le virus n'est pas neutralisé (en raison d'une faible affinité de liaison ou d'un ciblage vers un épitope non neutralisant), la liaison d'anticorps peut entraîner la fuite du virus et, par conséquent, infection accrue. Ainsi, la phagocytose peut provoquer une réplication virale, avec la mort subséquente des cellules immunitaires. Le virus « trompe » le processus de phagocytose des cellules immunitaires et utilise les anticorps de l'hôte comme un cheval de Troie. L'ADE peut se produire en raison de la caractéristique non neutralisante de l'anticorps, qui se lie à des épitopes viraux autres que ceux impliqués dans l'attachement et l'entrée de la cellule hôte. L'ADE peut également se produire parce que les anticorps sont présents à des concentrations sous-neutralisantes (donnant des taux d'occupation sur les épitopes viraux en dessous du seuil de neutralisation)[9],[10].
En outre, l'ADE peut être induit lorsque la force de l'interaction anticorps-antigène est inférieure à un certain seuil[11],[12]. Ce phénomène pourrait entraîner à la fois une augmentation de l'infectivité et de la virulence.
L'ADE peut survenir pendant le développement d'une infection virale primaire ou secondaire, ainsi qu'après la vaccination avec une provocation virale ultérieure[13],[14],[15] Les virus qui peuvent causer l'ADE partagent fréquemment des caractéristiques communes telles que la diversité antigénique, les capacités à se répliquer et à établir la persistance dans les cellules immunitaires[13].
Le virus de la dengue utilise, au moins dans certains cas, ce mécanisme pour infecter les macrophages humains de personnes précédemment infectées avec une souche différente du virus. Un virus, normalement bénin, et restant bénin chez ceux qui sont infectés pour la première fois, peut alors chez ces personnes causer une infection virale grave et potentiellement mortelle[16].
Celles-ci impliquent notamment la formation de complexes « anticorps-virus, » ou de complexes « composant du système du complément-virus »[17].
Il est supposé que, dans la majorité des cas, les anticorps impliqués dans ce phénomène sont des anticorps neutralisants d'un autre virus, ou d'un autre sérotype du virus, comme dans le cas de la dengue[18].
Les anticorps produits par des lymphocytes B mémoires réactivés (ou transmis par voie materno-fœtale)[19],[20], pourraient non seulement être peu efficaces pour neutraliser le nouveau sérotype viral, mais ces anticorps « à réactivité croisée » pourraient se lier à la particule virale pour former avec elle un complexe facilitant l’infection de toute cellule portant le récepteur Fc, telles que les monocytes/macrophages[21]. La réplication virale, alors plus rapide et plus intense, pourrait alors aggraver la maladie (virémie et sévérité clinique accrues)[22],[23],[24],[25],[26]. En outre, le virus qui infecte des monocytes et macrophages pourrait induire une présentation d’antigènes viraux et l’activation de lymphocytes T mémoires à réactivité croisée[27] (générés lors d'une primo-infection), qui prolifèrent alors à l'occasion d’une seconde infection[28],[29] et sécrètent massivement des cytokines proinflammatoires (IFNγ et TNFα par exemple)[30],[31], pouvant entraîner de graves dommages vasculaires (dont hémorragies et choc cytokinique).
Virus concernés
[modifier | modifier le code]De nombreux virus sont potentiellement concernés par la facilitation de l'infection par des anticorps, mais souvent, c'est uniquement in vitro que les preuves d'une facilitation de l'infection par des anticorps ont été trouvées.
Virus de la dengue
[modifier | modifier le code]Le virus de la dengue peut entraîner des formes sévères de dengue hémorragique ; et il a été noté que l'histoire immunologique du patient influe aussi sur le déroulement clinique de l’infection : des études épidémiologiques ont mis en avant une incidence accrue d'un syndrome de choc de dengue (ou DSS pour « dengue shock syndrome ») en cas d'infection secondaire par un sérotype viral différent de celui ayant provoqué la primo-infection[32],[33],[34]. C'est dans ce contexte qu'a été avancé en 1970 l'hypothèse de la facilitation de l'infection par les anticorps[35],[36] ; c'était alors la première mention de ce phénomène.
Les quatre sérotypes existants de la dengue sont à l'origine de ce phénomène.
- Une première infection par un sérotype donné du virus de la dengue génère des anticorps neutralisants (monotypes), entraînant une protection vis-à-vis du sérotype de virus de la dengue concerné, et d'autres anticorps hétérotypes, potentiellement actifs pour les quatre sérotypes. Cette première infection cause une dengue « bénigne ».
- Une seconde infection, par un autre sérotype du virus de la dengue, utilisera les anticorps hétérotypes générés précédemment pour infecter plus facilement le sujet. Une dengue hémorragique, beaucoup plus grave, peut alors survenir[37].
La facilitation de l'infection par les anticorps est suspectée dans les complications liées au vaccin contre la dengue (Dengvaxia, développé par Sanofi Pasteur)[38].
Virus de l'immunodéficience humaine
[modifier | modifier le code]La facilitation de l'infection par des anticorps est suspectée lors de l'infection par le VIH[39]. Dans ce contexte, des tests in vitro ont montré l'existence du phénomène. Cependant, cela n'a pas encore été démontré in vivo, et l'impact de la facilitation de l'infection du VIH par des anticorps reste peu connu. La seule existence de ce phénomène reste cependant préoccupante, notamment par rapport aux essais vaccinaux dirigés contre le VIH[40].
Autres virus ?
[modifier | modifier le code]La facilitation de l'infection par des anticorps a été décrite ou suspectée pour d'autres virus, mais généralement uniquement in vitro[41].
- Ce phénomène peut ainsi être observé in vitro lors d'infections à entérovirus. Il pourrait jouer un rôle dans la pathogénèse du diabète de type 1[42],[43].
- La facilitation de l'infection du SRAS par des anticorps a été également suspectée dans les années 2010[44], de même en 2020 pour le SARS-CoV-2 (responsable de la COVID-19 et donc de la pandémie de COVID-19), mais, selon Anuj Sharma (Uniformed Services University of the Health Sciences, Bethesda), en mars 2020, il était encore trop tôt pour en être certain[41]. Sharma note que divers coronavirus ont une réactivité croisée, avec donc des réponses d'anticorps réactifs croisées[45]. Hormis pour les sérotypes du virus de la dengue, qui a démontré l'existence d'une facilitation de l'infection par des anticorps dans le modèle animal (voir plus haut), pour d'autres virus la preuve des niveaux d'anticorps sous-neutralisants a essentiellement été faite in vitro sur des cultures cellulaires. Or dans le domaine de l'étude des virus, notamment chez les coronavirus, les démonstrations in vitro (pour la recherche d'efficacité de médicaments par exemple), fréquemment, n'ont pas été confirmées in vivo. In vitro, un manque de réponse immunitaire innée/adaptative des cellules cultivées peut induire une réduction des niveaux d'anticorps neutralisants, qui avec l'absence de réponse immunitaire innée d'autres cellules peut entraîner une « facilitation de l'infection par des anticorps » artificielle qui n'aurait éventuellement pas lieu in vivo. Par ailleurs, le diabète et les maladies cardiovasculaires se sont montrés prédicteurs d'un risque de forme grave de la COVID-19, or ces deux maladies sont connues comme causes de dysfonctionnement de la réponse immunitaire[46],[47]. Telle que rapporté par Channappanavar et al., la dérégulation immunitaire peut faciliter une pneumonie atypique létale par le SRAS-CoV[48]. Selon une étude parue en janvier 2022, aucun phénomène de facilitation de l'infection par des anticorps n'est causé par les vaccins anti-covid[49].
Limites
[modifier | modifier le code]L'hypothèse de la facilitation par les anticorps est cependant parfois contredite ou questionnée (même pour la dengue) :
- des études épidémiologiques ne confirment pas son universalité selon S Devignot et al. en 2010[50], citant Devrais & al. (2009)[51] ;
- en zone d’endémie de dengue, les anticorps maternels semblent plutôt protéger l'enfant que faciliter l'infection[52] ;
- des chocs DSS se manifestent parfois lors de primo-infection[53],[54] ;
- des infections secondaires non compliquées de syndrome de choc existent[55].
Voir aussi
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]- Anticorps
- Immunité à médiation cellulaire
- Immunité humorale
- Réponse polyclonale (en)
- Péché originel antigénique
Bibliographie
[modifier | modifier le code]- Deutsch S (1975) Études sur la spécificité des anticorps produits par des cellules isolées, en réponse à des stimulations secondaires hétérologues (Doctoral dissertation).
- (en) Juthathip Mongkolsapaya, Wanwisa Dejnirattisai, Xiao-ning Xu et Sirijitt Vasanawathana, « Original antigenic sin and apoptosis in the pathogenesis of dengue hemorrhagic fever », Nature Medicine, vol. 9, no 7, , p. 921–927 (ISSN 1078-8956 et 1546-170X, DOI 10.1038/nm887, lire en ligne, consulté le )
Notes et références
[modifier | modifier le code]- (en) Sol M. Cancel Tirado et Kyoung-Jin Yoon, « Antibody-Dependent Enhancement of Virus Infection and Disease », Viral Immunology, vol. 16, no 1, , p. 69–86 (ISSN 0882-8245 et 1557-8976, DOI 10.1089/088282403763635465, lire en ligne, consulté le )
- Deparis X, Maréchal V, Matheus S., « Mécanismes physiopathologiques de la dengue : revue critique des hypothèses », Med Trop, 2009, n°69, p. 351-357.
- Rekha Khandia, Ashok Munjal, Kuldeep Dhama et Kumaragurubaran Karthik, « Modulation of Dengue/Zika Virus Pathogenicity by Antibody-Dependent Enhancement and Strategies to Protect Against Enhancement in Zika Virus Infection », Frontiers in Immunology, vol. 9, , p. 597 (ISSN 1664-3224, PMID 29740424, PMCID PMC5925603, DOI 10.3389/fimmu.2018.00597, lire en ligne, consulté le )
- (en) S. Plotkin et W. Orenstein, « Yellow fever vaccine », dans Vaccines, Amsterdam, Elsevier, (ISBN 978-1-4557-3798-7, lire en ligne), p. 870–968
- (en) Jason A. Tetro, « Is COVID-19 receiving ADE from other coronaviruses? », Microbes and Infection, vol. 22, no 2, , p. 72–73 (PMID 32092539, PMCID PMC7102551, DOI 10.1016/j.micinf.2020.02.006, lire en ligne, consulté le ).
- Thomas S, Redfern JB, Lidbury BA, Mahalingam S. Antibody-dependent enhan- cement and vaccine development. Expert Rev Vaccines 2006 ; 5 : 409-12.
- Durbin AP, Whitehead SS. Dengue vaccine candidates in development. Curr Top Microbiol Immunol 2010 ; 338 : 129-43
- (en) Lynne Peeples, « News Feature: Avoiding pitfalls in the pursuit of a COVID-19 vaccine », Proceedings of the National Academy of Sciences, vol. 117, no 15, , p. 8218–8221 (ISSN 0027-8424 et 1091-6490, DOI 10.1073/pnas.2005456117, lire en ligne, consulté le ).
- Wilder-Smith A, Hombach J, Ferguson N, Selgelid M, O'Brien K, Vannice K, Barrett A, Ferdinand E, Flasche S, Guzman M, Novaes HM, Ng LC, Smith PG, Tharmaphornpilas P, Yoon IK, Cravioto A, Farrar J, Nolan TM, « Deliberations of the Strategic Advisory Group of Experts on Immunization on the use of CYD-TDV dengue vaccine », The Lancet. Infectious Diseases, vol. 19, no 1, , e31–e38 (ISBN 978-981-15-1044-1, PMID 30195995, PMCID 7119964, DOI 10.1007/978-981-15-1045-8_2)
- Klasse PJ, « Neutralization of Virus Infectivity by Antibodies: Old Problems in New Perspectives », Advances in Biology, vol. 2014, , p. 1–24 (PMID 27099867, PMCID 4835181, DOI 10.1155/2014/157895
 )
) - Iwasaki A, Yang Y, « The potential danger of suboptimal antibody responses in COVID-19 », Nature Reviews. Immunology, vol. 20, no 6, , p. 339–341 (PMID 32317716, PMCID 7187142, DOI 10.1038/s41577-020-0321-6
 )
) - Ricke D, Malone RW, « Medical Countermeasures Analysis of 2019-nCoV and Vaccine Risks for Antibody-Dependent Enhancement (ADE) », SSRN Working Paper Series, (ISSN 1556-5068, DOI 10.2139/ssrn.3546070, S2CID 216395996)
- Tirado SM, Yoon KJ, « Amélioration de l'infection virale et de la maladie dépendante des anticorps », Immunologie virale, vol. 16, , p. 69-86 (PMID 12725690, DOI 10.1089/088282403763635465)
- Tay MZ, Wiehe K, Pollara J, « Antibody-Dependent Cellular Phagocytosis in Antiviral Immune Responses », Frontiers in Immunology, vol. 10, , p. 332 (PMID 30873178, PMCID 6404786, DOI 10.3389/fimmu.2019.00332
 )
) - Smatti MK, Al Thani AA, Yassine HM, « Viral-Induced Enhanced Disease Illness », Frontiers in Microbiology, vol. 9, , p. 2991 (PMID 30568643, PMCID 6290032, DOI 10.3389/fmicb.2018.02991
 )
) - Dimmock NJ, Easton AJ, Leppard K (2007) Introduction to modern virology. Malden, MA: Blackwell Pub. p. 65. (ISBN 978-1-4051-3645-7)
- Ayato Takada et Yoshihiro Kawaoka, « Antibody-dependent enhancement of viral infection: molecular mechanisms and in vivo implications », Reviews in Medical Virology, vol. 13, , p. 387–398 (ISSN 1052-9276, PMID 14625886, DOI 10.1002/rmv.405, lire en ligne, consulté le )
- « La Dengue : 4 virus, l’homme et le moustique… – Institut Pasteur de Nouvelle-Calédonie »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur institutpasteur.nc (consulté le ).
- Kliks SC, Nimmanitya S, Nisalak A, Burke DS. Evidence that maternal dengue antibodies are important in the development of dengue hemorrhagic fever in infants. Am J Trop Med Hyg 1988; 38 : 411-9
- Simmons CP, Chau TN, Thuy TT, Tuan NM, Hoang DM, Thien NT, et al. Maternal antibody and viral factors in the pathogenesis of dengue virus in infants. J Infect Dis 2007 ; 196 : 416-24.
- Halstead SB, O'Rourke EJ. Dengue viruses and mononuclear phagocytes. I. Infection enhancement by non-neutralizing antibody. J Exp Med 1977 ; 146 : 201- 17.
- Vaughn DW, Green S, Kalayanarooj S, Innis BL, Nimmannitya S, Suntayakorn S, et al. Dengue viremia titer, antibody response pattern, and virus serotype correlate with disease severity. J Infect Dis 2000 ; 181 : 2-9.
- Murgue B, Roche C, Chungue E, Deparis X. Prospective study of the duration and magnitude of viraemia in children hospitalised during the 1996-1997 dengue-2 outbreak in French Polynesia. J Med Virol 2000 ; 60 : 432-8.
- Wang WK, Chao DY, Kao CL, Wu HC, Liu YC, Li CM, et al. High levels of plasma dengue viral load during defervescence in patients with dengue hemorrhagic fever: implications for pathogenesis. Virology 2003 ; 305 : 330-8.
- Guilarde AO, Turchi MD, Siqueira JB Jr., Feres VC, Rocha B, Levi JE, et al. Dengue and dengue hemorrhagic fever among adults: clinical outcomes related to viremia, serotypes, and antibody response. J Infect Dis 2008 ; 197: 817-24.
- Gubler DJ, Suharyono W, Tan R, Abidin M, Sie A. Viraemia in patients with naturally acquired dengue infection. Bull World Health Organ 1981 ; 59 : 623-30.
- Mongkolsapaya J, Dejnirattisai W, Xu XN, Vasanawathana S, Tangthawornchaikul N, Chairunsri A, et al. Original antigenic sin and apoptosis in the pathogenesis of dengue hemorrhagic fever. Nat Med 2003 ; 9 : 921-7.
- Kurane I, Innis BL, Nimmannitya S, Nisalak A, Meager A, Janus J, et al. Activation of T lymphocytes in dengue virus infections. High levels of soluble interleukin 2 receptor, soluble CD4, soluble CD8, interleukin 2, and interferon-gamma in sera of children with dengue. J Clin Invest 1991 ; 88 : 1473-80.
- Green S, Vaughn DW, Kalayanarooj S, Nimmannitya S, Suntayakorn S, Nisalak A, et al. Early immune activation in acute dengue illness is related to development of plasma leakage and disease severity. J Infect Dis 1999 ; 179 : 755-62
- Mangada MM, Endy TP, Nisalak A, Chunsuttiwat S, Vaughn DW, Libraty DH, et al. Dengue-specific T cell responses in peripheral blood mononuclear cells obtai- ned prior to secondary dengue virus infections in Thai schoolchildren. J Infect Dis 2002 ; 185 : 1697-703.
- Mangada MM, Rothman AL. Altered cytokine responses of dengue-specific CD4+ T cells to heterologous serotypes. J Immunol 2005 ; 175 : 2676-83.
- (en) Guzmán MG, Kouri G, Valdés L, Bravo J, Vázquez S, Halstead SB, « Enhanced seve- rity of secondary dengue-2 infections: death rates in 1981 and 1997 Cuban outbreaks », Rev Panam Salud Publica, vol. 11, no 4, , p. 223-7. (PMID 12049030, DOI 10.1590/s1020-49892002000400003)
- (en) Thein S, Aung MM, Shwe TN, Aye M, Zaw A, Aye K et al., « Risk factors in dengue shock syndrome », Am J Trop Med Hyg, vol. 56, no 5, , p. 566-72. (PMID 9180609, DOI 10.4269/ajtmh.1997.56.566)
- (en) Endy TP, Nisalak A, Chunsuttitwat S, Vaughn DW, Green S, Ennis FA et al., « Relationship of preexisting dengue virus (DV) neutralizing antibody levels to viremia and severity of disease in a prospective cohort study of DV infection in Thailand », J Infect Dis, vol. 189, no 6, , p. 990-1000. (PMID 14999601, DOI 10.1086/382280)
- (en) S. B. Halstead, « Observations related to pathogensis of dengue hemorrhagic fever. VI. Hypotheses and discussion », The Yale Journal of Biology and Medicine, vol. 42, , p. 350–62. (ISSN 0044-0086, PMID 5419208, PMCID 2591710, lire en ligne, consulté le )
- (en) P. Marianneau, « The dengue », Virologie, vol. 2, (ISSN 1267-8694, lire en ligne, consulté le )
- (en) Scott B. Halstead, « Dengue Antibody-Dependent Enhancement: Knowns and Unknowns », Microbiology Spectrum, vol. 2, (ISSN 2165-0497, DOI 10.1128/microbiolspec.aid-0022-2014, lire en ligne, consulté le )
- « Philippines : suspension du vaccin contre la dengue de Sanofi », sur lefigaro.fr, (consulté le ).
- Suzanne Willey, Marlén MI Aasa-Chapman, Stephen O'Farrell et Pierre Pellegrino, « Extensive complement-dependent enhancement of HIV-1 by autologous non-neutralising antibodies at early stages of infection », Retrovirology, vol. 8, , p. 16 (ISSN 1742-4690, PMID 21401915, PMCID 3065417, DOI 10.1186/1742-4690-8-16, lire en ligne, consulté le )
- « Antibody-Dependent Enhancement and the Risk of HIV Infection », sur eurekaselect.com (consulté le ).
- (en) Anuj Sharma, « It is too soon to attribute ADE to COVID-19 », Microbes and Infection, (ISSN 1286-4579, PMID 32268188, PMCID PMC7131212, DOI 10.1016/j.micinf.2020.03.005, lire en ligne, consulté le )
- Pierre Sauter et Didier Hober, « Mechanisms and results of the antibody-dependent enhancement of viral infections and role in the pathogenesis of coxsackievirus B-induced diseases », Microbes and Infection / Institut Pasteur, vol. 11, , p. 443–451 (ISSN 1769-714X, PMID 19399964, lire en ligne, consulté le )
- D Hober, F Sane, H Jaïdane et K Riedweg, « Immunology in the clinic review series; focus on type 1 diabetes and viruses: role of antibodies enhancing the infection with Coxsackievirus-B in the pathogenesis of type 1 diabetes », Clinical and Experimental Immunology, vol. 168, , p. 47–51 (ISSN 0009-9104, PMID 22385236, PMCID 3390492, DOI 10.1111/j.1365-2249.2011.04559.x, lire en ligne, consulté le )
- Sheng-Fan Wang, Sung-Pin Tseng, Chia-Hung Yen et Jyh-Yuan Yang, « Antibody-dependent SARS coronavirus infection is mediated by antibodies against spike proteins », Biochemical and Biophysical Research Communications, vol. 451, , p. 208–214 (ISSN 1090-2104, PMID 25073113, DOI 10.1016/j.bbrc.2014.07.090, lire en ligne, consulté le )
- (en) Yiu-Wing Kam, Kwoon-Yong Pok, Kai Er Eng et Li-Kiang Tan, « Sero-Prevalence and Cross-Reactivity of Chikungunya Virus Specific Anti-E2EP3 Antibodies in Arbovirus-Infected Patients », PLoS Neglected Tropical Diseases, vol. 9, no 1, , e3445 (ISSN 1935-2735, PMID 25568956, PMCID PMC4287563, DOI 10.1371/journal.pntd.0003445, lire en ligne, consulté le )
- (en) Dana T. Graves et Rayyan A. Kayal, « Diabetic complications and dysregulated innate immunity », Frontiers in Bioscience, vol. 13, , p. 1227-1239 (lire en ligne, consulté le )
- Massimo Fioranelli, Anna G. Bottaccioli, Francesco Bottaccioli et Maria Bianchi, « Stress and Inflammation in Coronary Artery Disease: A Review Psychoneuroendocrineimmunology-Based », Frontiers in Immunology, vol. 9, , p. 2031 (ISSN 1664-3224, PMID 30237802, PMCID PMC6135895, DOI 10.3389/fimmu.2018.02031, lire en ligne, consulté le )
- (en) Peter J. Hotez et Maria Elena Bottazzi, « Whole Inactivated Virus and Protein-Based COVID-19 Vaccines », Annual Review of Medicine, vol. 73, no 1, , p. 55–64 (ISSN 0066-4219, PMID 34637324, DOI 10.1146/annurev-med-042420-113212, S2CID 238747462, lire en ligne, consulté le )
- Devignot S, Tolou H & Couissinier-Paris P (2010) Le syndrome de choc de dengue : vers un décryptage de la physiopathologie ; Institut de Recherche Biomédicales des Armées, Antenne de Marseille (IMTSSA), Unité de Virologie Tropicale, France ; Revue générale ; Med Trop 70-3 -300
- Deparis X, Maréchal V, Matheus S (2009) Mécanismes physiopathologiques de la dengue : revue critique des hypothèses. Med Trop ; 69 : 351-7
- Libraty DH, Acosta LP, Tallo V, Segubre-Mercado E, Bautista A, Potts JA, et al. A prospective nested case-control study of Dengue in infants: rethinking and refining the antibody-dependent enhancement dengue hemorrhagic fever model. PLoS Med 2009 ; 6 : e1000171.
- Laoprasopwattana K, Libraty DH, Endy TP, Nisalak A, Chunsuttiwat S, Vaughn DW, et al. Dengue Virus (DV) enhancing antibody activity in preillness plasma does not predict subsequent disease severity or viremia in secondary DV infection. J Infect Dis 2005 ; 192 : 510-9.
- Ong A, Sandar M, Chen MI, Sin LY. Fatal dengue hemorrhagic fever in adults during a dengue epidemic in Singapore. Int J Infect Dis 2007 ; 11 : 263-7.
- Harris E, Videa E, Perez L, Sandoval E, Téllez Y, Pérez ML, et al. Clinical, epidemiologic, and virologic features of dengue in the 1998 epidemic in Nicaragua. Am J Trop Med Hyg 2000; 63 : 5-11.


 French
French Deutsch
Deutsch