Manganocène — Wikipédia
| Manganocène | |
 | |
| Identification | |
|---|---|
| Nom UICPA | manganocène |
| Synonymes | bis(cyclopentadiényl)manganèse |
| No CAS | |
| No ECHA | 100.149.777 |
| PubChem | 24199707 |
| SMILES | |
| InChI | |
| Apparence | solide cristallin brun[1] |
| Propriétés chimiques | |
| Formule | C10H10Mn |
| Masse molaire[2] | 185,124 4 ± 0,008 7 g/mol C 64,88 %, H 5,44 %, Mn 29,68 %, |
| Propriétés physiques | |
| T° fusion | 175 °C[3] |
| T° ébullition | 245 °C[3] |
| Point d’éclair | 52 °C[3] |
| Précautions | |
| SGH[3] | |
| H228, H315, H319, H335, P210, P261, P280, P305+P351+P338 et P405 | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
Le manganocène est un composé organométallique du manganèse appartenant à la famille des métallocènes. C'est un solide brun, rose au-dessus de 158 °C, avec des propriétés magnétiques.
Propriétés
[modifier | modifier le code]Le manganèse ayant un électron de moins que le fer, le manganocène possède un électron de valence de moins que le ferrocène, c'est-à-dire 17, violant ainsi la règle des 18 électrons. Cependant, le manganèse possède une configuration d5 spin haut (chaque orbitale d est occupée par un électron), il ne peut que difficilement être réduit à l'état Mn1+ et donc adopter une structure stable à 18 électrons[4].
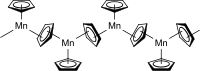
Cette instabilité partielle peut sans doute expliquer pourquoi, à l'état solide, le manganocène existe sous la forme d'un polymère, dans une structure où le manganèse est en fait lié à trois ligands cyclopentadiényle. Deux de ces ligands sont liés à deux centres manganèse à la fois, le troisième étant lié à un unique centre manganèse, formant ainsi une chaîne. La longueur de liaison C-Mn est de 242 pm pour les ligands mono-liés (terminaux) et varie de 240 à 330 pm pour les ligands di-liés (ponts)[5]. Les ligands cyclopentadiényle ponts ne sont ainsi pas répartis de façon symétrique entre les atomes de manganèse[6].
En dessous de sa température de Néel (134 °C)[7], le manganocène est antiferromagnétique. Au-dessus, il possède une fort moment magnétique de 5,81 μB[8]
Synthèse
[modifier | modifier le code]Le manganocène peut être obtenu comme d'autres métallocènes par réaction entre son sel de chlore (chlorure de manganèse(II)) et une source de ligands cyclopentadiényle, en général le cyclopentadiénure de sodium. On fait donc réagir le cyclopentadiène avec le sodium qui est ainsi déprotoné[9]:
La réaction entre le cyclopentadiénure de sodium et le chlorure de manganèse(II) est généralement effectuée dans le THF, le diméthyl glycol ou l'ammoniaque[9] :
- MnCl2 + 2 Na(C5H5) ⟶ Mn(C5H5)2 + 2 NaCl.
Notes et références
[modifier | modifier le code]- Christoph Elschenbroich, Organometallchemie, Teubner, , 6e éd. (ISBN 978-3-8351-0167-8), p. 452
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Bis(cyclopentadienyl)manganese », sur Alfa Aesar (consulté le ).
- (de) Christoph Elschenbroich, Organometallchemie, Teubner, , 6e éd. (ISBN 978-3-8351-0167-8), p. 468
- (de) Christoph Elschenbroich, Organometallchemie, Teubner, , 6e éd. (ISBN 978-3-8351-0167-8), p. 460
- (de) Erwin Riedel, Ralf Alsfasser, Christoph Janiak et Thomas M. Klapötke, Moderne Anorganische Chemie, von Gruyter, , 4e éd. (ISBN 978-3-11-019060-1), p. 707
- (de) Arnold F. Holleman, Nils Wiberg, Lehrbuch der Anorganischen Chemie, de Gruyter, , 102e éd. (ISBN 978-3-11-017770-1), p. 1619
- (de) Christoph Elschenbroich, Organometallchemie, Teubner, , 6e éd. (ISBN 978-3-8351-0167-8), p. 455
- (de) Christoph Elschenbroich, Organometallchemie, Teubner, , 6e éd. (ISBN 978-3-8351-0167-8), p. 451
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Manganocen » (voir la liste des auteurs).


 French
French Deutsch
Deutsch
