Allotropie du phosphore — Wikipédia

Le phosphore élémentaire peut exister sous formes amorphes ou cristallines : il s'agit de formes allotropiques du phosphore. Les plus communes sont le phosphore blanc et le phosphore rouge solides. Il existe également des formes violet et noir, toujours sous forme solide. Le phosphore gazeux existe sous la forme de diphosphore et de phosphore atomique.
Phosphore blanc
[modifier | modifier le code]
Le phosphore blanc, le phosphore jaune ou tétraphosphore (P4) existe en tant que molécules composées de 4 atomes. L'arrangement tétraédrique résulte en une contrainte circulaire qui favorise l'instabilité. La molécule possède 6 liens P-P simples. Il existe deux formes cristallines. La forme α, qui est stable aux conditions normales de pression et de température, est cubique à faces centrées. À 192,5 kelvins, elle se transforme de façon réversible en forme β. Cette dernière aurait une structure cristalline hexagonale[1].
Le phosphore blanc est un solide transparent cireux qui devient rapidement jaune lorsque exposé à la lumière, ce qui explique pourquoi il est aussi appelé phosphore jaune. Il luit de couleur vert dans le noir (lorsqu'en contact avec de l'oxygène), est très inflammable et pyrophorique (auto-allumage) au contact de l'air. Il est toxique (provoquant de sévères lésions au foie si ingéré) et amène la nécrose de la mâchoire si avalé ou inspiré de façon chronique. L'odeur de la combustion de cette forme ressemble à celle de l'ail, et des échantillons sont régulièrement recouverts d'un film de (di)pentoxyde de phosphore blanc de formule chimique P4O10. Le phosphore blanc est peu soluble dans l'eau : il est souvent stocké dans l'eau pour cette raison. Par contre, il est soluble dans le benzène, les huiles, le sulfure de carbone et le chlorure de soufre.
Fabrication et applications
[modifier | modifier le code]La forme allotropique blanche peut être fabriquée à l'aide de différentes méthodes. Dans un procédé, du phosphate de calcium, dérivé de la phosphorite, est chauffé dans une fournaise en présence de carbone et silice[2]. Le phosphore élémental est alors libéré sous la forme de vapeur et peut être recuilli à l'aide d'acide phosphorique.

Le phosphore blanc possède une pression de vapeur élevée à la température de la pièce. Sa densité de vapeur indique que sa vapeur est composée de molécules P4 jusqu'à 800 °C. À températures plus élevées, elles se dissocient pour former du P2.
Il s'enflamme spontanément dans l'air à 50 °C et à des températures plus basses s'il est réduit en poudre. Cette combustion amène la création de pentoxyde de phosphore : P4 + 5 O2 → P4O10.
À cause de cette propriété, le phosphore blanc sert dans les armes.
Non-existence du P8 cubique
[modifier | modifier le code]Bien que le phosphore blanc se transforme en phosphore rouge, thermodynamiquement plus stable, la formation du P8 cubique dans la phase condensée n'a pas encore été observée en 2010. Des dérivés de cette molécule hypothétique ont cependant été préparés à partir de phosphoalcynes[3].
Phosphore rouge
[modifier | modifier le code]

Le phosphore rouge peut être créé en chauffant du phosphore blanc à 250 °C ou en l'exposant à la lumière du Soleil. Le phosphore rouge existe sous la forme d'un réseau amorphe. Si chauffé davantage, le phosphore rouge amorphe cristallise. Il ne s'allume pas spontanément dans l'air aux températures inférieures à 240 °C.
Le phosphore rouge peut se transformer en phosphore blanc si chauffé à 260 °C (comme lorsqu'une allumette est allumée).
Dans la plupart des ex-pays de l'Union soviétique, c'est une substance contrôlée car elle sert à la fabrication des amphétamines.
Phosphore violet de Hittorf
[modifier | modifier le code]


Le phosphore monoclinique ou phosphore violet est aussi connu sous le nom de phosphore métallique de Hittorf[4],[5]. En 1865, Hittorf a chauffé à 530 °C du phosphore rouge dans un tube scellé. La partie haute du tube fut maintenue à 444 °C. Des cristaux monocliniques opaques brillants se sublimèrent. Le phosphore violet peut aussi être préparé en dissolvant du phosphore blanc dans du plomb fondu, le mélange étant inséré dans un tube scellé à 500 °C pendant 18 heures. En laissant refroidir lentement, la forme allotropique de Hittorf cristallise. Les cristaux peuvent être révélés en dissolvant le plomb dans une solution diluée d'acide nitrique puis en faisant bouillir dans une solution concentrée d'acide chlorhydrique[6]. En 1865, Hittorf a découvert que lorsque le phosphore est re-cristallisé à partir de plomb fondu, une forme pourpre/violette est obtenue. Cette forme est parfois appelée phosphore de Hittorf. De plus, il existe une forme fibreuse composée de cages phosphoriques semblables.
Réactions du phosphore violet
[modifier | modifier le code]Le phosphore violet ne s'allume pas dans l'air avant d'atteindre 300 °C et est insoluble dans la plupart des solvants. Il n'est pas attaqué par les alcalis et réagit lentement avec les halogènes. Il peut être oxydé par l'acide nitrique, devenant de l'acide phosphorique.
S'il est chauffé dans une atmosphère de gaz inerte, par exemple d'azote ou du dioxyde de carbone, il se sublime et la vapeur se condense sous la forme de phosphore blanc. Cependant, s'il est chauffé sous vide, et que la vapeur se condense rapidement, du phosphore violet est obtenu. Il semble que le phosphore violet est un polymère d'une masse moléculaire relativement élevée qui, exposé à la chaleur, forme des molécules de P2. En refroidissant, elles devraient normalement former des dimères qui se transforment en P4 (c'est-à-dire du phosphore blanc) mais, dans le vide, elles se combinent pour former un polymère violet.
Phosphore noir
[modifier | modifier le code]
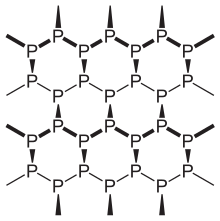
Le phosphore noir est une forme thermodynamiquement stable du phosphore à température et pression normales et est une de ses nombreuses formes allotropiques. Il s'obtient en chauffant du phosphore blanc sous haute pression (12 000 atm). Il est synthétisé par Percy Williams Bridgman en 1914[7].
Il possède plusieurs caractéristiques du graphite : noir, floconneux. Il a une structure en couche et est un semi-conducteur à faible épaisseur avec un écart de bande apparente de 0,3 eV[8]. D'ailleurs, les monocouches de phosphore noir sont appelées phosphorènes.
Pour isoler des couches minces de phosphore noir, la technique la plus courante dans le milieu scientifique est l'exfoliation mécanique. Or, la communauté scientifique tente de développer un procédé de gravure plasma afin d'isoler des monocouches de phosphore noir[9].
Le phosphore noir est un cristal orthorhombique et est le moins réactif des allotropes connus, car il possède plusieurs chaînes circulaires interreliées. Chaque atome est lié à trois autres atomes[10],[11]. En 2007, une synthèse fut réalisée à l'aide d'un catalyseur métallique[12].
L'une des formes cristallines du phosphore rouge/noir est cubique[13].
En 2014, une équipe de scientifiques a découvert que l'on pouvait utiliser ce type de phosphore pour créer des circuits électroniques[14], le but premier des chercheurs étant de trouver un élément presque-identique au graphène, mais naturellement semi-conducteur. On ne sait actuellement pas si l'on peut utiliser ce composé en masse, et à bas coût, cependant les recherches continuent, et quelques tests (créations de transistors, etc.) ont déjà été menés.
Diphosphore
[modifier | modifier le code]
Le diphosphore (P2) ne s'obtient que sous des conditions extrêmes (par exemple, du P4 à 1 100 K. Cependant, quelques avancées ont été effectuées en créant des molécules diatomiques dans des solutions homogènes, à TPN, en ayant recours à des complexes de métaux de transition (basés par exemple sur du tungstène et du niobium)[15].
Le diphosphore est la forme gazeuse du phosphore et sa forme thermodynamiquement stable au-dessus de 1 200 °C et jusqu'à 2 000 °C. La dissociation du tétraphosphore (P4) commence à de plus basses températures : le pourcentage de P2 à 800 °C est ≈1 %. À plus de 2 000 °C, les molécules de diphosphore commencent à se dissocier en phosphore atomique.
Nanotiges de phosphore
[modifier | modifier le code]Des nanotiges de phosphore furent synthétisées sous la forme de polymères P12-[16].
La phase rouge-brun est différente du phosphore rouge et est également stable à l'air sur une durée de plusieurs semaines. Les observations effectuées au microscope électronique ont montré que la forme rouge-brun contient de longues nanotiges parallèles d'un diamètre allant de 0,34 nm à 0,47 nm.
| Forme | Blanc(α) | Blanc(β) | Violet | Noir |
|---|---|---|---|---|
| Symétrie | Cubique centré | Triclinique | Monoclinique | Orthorhombique |
| Notation de Pearson | aP24 | mP84 | oS8 | |
| Groupe d'espace | I43m | P1 No.2 | P2/c No.13 | Cmca No.64 |
| Densité | 1,828 | 1,88 | 2,36 | 2,69 |
| Bande interdite (eV) | 2,1 | 1,5 | 0,34 | |
| Indice de réfraction | 1,8244 | 2,6 | 2,4 |
Notes et références
[modifier | modifier le code]- (en) Marie-Thérèse Averbuch-Pouchot et A. Durif. Topics in Phosphate Chemistry, World Scientific, 1996. (ISBN 9810226349). p. 3.
- Threlfall, R.E., (1951). 100 years of Phosphorus Making: 1851–1951. Oldbury : Albright and Wilson Ltd
- (en) Rainer Streubel, « Phosphaalkyne Cyclooligomers: From Dimers to Hexamers — First Steps on the Way to Phosphorus–Carbon Cage Compounds », Angewandte Chemie International Edition in English, vol. 34, , p. 436 (DOI 10.1002/anie.199504361)
- Lateral Science – Phosphorus Topics
- Monoclinic phosphorus formed from vapor in the presence of an alkali metal (en) Brevet U.S. 4620968
- (en) W. Hittorf, « Zur Kenntniss des Phosphors », Annalen der Physik, vol. 202, no 10, , p. 193–228 (DOI 10.1002/andp.18652021002)
- P. W. Bridgman, « TWO NEW MODIFICATIONS OF PHOSPHORUS. », Journal of the American Chemical Society, vol. 36, no 7, , p. 1344–1363 (ISSN 0002-7863, DOI 10.1021/ja02184a002, lire en ligne, consulté le )
- (en) Vladimir V. Korolkov, Ivan G. Timokhin, Rolf Haubrichs et Emily F. Smith, « Supramolecular networks stabilise and functionalise black phosphorus », Nature Communications, vol. 8, no 1, (ISSN 2041-1723, DOI 10.1038/s41467-017-01797-6, lire en ligne, consulté le )
- Geonyeop Lee, Jong-Young Lee, Gwan-Hyoung Lee et Jihyun Kim, « Tuning the thickness of black phosphorus via ion bombardment-free plasma etching for device performance improvement », Journal of Materials Chemistry C, vol. 4, no 26, , p. 6234–6239 (ISSN 2050-7526 et 2050-7534, DOI 10.1039/c6tc01514j, lire en ligne, consulté le )
- (en) A. Brown et S. Rundqvist, « Refinement of the crystal structure of black phosphorus », Acta Crystallographica, vol. 19, , p. 684 (DOI 10.1107/S0365110X65004140)
- (en) L. Cartz, S. R. Srinivasa, R. J. Riedner, J. D. Jorgensen et T. G. Worlton, « Effect of pressure on bonding in black phosphorus », The Journal of Chemical Physics, vol. 71, , p. 1718 (DOI 10.1063/1.438523)
- (en) Stefan Lange, Peer Schmidt et Tom Nilges, « Au3SnP7@Black Phosphorus: An Easy Access to Black Phosphorus », Inorganic Chemistry, vol. 46, no 10, , p. 4028 (PMID 17439206, DOI 10.1021/ic062192q)
- (en) Rajeev Ahuja, « Calculated high pressure crystal structure transformations for phosphorus », Physica status solidi (b), vol. 235, , p. 282 (DOI 10.1002/pssb.200301569)
- « Ordinateur du futur : le phosphorène mieux que le graphène ? », sur Futura (consulté le ).
- Na Piro, Js Figueroa, Jt Mckellar et Cc Cummins, « Triple-bond reactivity of diphosphorus molecules. », Science, vol. 313, no 5791, , p. 1276–1279 (PMID 16946068, DOI 10.1126/science.1129630)
- A ; Bräu, Mf ; Zweck, J ; Brunklaus, G ; Eckert, H Pfitzner, « Phosphorus nanorods – two allotropic modifications of a long-known element. », Angewandte Chemie (International ed. in English), vol. 43, no 32, , p. 4228–31 (PMID 15307095, DOI 10.1002/anie.200460244)
- (de) A Holleman et N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlin, de Gruyter, , 33e éd., 2033 p. (ISBN 978-3-11-012641-9), « XV 2.1.3 »
- (en) L. I. Berger, Semiconductor materials, Boca Raton, CRC Press, , 496 p. (ISBN 978-0-8493-8912-2, LCCN 96041739, lire en ligne), p. 84
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Allotropes of phosphorus » (voir la liste des auteurs).


 French
French Deutsch
Deutsch