Surfusion — Wikipédia
La surfusion est l'état d’une matière qui demeure en phase liquide alors que sa température est plus basse que son point de solidification. C'est un état dit métastable, c'est-à-dire qu'une petite perturbation peut suffire pour déclencher abruptement le changement vers la phase solide. Un état apparenté, appelé surébullition, existe pour une matière qui demeure en phase liquide alors que sa température est plus élevée que son point d'ébullition.
Principe
[modifier | modifier le code]Approche énergétique
[modifier | modifier le code]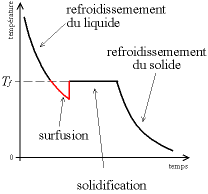
La surfusion est due à l'énergie de tension superficielle à l'interface solide-liquide.
De manière simplifiée, on peut considérer que dans un liquide libre d'impuretés, les petits germes de solide en voie de congélation sont instables car ils sont refondus par l'agitation thermique. Plus rigoureusement, l'énergie libérée par la solidification (chaleur latente de fusion) ne compense pas l'énergie dépensée pour créer l'interface solide-liquide. Le liquide continue donc à se refroidir sans solidifier. Cet état peut être déstabilisé par l'ajout d'impuretés microscopiques (poussière), floculants ou monocristaux (cristaux de glace dans le cas de l'eau), pouvant servir de noyaux de condensation, ou par un brassage qui stimule la formation de cristaux suffisamment gros pour ne pas refondre.
On peut déterminer le rayon minimal pour qu'un cristal soit stable, en fonction de la tension superficielle σ, de la chaleur latente de fusion L et de la masse volumique ρ :
C'est aussi le rayon minimal que doit avoir un noyau de condensation. La tension superficielle σ diminuant avec la température, le rayon minimum diminue lui aussi. La solidification est donc « plus facile » lorsque la température baisse.
Ce phénomène se traduit en physique par une économie d'énergie. En effet, bien que la température soit plus basse que la température critique, le fait de passer de l'état liquide à l'état solide requiert un coût énergétique. Or, du fait de la température et en l'absence de perturbation (pouvant être induite par la présence d'impuretés), le système ne s'effondre pas.
Approche géométrique
[modifier | modifier le code]Selon des travaux récents, ce phénomène serait lié à l'impossibilité de paver l’espace périodiquement avec un type de solide régulier. C'est un problème de géométrie dans lequel une forme est plus appropriée qu'une autre pour entièrement occuper un espace donné (par exemple des triangles ou des hexagones permettent de modéliser plus finement un cercle, à maille égale, que des carrés[1]).
L'hypothèse formulée par certains théoriciens est que les atomes seraient arrangés dans le liquide en suivant un motif pentagonal. Ce dernier ne permettant pas de paver l'espace, il justifierait alors l'impossibilité de cristallisation sans la destruction de ce motif pentagonal : d'où l'existence du phénomène de surfusion[2].
Cette hypothèse s'est vue renforcée en par les travaux de chercheurs de l'ESRF travaillant sur les processus de croissance de nanofils semi-conducteurs et s'apercevant qu’un alliage d’or et de silicium présente aussi ce phénomène de surfusion[3],[4].
Application
[modifier | modifier le code]Le phénomène de surfusion est très lié à la formation de verres qui sont d'une certaine manière des liquides surfondus figés. D'autre part, ce phénomène permet partiellement d'expliquer pourquoi l'eau très froide mise au congélateur est plus lente à geler que l'eau tiède (voir effet Mpemba, du nom d'Erasto Mpemba qui l'a mis en évidence).
Matériaux à changement de phase
[modifier | modifier le code]Avec les matériaux à changement de phase, le phénomène de surfusion est utilisé afin de stocker l'énergie thermique produite par une unité de production de chaleur sous forme latente[5]. Cela permet notamment de limiter les déperditions thermiques dans l'environnement et offre une façon de stocker l'énergie thermique de manière saisonnière[5].
L'exemple le plus fréquent et le plus populaire est celui de la « chaufferette chimique ». Petite poche contenant de l'acétate de sodium trihydraté liquide, espèce relativement stable en surfusion à température ambiante. Sa température de fusion étant aux alentours de 56 °C, déclencher sa solidification à partir de l'état de surfusion et à température ambiante (entre 15 et 25 °C) provoque un « saut » de température (Voir figure plus haut : Solidification présentant une surfusion) qui va donc faire chauffer l'acétate de sodium trihydraté (désormais solide) à 56 °C. D'où l'important dégagement de chaleur ressenti par l'usager ayant utilisé la chaufferette[6].
Le déclenchement de cette solidification se fait, en général, au moyen d'une petite capsule de métal bombée qu'on retourne dans l'autre sens et qui va libérer un grain d'acétate de sodium trihydraté solide, déclenchant ainsi la solidification.
Surfusion de l'eau
[modifier | modifier le code]L'eau peut se présenter sous forme surfondue dans un intervalle de température allant de 0 à −42,55 °C[7]. Une étude de 2011 menée par des chimistes a démontré de manière théorique que la température minimale que l'eau surfondue peut atteindre avant solidification est −48 °C[8]. L'eau surfondue se congèlera dès qu'elle entrera en contact avec une surface solide ou un type particulier d'aérosol appelé « noyau de congélation ».
- Effet stabilisateur des gaz dissous
La présence de gaz dissous (souvent appelés gaz « mélangés ») contribue au maintien de cet état liquide à une température inférieure à la température de fusion. Leur présence crée une agitation moléculaire ayant le même effet que la chaleur. En abaissant lentement la température d'un verre d'eau (par exemple 1/2 degré par jour) on augmente la quantité de gaz mélangés. Arrivé à moins deux degrés, on peut ajouter des impuretés à la surface, l'eau restera liquide, même en continuant à baisser progressivement la température. Si on agite, on libère les gaz mélangés et l'eau gèle instantanément.
L'expérience suivante est très simple à réaliser. Prenez une bouteille neuve (en plastique pour qu'elle n'éclate pas dangereusement) de boisson pétillante et placez-la entre −5 et −8 °C. Après quelques heures, l'échange de chaleur est fait et la boisson reste souvent liquide. Si on ouvre alors la bouteille, du gaz s'échappe et tout le contenu gèle en presque une seconde (la très faible baisse additionnelle de température due à la détente du gaz ne joue pas ici le rôle principal).
En météorologie
[modifier | modifier le code]L'eau surfondue joue un rôle important dans plusieurs phénomènes météorologiques.
- L'eau surfondue n'est pas rare dans les nuages, où les avions qui la rencontrent sont sujets au givrage. Cette accumulation de glace est particulièrement dangereuse car même une mince couche de glace sur des ailes, outre l'augmentation de la masse de l'aéronef, peut diminuer leur portance, entrainant un risque de décrochage. De plus, les verrières peuvent aussi se couvrir de givre. Au sein des nuages, l'eau surfondue joue aussi un rôle primordial dans les processus menant à la formation de précipitations.
- Sur l'océan, par temps très froid et venteux, les embruns peuvent devenir surfondus et geler sur la superstructure des navires. Cette situation peut compromettre leur stabilité et les mettre en danger.
- Lorsque la pluie ou la bruine entrent dans une couche d'air plus froide que le point de congélation, les gouttelettes qui les composent peuvent devenir surfondues ; lorsqu'elles atteignent le sol, leur eau se transforme brutalement en glace, ce qui occasionne du verglas.
Dans la culture populaire
[modifier | modifier le code]Dans son roman Kaputt (1943), l'écrivain italien Curzio Malaparte relate l'anecdote suivante, que l'on présume survenue en 1942 lors du siège de Léningrad, dans le lac Ladoga :
« Le troisième jour un énorme incendie se déclara dans la forêt de Raikkola. Hommes, chevaux et arbres emprisonnés dans le cercle de feu criaient d'une manière affreuse. (...) Fous de terreur, les chevaux de l'artillerie soviétique — il y en avait près de mille — se lancèrent dans la fournaise et échappèrent aux flammes et aux mitrailleuses. Beaucoup périrent dans les flammes, mais la plupart parvinrent à atteindre la rive du lac et se jetèrent dans l'eau. (...)
Le vent du Nord survint pendant la nuit (...) Le froid devint terrible. Soudainement, avec la sonorité particulière du verre se brisant, l'eau gela (...)
Le jour suivant, lorsque les premières patrouilles, les cheveux roussis, atteignirent la rive, un spectacle horrible et surprenant se présenta à eux. Le lac ressemblait à une vaste surface de marbre blanc sur laquelle auraient été déposées les têtes de centaines de chevaux. »
— Curzio Malaparte, Kaputt, 1943
L'astrophysicien et vulgarisateur Hubert Reeves reprend ce récit et le tient pour véridique dans son livre L'Heure de s'enivrer (1986). Il émet l'hypothèse que le gel quasi instantané de l'eau du lac était causé par un changement de phase rapide dû à l'état présumé de surfusion de l'eau au moment de l'incident.
Un autre exemple plus ancien mais purement fictif se trouve dans la littérature :
Hector Servadac, roman de Jules Verne écrit en 1877, décrit un phénomène de surfusion de l'eau et la solidification instantanée d'un bassin de plusieurs milliers de kilomètres carrés. L'eau est en effet refroidie par l'éloignement de la comète Gallia du soleil et absente de tout mouvement macroscopique (pas de vent ni de marée), la congélation est déclenchée par le lancement d'un caillou par Nina, la jeune italienne recueillie par Servadac.
L'idée de la solidification instantanée de toutes les eaux du globe est reprise par Kurt Vonnegut dans son roman Le Berceau du chat.
Notes
[modifier | modifier le code]- Voir l'article Maillage
- ARTIFICA, « Confirmation expérimentale des théories sur la surfusion ou pourquoi l'eau ne gèle pas dans les nuages - Communiqués et dossiers de presse - CNRS », sur www2.cnrs.fr (consulté le )
- (en) T. U. Schülli, R. Daudin, G. Renaud et A. Vaysset, « Substrate-enhanced supercooling in AuSi eutectic droplets », Nature, vol. 464, , p. 1174–1177 (ISSN 0028-0836, DOI 10.1038/nature08986, lire en ligne, consulté le )
- l'énigme de la surfusion en passe d'être résolue, sur futura-sciences.com
- (en) Belén Zalba, José Ma Marín, Luisa F. Cabeza et Harald Mehling, « Review on thermal energy storage with phase change: materials, heat transfer analysis and applications », Applied Thermal Engineering, Elsevier BV, vol. 23, no 3, , p. 251-283 (ISSN 1359-4311, DOI 10.1016/s1359-4311(02)00192-8, lire en ligne).
- Timo van Neerden, « Comment fonctionnent les chaufferettes de poche, ou bouillottes magique ? - Couleur-Science », sur couleur-science.eu (consulté le )
- (en) Physics, « Synopsis: The coldest water », sur APS Physics, (consulté le ).
- (en) ScienceDaily, « Supercool: Water doesn't have to freeze until -48 C (-55 F) », sur ScienceDaily, (consulté le ).
Voir aussi
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]- Brisure spontanée de symétrie
- Chaufferette, une utilisation de la surfusion dans le cas des chaufferettes chimiques
- Eutectique
- Fusion
- Pluie verglaçante
- Précipité
- Surébullition
- Symétrie (physique)
- Verglas


 French
French Deutsch
Deutsch