1,4-Dioxán – Wikipédia
| 1,4-Dioxán | |||
 A dioxán szerkezeti képlete |  1,4-dioxán | ||
| Más nevek | 1,4-dioxaciklohexán p-dioxán [6]-korona-2-dietilén-dioxid dietilén-éter dioxán | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 123-91-1 | ||
| ChemSpider | 29015 | ||
| EINECS-szám | 204-661-8 | ||
| DrugBank | DB03316 | ||
| KEGG | C14440 | ||
| ChEBI | 47032 | ||
| |||
| |||
| InChIKey | RYHBNJHYFVUHQT-UHFFFAOYSA-N | ||
| UNII | J8A3S10O7S | ||
| ChEMBL | 453716 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C4H8O2 | ||
| Moláris tömeg | 88,11 g/mol | ||
| Megjelenés | színtelen folyadék[1] | ||
| Szag | enyhe, éterszerű[1] | ||
| Sűrűség | 1,033 g/ml | ||
| Olvadáspont | 11,8 °C | ||
| Forráspont | 101,1 °C | ||
| Oldhatóság (vízben) | elegyedik | ||
| Mágneses szuszceptibilitás | −52,16·10−6 cm³/mol | ||
| Gőznyomás | 29 Hgmm (20 °C)[1] | ||
| Termokémia | |||
| Std. képződési entalpia ΔfH | −354 kJ/mol | ||
| Égés standard- entalpiája ΔcH | −2363 kJ/mol | ||
| Standard moláris entrópia S | 196,6 J/K·mol | ||
| Veszélyek | |||
| EU osztályozás | gyúlékony (F) Carc. Cat. 3 irritáló (Xn) | ||
| Főbb veszélyek | Carcinogen[1] | ||
| NFPA 704 | |||
| R mondatok | R11, R19, R36/37, R40, R66 | ||
| S mondatok | (S2), S9, S16, S36/37, S46 | ||
| Robbanási határ | 2,0–22%[1] | ||
| PEL | TWA 100 ppm (360 mg/m³) [bőrön][1] | ||
| LD50 | 5,7 g/kg (egér, szájon át) 5,2 g/kg (patkány, szájon át) | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Az 1,4-dioxán az éterek közé tartozó heterociklus szerves vegyület. Színtelen, gyengén édeskés, a dietil-éteréhez hasonló szagú folyadék. Gyakran használt elnevezése a dioxán, mivel a többi (1,2- és 1,3-dioxán) izomerrel csak ritkán lehet találkozni.
Oldószerként számos gyakorlati és laboratóriumi alkalmazása ismert, felhasználják továbbá klórozott szénhidrogének alumíniumtartályokban történő szállításánál stabilizátorként.[3]
Előállítása
[szerkesztés]A dietilén-glikol savkatalizált dehidratálásával állítják elő, melyhez a kiindulási anyagot etilén-oxid hidrolízisével nyerik.
1985-ben a világ dioxántermelő kapacitása 11 000 és 14 000 tonna között volt.[4] 1990-ben az USA által előállított dioxán mennyisége 5250 és 9150 tonna közé esett.[5]
Szerkezete
[szerkesztés]Molekulája középpontosan szimmetrikus, ami azt jelenti, hogy a ciklohexán-származékokra jellemző szék konformációt vesz fel. Ugyanakkor a molekula konformációja flexibilis, és a kád forma is kialakulhat, pl. fémion kelátjaiban. A dioxán kis méretű – csak két etilénoxil-egységet tartalmazó – koronaéterre emlékeztet.
Felhasználása
[szerkesztés]Triklóretán szállítása
[szerkesztés]Az 1980-as években előállított dioxán nagy részét stabilizátorként használták fel az 1,1,1-triklóretán alumíniumtartályokban történő tárolásához és szállításához. Az alumíniumot általában passziváló oxidréteg védi, ám ha ez megsérül, a fémalumínium reakcióba lép a triklóretánnal, alumínium-klorid keletkezik, amely viszont a triklóretán dehidrohalogénezését katalizálja, melynek során vinilidén-klorid és hidrogén-klorid keletkezik. A dioxán – az alumínium-kloriddal adduktot képezve – „megmérgezi” ezt a katalitikus reakciót.[4]
Oldószerként
[szerkesztés]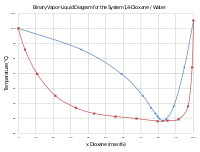
A dioxánnak, mint sokoldalú aprotikus oldószernek különböző felhasználásai ismertek, pl. tinták, ragasztók és cellulóz-észterek esetében.[6] Egyes folyamatokban a tetrahidrofuránt (THF) váltja le, mivel forráspontja magasabb (101 °C, szemben a THF 66 °C-os értékével), és kevésbé mérgező.
Míg a dietil-éter vízben meglehetősen kevéssé oldódik, a dioxán higroszkópos, és a vízzel elegyedik. Standard nyomáson a víz és dioxán 17,9:82,1 tömegarányú elegye pozitív azeotrópot képez, melynek forráspontja 87,6 C.[7]
A gyűrű oxigénatomjai Lewis-bázisok, így a dioxán számos szervetlen vegyületet képes szolvatálni, diéter kelátképző ligandum. A Grignard-reagenssel reagál, a magnézium-dihalogenidet kicsapja, így felhasználható a Schlenk-egyensúly eltolására.[4] Így állítják elő a dimetilmagnéziumot:[8][9]
- 2 CH3MgBr + (C2H4O)2 → MgBr2(C2H4O)2 + (CH3)2Mg
Spektroszkópia
[szerkesztés]Deutérium-oxidban végzett NMR-spektroszkópiai vizsgálatokban belső standardként használják .[10]
Hivatkozások
[szerkesztés]- ↑ a b c d e f g h NIOSH Pocket Guide to Chemical Hazards #0237. National Institute for Occupational Safety and Health (NIOSH)
- ↑ a b '"Dioxane". Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).'
- ↑ Wisconsin Department of Health Services (2013) 1,4-Dioxane Fact Sheet Archiválva 2020. október 16-i dátummal a Wayback Machine-ben. Publication 00514. Accessed on 2016-11-12.
- ↑ a b c (2000) „Dioxane in Ullmann's Encyclopedia of Industrial Chemistry”. DOI:10.1002/14356007.a08_545.
- ↑ 1, 4-Dioxane Fact Sheet: Support Document. OPPT Chemical Fact Sheets. United States Environmental Protection Agency, 1995. február 1. (Hozzáférés: 2010. május 14.)
- ↑ Klaus Weissermel, Hans-Jürgen Arpe (2003) "Industrial Organic Chemistry". John Wiley & Sons, page 158. ISBN 3527305785, 9783527305780.
- ↑ Schneider, C. H.; Lynch, C. C.: The Ternary System: Dioxane-Ethanol-Water in J. Am. Chem. Soc., 1943, vol. 65, pp 1063–1066. doi:10.1021/ja01246a015.
- ↑ (1935) „The Preparation of Dialkylmagnesium Compounds from Grignard Reagents”. Journal of the American Chemical Society 57 (11), 2238. o. DOI:10.1021/ja01314a059.
- ↑ (1962) „Studies of the Grignard Reaction. II. Kinetics of the Reaction of Dimethylmagnesium with Benzophenone and of Methylmagnesium Bromide-Magnesium Bromide with Pinacolone”. The Journal of Organic Chemistry 27 (2), 596. o. DOI:10.1021/jo01049a060.
- ↑ (1994) „Appropriateness of DSS and TSP as internal references for 1H NMR studies of molten globule proteins in aqueous media”. Journal of Biomolecular NMR 4 (6), 859. o. DOI:10.1007/BF00398414.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a(z) 1,4-Dioxane című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Kapcsolódó szócikkek
[szerkesztés]


 French
French Deutsch
Deutsch