Acido formico
| Acido formico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| acido formico (preferito) | |
| Nomi alternativi | |
| acido metanoico (sistematico) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CH2O2 |
| Massa molecolare (u) | 46,03 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 200-579-1 |
| PubChem | 284 e 18971002 |
| DrugBank | DBDB01942 |
| SMILES | C(=O)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,22 |
| Costante di dissociazione acida a 298 K | 1,77 × 10−4 |
| Solubilità in acqua | completamente solubile |
| Temperatura di fusione | 8,4 °C (281,5 K) |
| ΔfusH0 (kJ·mol−1) | 12,7 |
| ΔfusS0 (J·K−1mol−1) | 45,1 |
| Temperatura di ebollizione | 100,8 °C (373,9 K) |
| ΔebH0 (kJ·mol−1) | 22,7 |
| ΔebS0 (J·K−1mol−1) | 119,8 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −425,0 |
| ΔfG0 (kJ·mol−1) | −361,4 |
| S0m(J·K−1mol−1) | 129,0 |
| C0p,m(J·K−1mol−1) | 99,0 |
| Indicazioni di sicurezza | |
| Punto di fiamma | 48 °C (321 K) |
| Limiti di esplosione | 12 - 38% vol. |
| Temperatura di autoignizione | 480 °C (753 K) |
| Simboli di rischio chimico | |
  | |
| pericolo | |
| Frasi H | 226 - 302 - 314 - 331 |
| Consigli P | 210 - 280 - 303+361+353 - 304+340+310 - 305+351+338 - 403+223 [1] |
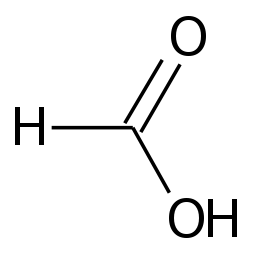
L'acido formico, nome sistematico acido metanoico,[2] è il più semplice degli acidi carbossilici, avente formula chimica H-C(=O)-OH. I suoi sali sono detti "formiati".
È un liquido incolore dall'odore pungente, è corrosivo e, se tenuto a contatto con la pelle, provoca ustioni, distruggendo l'intero spessore del tessuto cutaneo. È un forte agente riducente.
Deve il suo nome alle formiche, nel cui organismo viene sintetizzato e usato come veleno urticante.
Proprietà
[modifica | modifica wikitesto]L'acido formico è un liquido incolore con un odore pungente e penetrante[3] a temperatura ambiente. È miscibile in glicerolo, acetato di etile, metanolo e acqua; è molto solubile in acetone. Negli idrocarburi e nella fase vapore è costituito da dimeri legati tra loro attraverso legami a idrogeno piuttosto che da singole molecole.[4][5] Per questa ragione, l'acido formico gassoso non obbedisce alla legge dei gas ideali.[5] L'acido formico solido, che può esistere in uno dei due polimorfi, è costituito da una rete virtualmente infinita di molecole di acido formico. L'acido formico liquido tende a sopraffondere.
Produzione
[modifica | modifica wikitesto]Viene ottenuto per la prima volta nel 1670 dalla distillazione distruttiva di formiche.
L'acido formico è prodotto facendo prima reagire a 80 °C e ad una pressione di 40 atm in fase liquida il metanolo con monossido di carbonio:
Si forma il formiato di metile, un derivato, che viene successivamente idrolizzato:
Dato che per l'idrolisi è necessaria una grande quantità di acqua, si preferisce fare reagire prima il formiato con ammoniaca per formare la formammide:
Poi la formammide viene idrolizzata con acqua ed acido solforico:
Un altro metodo è quello di fare reagire l'ossido di carbonio con idrossido di sodio per formare il sodio formiato
Quest'ultimo viene fatto poi reagire con acido solforico per produrre l'acido formico:
In biochimica il formiato viene prodotto dall'ossalato in ambiente acido grazie all'azione dell'enzima ossalato decarbossilasi. Dalla reazione si produce anche anidride carbonica.
Usi
[modifica | modifica wikitesto]L'uso principale dell'acido formico è come agente conservante e antibatterico nei mangimi per animali d'allevamento. Vaporizzato sul fieno o su altri foraggi, ne arresta alcuni processi di fermentazione. Nell'industria avicola viene a volte addizionato al mangime per eliminare i batteri della salmonella.
Tra gli additivi alimentari è identificato dalla sigla E 236.
In apicoltura viene usato nella lotta contro la Varroa destructor. La difficoltà e la pericolosità di somministrazione ne limitano l'utilizzo.
Alcuni uccelli, tra cui il corvo e la ghiandaia, provocano pesantemente le formiche, che nel tentativo di respingere il molestatore gli spruzzano contro l'acido formico. Questa pratica è nota col nome di anting o bagno di formiche. L'uccello si serve dell'acido per liberarsi dei parassiti.[6][7]
I formiati, sali derivati dell'acido formico, vengono impiegati nell'industria tessile, della carta, della gomma, della plastica e nella concia dei pellami. Alcuni suoi esteri trovano uso come aromi artificiali e come profumi.
Note
[modifica | modifica wikitesto]- ^ scheda dell'acido formico su IFA-GESTIS (archiviato dall'url originale il 16 ottobre 2019).
- ^ (EN) Henri A. Favre e Warren H. Powell, Nomenclature of Organic Chemistry, 5 dicembre 2013, DOI:10.1039/9781849733069. URL consultato il 24 aprile 2023.
- ^ OSHA Occupational Chemical Database - Occupational Safety and Health Administration, su osha.gov. URL consultato il 2 gennaio 2020 (archiviato dall'url originale il 29 aprile 2021).
- ^ Werner Reutemann e Heinz Kieczka, Formic Acid, in Ullmann's Encyclopedia of Industrial Chemistry, 2000, DOI:10.1002/14356007.a12_013, ISBN 978-3-527-30673-2.
- ^ a b Roman M. Balabin, Polar (Acyclic) Isomer of Formic Acid Dimer: Gas-Phase Raman Spectroscopy Study and Thermodynamic Parameters, in The Journal of Physical Chemistry A, vol. 113, n. 17, 2009, pp. 4910–8, Bibcode:2009JPCA..113.4910B, DOI:10.1021/jp9002643, PMID 19344174.
- ^ Ecospirituality Foundation, su eco-spirituality.org. URL consultato il 26 settembre 2007 (archiviato dall'url originale il 21 giugno 2007).
- ^ I boschi di Buccheri, su isaporidisicilia.com. URL consultato il 29 marzo 2012.
Bibliografia
[modifica | modifica wikitesto]- (EN) Klaus Weissermel, Hans-Jürgen Arpe, Charlet R. Lindley, Industrial organic chemistry, 4ª ed., Wiley-VCH, 2003, pp. 42-46, ISBN 3-527-30578-5.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su acido formico
Wikimedia Commons contiene immagini o altri file su acido formico
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) William H. Brown, formic acid, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 32773 · LCCN (EN) sh85050819 · GND (DE) 4261520-3 · BNF (FR) cb122285920 (data) · J9U (EN, HE) 987007545719505171 |
|---|


 French
French Deutsch
Deutsch





