Biofilm

Un biofilm o biopellicola o microfouling è una aggregazione complessa di microrganismi contraddistinta dalla secrezione di una matrice adesiva e protettiva, e spesso anche da:
- adesione a una superficie, sia di tipo biologico sia inerte (ad esempio rocce e protesi),
- eterogeneità strutturale,
- interazioni biologiche complesse,
- una matrice extracellulare di sostanze polimeriche, spesso di carattere polisaccaridico.
Gli organismi unicellulari solitamente mostrano due distinte modalità di comportamento. La prima è la familiare forma fluttuante, o planctonica, nella quale le cellule separate fluttuano o nuotano indipendentemente in un supporto liquido. La seconda è lo stato aggregato, o sessile, in cui le cellule sono strettamente vincolate e fermamente attaccate l'una all'altra e anche, di solito, a una superficie solida. La modifica del comportamento è attivata da un meccanismo di comunicazione chimica che differisce tra le specie. Alcune specie, ad esempio, possono produrre acil-omoseril-lattoni come segnale di "quiescenza", che induce le cellule planctoniche circostanti al cambiamento fenotipico verso lo stato sessile, attraverso una differente espressione dei geni della cellula.
Secondo il CDC (Centers for Disease Control and Prevention) di Atlanta, fino all'80% delle infezioni batteriche che colpiscono persone nei paesi occidentali sono causate da biofilm polimicrobici. Pertanto, le infezioni uroginecologiche ricorrenti non dovrebbero più essere considerate come infezioni supportate da un singolo ceppo patogeno, ma come sindromi polimicrobiche caratterizzate da un significativo aumento del carico batterico aerobico, anaerobico e fungino, con un possibile ceppo patogeno dominante.[1]
Formazione
[modifica | modifica wikitesto]La formazione di un biofilm inizia con l'ancoraggio di microrganismi liberamente fluttuanti a una superficie. I primi "coloni" aderiscono alla superficie inizialmente attraverso deboli e reversibili forze di Van der Waals.
Se i batteri colonizzatori non sono immediatamente separati dalla superficie, possono ancorarsi più stabilmente utilizzando molecole di adesione cellulare, come i pili.
I primi colonizzatori facilitano l'arrivo di altre cellule mettendo a disposizione diversi siti di adesione cellulare e iniziano a costruire la matrice che permette l'integrità del biofilm. Alcune specie non sono in grado di attaccarsi autonomamente a una superficie, ma spesso riescono ad ancorarsi alla matrice o ai colonizzatori precedenti. Una volta che la colonizzazione ha avuto inizio il biofilm cresce tramite divisioni cellulari e integrazione di batteri esterni, anche di altre specie.
Sviluppo
[modifica | modifica wikitesto]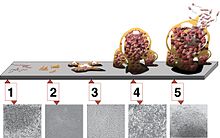
Si distinguono cinque fasi nello sviluppo di un biofilm:
- attecchimento iniziale
- attecchimento irreversibile (irreversible attachment)
- maturazione I
- maturazione II
- dispersione
Proprietà
[modifica | modifica wikitesto]I biofilm sono usualmente trovati su substrati solidi sommersi o esposti ad alcune soluzioni acquose, sebbene possano anche formarsi come tappeti o masse galleggianti su superfici liquide. Se è rifornito di risorse sufficienti per la crescita un biofilm crescerà fino a diventare macroscopico in poco tempo. I biofilm di solito consistono di molte specie di batteri e archaea. Un biofilm contenente differenti specie prende solitamente il nome di consorzio batterico, ed è quantitativamente più frequente di biofilm composti da singole specie, più rari e possibili solo a determinate condizioni. Ogni specie presente nel consorzio svolge differenti funzioni metaboliche e presenta solitamente diverso trofismo, richieste di ossigeno o nicchia ecologica. In questo modo il consorzio è più efficiente senza che le diverse specie entrino in conflitto tra loro
Il biofilm è tenuto insieme e protetto da una matrice di composti polimerici escreti. Questa matrice è tanto forte che, a certe condizioni, i biofilm possono fossilizzarsi. La matrice protegge le cellule all'interno e facilita la comunicazione tramite segnali chimici o fisici. In alcuni biofilm sono stati rinvenuti canali d'acqua che contribuiscono a distribuire i nutrienti e le molecole segnale. Allo stesso modo, questi canalicoli convogliano verso la periferia sostanze di scarto ed eventuali esotossine.
I batteri che vivono su un biofilm solitamente hanno proprietà significativamente differenti dai batteri delle stesse specie che vagano liberamente, poiché l'ambiente denso e protetto del film permette loro di cooperare e interagire in varie maniere. Un beneficio di questo ambiente è l'aumentata resistenza a detergenti e antibiotici, dato che la densa matrice extracellulare e lo strato esterno delle cellule protegge la parte interna della comunità. In alcuni casi la resistenza agli antibiotici può aumentare di 1000 volte.
Localizzazione
[modifica | modifica wikitesto]I biofilm sono ubiquitari. Quasi ogni specie di batterio o archaea possiede meccanismi attraverso i quali possono aderire a superfici e l'uno con l'altro. I biofilm si possono trovare su rocce e sulla ghiaia al fondo di ogni corso d'acqua e spesso si formano sulla superficie di acque stagnanti. Possono crescere sia nei laghi caldi e acidici dello Yellowstone sia sui ghiacciai in Antartide.
Generalmente i biofilm formati da colonie eterogenee sono più spessi e più stabili di quelli monospecie. Dopo qualche tempo i batteri adesi al biofilm sono in grado di staccarsi, venendo a costituire una massa indipendente che periodicamente si sfoglia e, con la finalità di sopravvivere e di colonizzare altre nicchie, può dare origine alla formazione di un nuovo biofilm in un altro posto. Questo fenomeno può essere favorito dalle forze di scorrimento del fluido, dalla presenza di determinati composti o dalle caratteristiche delle singole specie batteriche.
I biofilm permettono la sopravvivenza delle cellule batteriche in un ambiente ostile. Infatti le cellule planktoniche sono più esposte a svariati fattori deleteri come batteriofagi o protozoi in natura, agenti biocidi nei dispositivi industriali, agenti antimicrobici in situazioni cliniche e dall'azione di anticorpi e fagociti. Inoltre la complessità della loro struttura e l'eterogeneità metabolica e fisiologica, suggeriscono un'analogia fra queste comunità e i tessuti di organismi superiori. Nonostante la formazione di biofilm sia stato un aspetto ampiamente documentato della fisiologia batterica da oltre 100 anni, solo ora si sta iniziando a comprendere questo processo a livello molecolare. Infatti solo 2 decenni fa, la riscoperta che nei sistemi acquatici i batteri sono adesi a diverse superfici ha fatto concentrare gli sforzi sullo studio dei biofilm. Negli scorsi anni sono stati ideati sistemi di screening semplici per l'isolamento di mutanti difettivi nella formazione di biofilm, creando strumenti per l'analisi genetica di questa complessa struttura.
Il biofilm può comprendere una singola specie microbica o più specie, e può formarsi su un ampio range di superfici abiotiche o biotiche. Nonostante i biofilm misti predominino in molti ambienti, quelli composti da una singola specie hanno un forte interesse medico, in quanto causa di una grande varietà di infezioni, dal momento che possono formarsi sulla superficie di impianti medici. Pseudomonas aeruginosa è stata la specie più studiata tra i batteri gram negativi che formano biofilm singoli, ma anche altri microrganismi quali ad esempio P.fluorescens, E.coli e Vibrio cholerae sono stati largamente studiati. Mentre tra i gram positivi più analizzati troviamo Staphylococcus epidermidis, S. aureus e gli enterococchi. Inoltre, è noto che anche Legionella pneumophila può albergare nel biofilm nelle reti di distribuzione dell'acqua potabile, anche protetta all'interno di amebe, e rappresentare quindi un rischio per la salute dei consumatori (http://www.iss.it/binary/publ/cont/08-19_web.1219825010.pdf Archiviato il 23 dicembre 2015 in Internet Archive.). I biofilm sono composti principalmente da cellule microbiche e matrice extracellulare (EPS). La percentuale di EPS si aggira tra il 50% e il 90% ed è considerata la materia prima del biofilm. Le proprietà chimico-fisiche di questa matrice possono variare molto, ma è principalmente composta da polisaccaridi. L'EPS può essere altamente idratato poiché può incorporare grandi quantità di acqua nella sua struttura tramite legami idrogeno, ma in alcuni casi l'EPS può anche essere idrofobico. La composizione e la struttura dei polisaccaridi determina la conformazione primaria della matrice. In alcuni batteri infatti, lo scheletro della struttura può contenere residui di esosi legati tra loro con legami β-1,3 o β-1,4, che conferiscono maggiore rigidità, minore deformabilità e in alcuni casi possono influenzare la solubilità. La composizione dell'EPS non è generalmente uniforme ma può variare spazialmente e temporalmente, infatti la quantità di EPS cresce con l'età del biofilm. Inoltre questa matrice può associare con ioni metallici, cationi divalenti a altre macromolecole, come proteine, DNA, lipidi e anche acidi umici. A causa della sua elevata idratazione la matrice previene l'essiccamento di alcuni biofilm naturali. Inoltre può contribuire alla resistenza agli antibiotici (un gruppo di bioingegneri ha infatti scoperto che i batteri all'interno del biofilm possono essere eliminati da antibiotici convenzionali se la struttura di queste comunità sessili viene perturbata da ultrasuoni o da campi elettrici a corrente continua) impedendo il trasporto di massa e la diffusione di queste sostanze attraverso il biofilm, probabilmente legando queste molecole direttamente. Alcuni studi hanno mostrato che la stabilità della struttura del biofilm è legata alla presenza di zuccheri neutri, polisaccaridi acidi e aminozuccheri.
Ruolo in medicina
[modifica | modifica wikitesto]Batteri e funghi formano biofilm a determinate condizioni. Quando un gruppo di batteri o funghi si accumulano su di una superficie e raggiungono una particolare densità cellulare, iniziano a secernere una sostanza polimerica che si compone di polisaccaridi, proteine e DNA, formando una matrice in cui le cellule batteriche o fungine sono fortemente radicate.
Aggregati cellulari
[modifica | modifica wikitesto]Gli aggregati multi-cellulari o biofilm permettono alle singole cellule batteriche o fungine o le colonie di batteri o funghi di esibire un comportamento coordinato e conferendo loro vantaggi biologici come la resistenza ad antibiotici e nei confronti del sistema immunitario dell'ospite. I biofilm sono strutturati per consentire la respirazione e lo scambio di liquidi e sostanze nutritive, mentre impediscono l'accesso alle cellule immunitarie dell'ospite come i fagociti; inoltre, riducono le concentrazioni di fattori inibitori o litici di tipo antimicrobico impedendo a questi di raggiungere i microrganismi. Il risultato di queste proprietà è che le infezioni, che sono la conseguenza risultato dalla formazione di biofilm, sono notoriamente difficili da eradicare e queste infezioni richiedono l'uso di alte concentrazioni di agenti antimicrobici, la rimozione dei tessuti colpiti, o la combinazione di questi trattamenti.
Formazione del quorum sensing
[modifica | modifica wikitesto]La formazione di biofilm sembra essere disciplinato dalla secrezione di molecole particolari, secondo un processo denominato quorum sensing. Il quorum sensing è un processo di comunicazione tra cellule batteriche. Esso è un processo auto indotto che fa sì che quando le molecole cominciano ad accumularsi nella zona circostante i microrganismi, i microrganismi si sottopongono a una serie di cambiamenti fisiologici che consentono la formazione del biofilm extracellulare. Ad esempio, a seguito del quorum sensing autoindotto, i microorganismi possono iniziare la produzione superficiale di polimeri extracellulari adesivi, la produzione biosurfattante, la sporulazione, la bioluminescenza e la secrezione di sostanze nutritive; con sequestramento di molecole e fattori di virulenza come conseguenza del processo di formazione del biofilm. Per questi motivi talvolta batteri presenti in un biofilm possono essere fino a 4.000 volte più resistenti agli antibiotici rispetto allo stesso organismo, in un ambiente allo stato libero[2][3].
Resistenza agli antibiotici
[modifica | modifica wikitesto]Il confronto tra la concentrazione minima inibente (MIC), che descrive la quantità di antimicrobico necessaria per inibire i microrganismi liberi capaci di formare biofilm, e la minima concentrazione di eradicazione del biofilm (MBEC), che descrive la concentrazione minima di un agente antimicrobico capace di inibire la crescita di un biofilm (necessaria per inibire o eliminare la crescita di biofilm), mostrano le differenze esistenti nella suscettibilità dei batteri liberi rispetto a quelli che formano biofilm. Spiegando perché i batteri che formano biofilm sono molto meno sensibili agli agenti antimicrobici ai comuni schemi terapeutici[4].
Inoltre, utilizzando una concentrazione di antibiotici in dose pari alla MIC, se l'infezione presenta un biofilm si può avere un'esposizione del biofilm a dosi sub-letali di antibiotici, provocando così una più alta incidenza di resistenze microbiche, con gravi conseguenze per l'ospite.
Casi specifici
[modifica | modifica wikitesto]La produzione di biofilm ha evidenti specifiche implicazioni in medicina; in particolare:
- La placca dentale è un biofilm, prodotto dai batteri presenti nel cavo orale come Streptococcus mutans.
- Biofilm possono crescere sulla superficie di impianti solidi (p. e.: protesi) nel corpo. Biofilm che si propagano lungo tubi o fili impiantati possono generare perniciose infezioni nei pazienti. Lo Staphylococcus epidermidis può produrre ad esempio biofilm sui cateteri venosi.
- Pseudomonas aeruginosa e Staphylococcus aureus possono produrre biofilm sull'epitelio respiratorio dei polmoni, complicando il decorso dei pazienti affetti da fibrosi cistica. Le cellule del sistema immunitario (come i macrofagi) non sono infatti in grado di contrastare la presenza di biofilm, ma solo di generare una infiammazione cronica. La terapia si basa infatti su farmaci anti-infiammatori (come alcuni FANS) e molecole disgreganti.
- Nella faringite si ritrovano biofilm prodotti da streptococchi di gruppo A che sono causa di fallimento della terapia antibiotica[5].
- Biofilm possono crescere anche su lenti intraoculari (es. cristallini artificiali) non sterilizzate[6][7].
- Il biofilm si produce anche in corso di infezioni della vagina da G. vaginalis e A. vaginae: vaginosi; e anche in seguito all'impianto di spirale uterina (IUD). Questo biofilm rende ragione del fatto che le vaginosi spesso recidivano per la difficoltà degli antibiotici di eradicare i germi che si proteggono con il biofilm[8][9].
- Sono comunissime le infezioni del tratto urinario dovute a batteri produttori di biofilm[10][11]
Uroginecologia
[modifica | modifica wikitesto]Ad esempio, Escherichia coli, spesso presente con infezioni uro-ginecologiche, forma un biofilm in vescica, o in vagina. Tale biofilm può comprendere una riserva intracellulare dormiente microrganismo che costituiscono circa 1% delle cellule batteriche, sono completamente resistenti agli antibiotici e alla risposta immunitaria del organismo, caratteristica fondamentale responsabile del fallimento della terapia antibiotica per i pazienti con infezioni ricorrenti. Una volta che la terapia antibiotica o antimicotica è completata, le cellule persistenti rapidamente riattivate ripristinano la carica batterica o fungina preesistente, causando infezioni ricorrenti. [12]
Il trattamento antibiotico può essere risolutivo sui batteri in fase planctonica, responsabili delle riacutizzazioni infettive rilasciate dal biofilm, ma non è in grado di eliminare la comunità batterica sessile contenuta nello stesso.
Il biofilm da Escherichia coli, presente contemporaneamente a livello vescicale e vaginale contiene persister cells, completamente resistenti agli antibiotici e al sistema immunitario rendendo tali infezioni croniche e ricorrenti. La progressione, verso la cronicizzazione è più rapida e gli episodi di cistite più ravvicinati se il biofilm vaginale non viene trattato.[13]
Il biofilm si può formare sulle superfici inerti, come dispositivi endouterini, anelli contraccettivi, impianti contraccettivi, pessari.[14][15][16]
Urologia
[modifica | modifica wikitesto]Se i microrganismi patogeni creano un biofilm nella vescica, possono causare cistite cronica con episodi acuti ogni volta che il biofilm viene aperto.[17] La terapia con antibiotici in questo caso è inefficace.[18] I biofilm patogeni tipici della vescica sono caratterizzati da ceppi uropatogeni di Escherichia coli (UPEC Uropatogenic escherichia coli) responsabili del 75%-85% delle cistiti ricorrenti e del biofilm intracellulare.[19] All'interno delle cellule dell'urotelio, i batteri organizzano biofilm immersi in una matrice di polisaccaridi saturi circondati da un guscio protettivo di uroplachina in prossimità della superficie, dove creano rigonfiamenti simili a baccelli.[20]
Eliminazione del biofilm
[modifica | modifica wikitesto]I risultati di recenti esperimenti hanno confermato, oltre all'effetto antiossidante, l'efficacia della N-acetilcisteina (NAC) nella distruzione dei biofilm e una diminuzione del numero di forme viventi di batteri presenti in esse. N-acetilcisteina (NAC) impedisce la formazione di biofilm da parte di agenti patogeni. N-acetilcisteina (NAC) ha un effetto devastante sui biofilm patogeni, agendo direttamente sulla matrice polisaccaridica.[21]
Profilassi e eliminazione dei biofilm patogeni
[modifica | modifica wikitesto]Gli ingredienti attivi, efficaci nella prevenzione e nel controllo dei biofilm, non contengono antibiotici: D-mannosio, n-acetilcisteina (NAC), probiotici, lattoferrina, morinda citrifolia.
È stato dimostrato che l'n-acetilcisteina può distruggere il biofilm, rendere disponibili i batteri per il d-mannosio o gli antibiotici.[22]
Biofilm su pavimenti e superfici di lavoro possono rendere difficile l'igiene degli alimenti nelle aree adibite alla preparazione di cibo.
Applicazioni
[modifica | modifica wikitesto]I biofilm possono essere impiegati per fini utili. Ad esempio in molti depuratori di acque provenienti da fognature viene incluso uno stadio di trattamento in cui l'acqua viene fatta passare attraverso biofilm cresciuti su filtri, che estraggono e metabolizzano molti composti organici nocivi.
Nell'industria alimentare il biofilm causa, in genere, notevoli problemi di ordine tecnologico impedendo o rallentando il flusso di calore, aumentando la resistenza di un fluido allo scorrimento, favorendo la corrosione e determinando anche perdite di prodotto. Inoltre, dal punto di vista igienico-sanitario esso riduce sensibilmente l'efficacia di un disinfettante convenzionale che riesce a penetrare solo parzialmente nel fitto strato di polimeri per giungere a contatto con le cellule batteriche. Va tenuto presente, inoltre, che tali cellule non presentano solamente caratteristiche alterative, ma sono dotate spesso di elevate potenzialità patogene: non di rado viene segnalata la presenza nei biofilm di Listeria monocytogenes, Yersinia enterocolitica, Campylobacter jejuni ed Escherichia coli.
Ruolo nell'ecologia acquatica
[modifica | modifica wikitesto]Organismi presenti
[modifica | modifica wikitesto]La base della catena trofica è composta dai batteri, che sono anche responsabili della formazione della matrice gelatinosa che forma la base del film (glicocalice, definito in questo contesto come EPS, Sostanze Polimeriche Extracellulari), questi batteri alimentano ricche faune di protozoi, sono anche presenti funghi saprofiti e diatomee fotosintetiche[23].
Ruolo ecologico
[modifica | modifica wikitesto]Questo “tappeto” organico contiene un gran numero di organismi, organizzati con una struttura di comunità simile a quella degli ecosistemi a scala maggiore e riveste un importante ruolo nella successiva colonizzazione del substrato da parte di organismi sessili più grandi[23].
Note
[modifica | modifica wikitesto]- ^ Verstraelen H, Swidinski A., The biofilm in bacterial vaginosis: implications for epedemiology, diagnosis and treatment., in Current Opinion in Infectious Diseases, № 26/ 2013 p. 86-89..
- ^ Karatan E, Watnick P, Signals, regulatory networks, and materials that build and break bacterial biofilms, in Microbiology and Molecular Biology Reviews : MMBR, vol. 73, n. 2, giugno 2009, pp. 310–47, DOI:10.1128/MMBR.00041-08, PMC 2698413, PMID 19487730. URL consultato il 2 marzo 2010.
- ^ Hoffman LR, D'Argenio DA, MacCoss MJ, Zhang Z, Jones RA, Miller SI, Aminoglycoside antibiotics induce bacterial biofilm formation, in Nature, vol. 436, n. 7054, agosto 2005, pp. 1171–5, DOI:10.1038/nature03912, PMID 16121184. URL consultato il 2 marzo 2010.
- ^ Høiby N, Bjarnsholt T, Givskov M, Molin S, Ciofu O. Antibiotic resistance of bacterial biofilms. Int J Antimicrob Agents. 2010 Apr; 35(4): 322-32. Epub 2010 Feb 10. Review. PMID 20149602.
- ^ Conley J, Olson ME, Cook LS, Ceri H, Phan V, Davies HD. Biofilm formation by group a streptococci: is there a relationship with treatment failure? J Clin Microbiol. 2003 Sep; 41(9): 4043-8. PMID 12958223.
- ^ Kadry AA, Fouda SI, Shibl AM, Abu El-Asrar AA. Impact of slime dispersants and anti-adhesives on in vitro biofilm formation of Staphylococcus epidermidis on intraocular lenses and on antibiotic activities. J Antimicrob Chemother. 2009 Mar; 63(3): 480-4. Epub 2009 Jan 14. PMID 19147522.
- ^ Casaroli-Marano RP, Adán A. [Eye infections associated with ocular implants]. Enferm Infecc Microbiol Clin. 2008 Nov;26(9):581-8. Review. Spanish. PMID 19100179.
- ^ Durán EL, Mujica MT, Jewtuchowicz VM, Finquelievich JL, Pinoni MV, Iovannitti CA. [Examination of the genetic variability among biofilm-forming Candida albicans clinical isolates]. Rev Iberoam Micol. 2007 Dec 31;24(4):268-71. Spanish. PMID 18095758.
- ^ Patterson JL, Girerd PH, Karjane NW, Jefferson KK. Effect of biofilm phenotype on resistance of Gardnerella vaginalis to hydrogen peroxide and lactic acid. Am J Obstet Gynecol. 2007 Aug;197(2):170.e1-7. PMID 17689638.
- ^ Andreu A. [Pathogenesis of urinary tract infections]. Enferm Infecc Microbiol Clin. 2005 Dec;23 Suppl 4:15-21. Review. Spanish. PMID 16854354.
- ^ Frank DN, Wilson SS, St Amand AL, Pace NR. Culture-independent microbiological analysis of foley urinary catheter biofilms. PLoS One. 2009 Nov 12;4(11):e7811. PMID 19907661.
- ^ Lewis K, Persister cells, in Annual Review of Microbiology, 2010/ 64 p.357-372.
- ^ Graziottin A, Zanello PP, D’Errico G, Cistiti e vaginiti recidivanti: ruolo dei biofilm e delle persister cells. Dalla Fisipatologia a nuove strategie terapeutiche., in Minerva Ginecologica, Ottobre, volume 66, 5 (p.497- 512).
- ^ Dondes GG, Vereecken A, Bosmans E, Dekeers-maeker A, Salembier G, Spitz, Definition of a type of abnormal vaginal flora that is distinct from bacterial vaginosis: aerobic vaginits., in BJOG., n. 2002.
- ^ Falagas ME, Velakoulis S, Iavazzo C, Athanasiou S, Mesh-related infections after pelvic organ prolapse repair surgery., in European Journal of Obstetrics & Gynecology and Reproductive Biology, 2007. — № 134. — p.147-156..
- ^ Tenke P Köves B, Nagy K, Hultgren SJ, Mendling W, WulltB et al, Update on biofilm infections in the urinary tract, in World Journal of Urology, 2012. — № 30. — p 51-57..
- ^ Lewis K, Persister cells, in Annual Review of Microbiology., № 64.
- ^ Naves P, Del Prado G, Huelves L,Rodriguez-Cerrato V, Ruiz V, Ponte MC, Effects of human sierum albumium, ibuprofen and N-acetil-L-cysteine against biofilm formation by pathogenic Escheriachia Coli strains, in Journal of Hospital Infection, 2010. — № 76 p.165-170.
- ^ Berry RE, Klumpp DJ, Schaeffer AJ, Urotelial cultures support intracellular bacterial community formation by uropathogenic E.coli, in Infection and Immunity, 2009. — № 77. — p. 2762-2772..
- ^ Anderson GG, Palermo JJ., Intracellular bacterial biofilm –like pods in urinary tract infections, in Science, 2003. — № 301. — p. 105 -107..
- ^ Marchiori D, Zanello P.P, Efficacy of N-acetylcysteine, D-mannose and Morinda citrifolia to Treat Recurrent Cystitis in Breast Cancer Survivals, in In Vivo, 2017. — Sep-Oct (№ 31). — p. 931-936..
- ^ Marchese A, Bozzolasco M, Gualco L, Debbia EA, Schito GC, Schito AM, Effect of fosfomycin alone and in combination with n-acetylcystein on E.coli biofilms, in International Journal of Antimicrobial Agents, 2003. — Т. 22. — p. 95-100..
- ^ a b AA.VV. Manuale di metodologie di campionamento e studio del benthos marino mediterraneo, Società Italiana di Biologia Marina, Livorno 2003 - Supplemento a Biologia Marina Mediterranea n° 10
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su biofilm
Wikimedia Commons contiene immagini o altri file su biofilm
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) biofilm, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Bacterial Biofilms (Microbial Mats), su equisetites.de.
| Controllo di autorità | Thesaurus BNCF 52772 · LCCN (EN) sh89001286 · BNF (FR) cb122662826 (data) · J9U (EN, HE) 987007539351505171 · NDL (EN, JA) 01168854 |
|---|


 French
French Deutsch
Deutsch