Tensione superficiale

In fisica la tensione superficiale di un fluido è la tensione meccanica di coesione delle particelle sulla sua superficie esterna. Essa corrisponde microscopicamente alla densità superficiale di energia di legame sull'interfaccia tra un corpo continuo e un materiale di un'altra natura, ad esempio un solido, un liquido o un gas: non è quindi assimilabile dimensionalmente ad uno sforzo interno e per questo nel Sistema internazionale si misura in newton su metro (N/m).
Dal punto di vista termodinamico può essere definita come il lavoro necessario per aumentare la superficie del continuo di una quantità unitaria.[1] Il paracoro è una grandezza che esprime il volume molare dei liquidi corretto considerando l'effetto della tensione superficiale.
Definizione meccanica
[modifica | modifica wikitesto]A livello microscopico i liquidi sono composti di molecole tra cui si esplicano forze, principalmente di tipo elettrico, che dipendono fortemente dalla distanza intermolecolare : quando quest'ultima è inferiore di un certo valore caratteristico () del tipo di sostanza, la forza tra due molecole diventa repulsiva. In generale, però, le molecole all'interno di un liquido si attraggono, in quanto la situazione normale prevede , e la disposizione geometrica risponde ad un alto tasso di simmetria: questo porta al verificarsi dell'annullamento - in media - delle forze agenti sulla specifica molecola; per quanto riguarda, invece, le molecole sulla superficie libera, la simmetria non sussiste ed esse risentono di una forza diretta verso l'interno del liquido. Questo risultato indica che l'aumento della superficie libera non può avvenire spontaneamente: per un aumento di superficie bisogna perciò compiere un lavoro , definito come . In quest'ultima espressione, indica la tensione superficiale e dipende dal tipo di liquido, dal gas che si trova al di sopra della superficie libera, dal solido o liquido con cui la sostanza in esame è a contatto e dalla temperatura .
Alcuni valori
[modifica | modifica wikitesto]Considerando liquidi a contatto con l'aria con una temperatura 20 °C, la tensione superficiale sarà:

| Materiale | Tensione superficiale (N/m) |
|---|---|
| Acqua | 0,073 |
| Mercurio | 0,559 |
| Benzene | 0,029 |
| Olio di oliva | 0,0319 |
Stalagmometro
[modifica | modifica wikitesto]Per misurare sperimentalmente il valore della tensione superficiale di un liquido si ricorre allo stalagmometro: questo strumento si basa sulla caduta di gocce da un tubo. La goccia in uscita dal tubicino è trattenuta dalla tensione superficiale agente sulla linea , se è il raggio del foro; ricordando che è una forza per unità di lunghezza, la forza totale vale ed è verticale. Il distacco della goccia avviene quando essa ha raggiunto una dimensione tale che il suo peso eguagli la forza dovuta alla tensione superficiale, cioè : questa relazione consente la misura di .
Teoria delle bolle di sapone
[modifica | modifica wikitesto]La struttura della bolla di sapone è dovuta all'equilibrio tra le forze di pressione in gioco e di conseguenza a giustificare la dimensione della bolla è una differenza di pressione tra l'ambiente interno e quello esterno; uno studio approfondito di questo fenomeno è stato effettuato da Laplace.
Si immagini di voler portare il raggio di una bolla di sapone da a . Il lavoro compiuto dalle pressioni interne ed esterne per aumentare il volume da a deve essere uguale al lavoro della forza di tensione superficiale per portare la superficie da a . Seguono le deduzioni matematiche:
Dalle relazioni precedenti si deduce l'equazione di Laplace per le bolle di sapone:
Se la bolla fosse piena, il termine nel calcolo del lavoro della tensione superficiale non andrebbe considerato perciò l'equazione - in quel caso - sarebbe:
Bagnabilità
[modifica | modifica wikitesto]
Nel momento in cui si dovesse tenere conto di ciò che si trova al di fuori del liquido, non è più sufficiente considerare le sole forze di coesione, in quanto la presenza di un altro corpo ha influenza sui valori della tensione, nel senso che le molecole di questo svolgono anch'esse delle azioni (le forze di adesione) sulle molecole dello strato superficiale del liquido. In effetti, per ragioni del tutto simili a quelle sopra indicate, anche la superficie dei solidi possiede tensioni superficiali, ma a causa della mancanza di mobilità della superficie questa non è direttamente osservabile, né misurabile con metodi diretti.
Quando liquido e solido vengono in contatto, quindi, a causa delle interazioni tra le differenti fasi viene a stabilirsi una tensione interfacciale definita come l'energia addizionale per unità di area dovuta alla formazione di un'interfaccia (supponendo anche la presenza di un gas) solido/liquido e solido/gas.
Il profilo di una porzione di liquido posta su una superficie solida formerà con essa un angolo (vedere figure) che sarà maggiore o minore dell'angolo retto a seconda che in prevalga in modulo il risultante delle forze di coesione, , (normale alla tangente al profilo del liquido in e rivolto verso l'interno), oppure il risultante delle forze di adesione, , (normale alla superficie solida rivolto verso di essa).
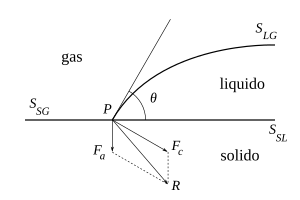
Dette , e , rispettivamente le superfici di separazione liquido/gas, solido/liquido e solido/gas, e indicate con , , le loro energie libere, l'energia libera totale è:
Il liquido si dispone in modo da minimizzare l'energia libera totale delle superfici (è trascurabile, per piccoli volumi, il termine gravitazionale dell'energia rispetto a quello superficiale ). Un'utile espressione dell'angolo di contatto è fornita dalla condizione di equilibrio, data dall'equazione di Young:
Soltanto e sono determinabili sperimentalmente, si trovano tuttavia nella letteratura scientifica delle relazioni sperimentali per il calcolo di e , come ad esempio la legge di Girifalco e Good (1957-60):
con
e e volumi molari di solido e liquido.
Le condizioni limite e esprimono rispettivamente:
- bagnabilità completa con la formazione di uno strato di liquido di spessore molecolare;
- totale assenza di bagnabilità.
In conclusione, la bagnabilità, favorita da basse energie interfacciali, elevate energie superficiali e modeste tensioni superficiali, a parità di liquido bagnante () e di tipo di materiale solido, risulta fortemente influenzata dallo stato di levigatezza e dalla presenza di impurità sulla superficie del materiale stesso: ciò è osservabile sperimentalmente anche sotto forma di menisco.
Termodinamica
[modifica | modifica wikitesto]
Le azioni attrattive tra le molecole di un liquido (le forze di coesione) fanno sì che le molecole dello strato superficiale siano soggette a una forza risultante non nulla che tende a farle spostare verso l'interno; esse pertanto tendono a sfuggire dalla superficie limite del liquido e di conseguenza questa tende ad assumere la estensione minima possibile (in assenza di altre forze, la superficie minima è quella sferica).
Le molecole sulla superficie possiedono un'energia potenziale superiore a quella delle molecole all'interno del liquido, sicché se si vuole aumentare l'estensione della superficie libera di un liquido occorre spendere un'energia proporzionale all'aumento di superficie.
Se il liquido viene sottoposto a una trasformazione che alteri esclusivamente la sua superficie , si ha una variazione dell'energia interna, , che è praticamente pari alla variazione di energia potenziale dello strato superficiale, e quindi proporzionale all'incremento della superficie. Tale variazione di energia interna (per il Primo principio della termodinamica) è in parte () fornita dall'energia cinetica delle molecole dell'ambiente e in parte () corrispondente a un lavoro meccanico che deve essere fornito dall'esterno.
Si definisce tensione superficiale (o energia libera superficiale) di un liquido la quantità di lavoro richiesto per aumentare la estensione della sua superficie di un'unità mantenendo costanti temperatura e pressione del sistema, cioè l'aumento di energia libera per unità di superficie:
- ,
dove è l'energia libera di Gibbs e è la superficie.
Da ciò è possibile dedurre la prima equazione di Kelvin che fornisce l'entalpia superficiale (o energia superficiale)
Influenza della temperatura sulla tensione superficiale
[modifica | modifica wikitesto]Esistono solo relazioni empiriche per determinare l'influenza della temperatura sul valore assunto dalla tensione superficiale.
Eötvös
[modifica | modifica wikitesto]in cui:
- è il volume molare della sostanza
- è la temperatura critica
- è costante per ciascuna sostanza.
Ad esempio, per l'acqua k = 1,03 erg/°C, V= 18 ml/mol e TC= 374 °C.
Relazione liquido temperatura
[modifica | modifica wikitesto]in cui è una costante di ciascun liquido e è un fattore empirico, il cui valore è 11/9 per i liquidi organici.
Salto di pressione attraverso una superficie curva
[modifica | modifica wikitesto]In assenza di viscosità, il salto di pressione attraverso una superficie curva è dato dall'equazione di Young-Laplace, che pone in relazione la pressione all'interno di un liquido con la pressione esterna, la tensione superficiale e la geometria della superficie.
- .
Tale equazione è applicabile a qualsiasi superficie:
- per una superficie piana : pressione interna ed esterna si equivalgono;
- per una superficie sferica
- per una superficie toroidale , dove r e R sono i raggi del toroide.
Per una bolla sferica reale il termine dovuto alla tensione superficiale è doppio. Ciò è dovuto alla presenza di due superfici, una interna e una esterna alla bolla.
Seconda equazione di Kelvin
[modifica | modifica wikitesto]La seconda equazione di Kelvin è ottenibile utilizzando l'Equazione di Clapeyron; essa evidenzia come, a causa della tensione superficiale, la tensione di vapore di piccole gocce di liquido in sospensione sia superiore alla tensione di vapore "standard" dello stesso liquido disposto in uno strato piano.
dove:
- è la tensione di vapore standard di un determinato liquido a una data temperatura e pressione.
- rappresenta il volume molare.
- è il raggio della sfera.
- è la costante dei gas.
Note
[modifica | modifica wikitesto]Bibliografia
[modifica | modifica wikitesto]- Donato Spataro, Trattato teorico e pratico di idromeccanica. v.1, U. Hoepli, Milano, 1915.
- Lev Davidovič Landau, Evgenij Michajlovič Lifšic, Fisica Statistica, Editori Riuniti, Roma, 1978.
- (EN) Landau L.D., Lifshitz E.M., Fluid mechanics, Pergamon Press, 1959.
- Duilio Citrini, Giorgio Noseda, Idraulica, Cesano Boscone, Casa Editrice Ambrosiana, 1987, p. 468.
Voci correlate
[modifica | modifica wikitesto]- Menisco (fisica)
- Superficie minima
- Paracoro
- Capillarità
- Sforzo normale
- Sforzo di taglio
- Deformazione
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file sulla tensione superficiale
Wikimedia Commons contiene immagini o altri file sulla tensione superficiale
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) surface tension, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Tensione superficiale (PDF), su polymertechnology.it.
- Flusso di Marangoni, su strangepaths.com.
- Video che mostra gli effetti della tensione superficiale., su fisica.decapoa.altervista.org. URL consultato il 19 dicembre 2008 (archiviato dall'url originale il 5 marzo 2016).
- Tensioni superficiali di liquidi, su itchiavari.org.
- (EN) Tensione interfacciale (PDF) [collegamento interrotto], su gtdbernoulli.nl.
- (DE) Adesione (PDF), su sundoc.bibliothek.uni-halle.de.
| Controllo di autorità | Thesaurus BNCF 41692 · LCCN (EN) sh85130727 · GND (DE) 4139720-4 · BNF (FR) cb11977813j (data) · J9U (EN, HE) 987007551147205171 · NDL (EN, JA) 00563859 |
|---|


 French
French Deutsch
Deutsch





































![{\displaystyle \phi ={\frac {4{\sqrt[{3}]{V_{S}\cdot V_{L}}}}{({\sqrt[{3}]{V_{S}}}+{\sqrt[{3}]{V_{L}}})^{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9fa6cf165a5108cd3ac2dc75156e543f13ea57c8)


























