ホルトンのタキソール全合成

ホルトンのタキソール全合成(ホルトンのタキソールぜんごうせい)は最初のタキソール全合成であり、1994年にロバート・ホルトン (Robert A. Holton) らの研究グループによって報告された[1][2][3]。ホルトンのタキソール全合成は、市販 (commercially available) の天然物であるパチョレンオキシド (patchoulene oxide) を出発物質とした直線的な合成法の良い例である。このエポキシドはパチョロールやボルネオールといったテルペンから2段階で得られる。一連の反応はエナンチオ選択的であり、(−)-パチョレンオキシドから (+)-タキソールが、(−)-ボルネオールからは (−)-タキソールが得られ、それぞれ 47° (c 0.19, メタノール) の旋光度を持つ。ホルトン法は、アミド尾部の結合を除いて約37段階を経る他の合成法に比べ、比較的短い。タキソールのABCD環に必要な20の炭素のうち、15が既に出発物質のパチョロールに含まれているのが理由の1つである。
合成に必要な原料は、パチョレンオキシドの他には 4-ペンタナール、メタクロロ過安息香酸 (MCPBA)、臭素化メチルマグネシウム、ホスゲンである。この経路で鍵となる段階はチャン転位 (Chan rearrangement) とスルホニルオキサジリジンによるエノラートの酸化である。
逆合成解析
[編集]逆合成解析を以下に示す。
 |
| Retrosynthesis |
|---|
AB環の合成
[編集]まず転位反応を連続して行い、パチョレンオキシド 1 から6員環と8員環が縮環しているAB環を作る(式1)。t-ブチルリチウムが 1 の酸性な α-エポキシドプロトンを引き抜けば、エポキシドの開環脱離が起こり、アリルアルコール 2 が生成する (a)。同時に生成するアルケン部分を過酸化 t-ブチルとテトライソプロピルスズで酸化し、エポキシド 3 とする (b)。続く反応で、ルイス酸三フッ化ホウ素触媒によりエポキシ環を開き、イソプロピル部位の骨格転移と脱離を起こしてジオール 4 を得る (c)。新たに作られたヒドロキシ基は、クロロトリエチルシラン、ジメチルアミノピリジン (DMAP)、ピリジンとの反応でトリエチルシリルエーテル 5 として保護する (d)。再び生成したアルケン部分は MCPBA でエポキシ化する (e)。エポキシド 6 は不安定で、アルコール部分のケトンへの酸化に伴って C−C 結合の開裂が起こり、AB環を持つ 1.7 が出来る (f)。次の段階では、生成したケトン基を利用してC環に必要な炭素の追加を行う。7 のヒドロキシ基は t-ブチルジメチルシリル (TBS) エーテルとして保護しておく。リチウムジイソプロピルアミド (LDA) と臭素化メチルマグネシウムとの反応で 7 のケトン基を臭化マグネシウムエノラート 8 とし (g)、これをアルドール反応で 4-ペンタナールに付加させ、2級アルコール 9 とする (h)。この2級アルコールは、まずジクロロメタン中ホスゲンとピリジン、次いでエタノールを作用させることにより炭酸エステル 10 として保護する (i)。11 へのアシロイン基の導入はタキソールへと導かれるエナンチオマーを得るために立体選択的に行うが、LDA でエノラートを生成させ、これを (+)-カンファースルホニルオキサジリジンで酸化することにより達成する (j)。ケトン基を Red-Al で還元してアルコールとし、塩基で後処理を行うと炭酸エステルの転移とエタノールの脱離が起こり、環状炭酸エステル 12 が得られる (k)。

C環の合成
[編集]シクロヘキサン環であるC環の合成には、2回の C−C 結合生成が必要である(式2)。アルコール 12 はスワン酸化でケトン 13 に変換する (a)。この段階での最初の C−C 結合生成は、リチウムテトラメチルピペリジドによる炭酸エステルの α-ヒドロキシエステル 14 へのチャン酸化である (b)。生成したヒドロキシ基はヨウ化サマリウム(II) で還元してエノール 15 とし (c)、酸性のシリカゲルカラム上での後処理によりケトン 16 を得る (d)。この化合物はシス体とトランス体の混合物として得られるが、不要なトランス異性体(縮環したB環とラクトンC環が船型-船形配座にある)は塩基処理と酸性条件での後処理によりエノラートに戻して再利用することにより、シス体へと変換できる。リチウムテトラメチルピペリジドと (+)-カンファースルホニルオキサジリジンによる α-ケトヒドロキシ基の追加(アシロイン 17 の生成)は、ホルトン法における第2のスルホニルオキサジリジンによるエノラート酸化であるが、C環上の C3 炭素上の水素のほうがより酸性であるにもかかわらず、選択的にA環上の C1 位で起こる (e)。ケトン基を Red-Al でヒドロキシ基に還元して 18 を得る (f)。

ジオール 18 はホスゲンを用いて炭酸エステル 19 として保護する(式3、a)。次に、末端アルケンをメタノール中水素化ナトリウムの存在下でオゾン分解し、メチルエステル 20 に変換する (b)。C環合成における第2の C−C 結合生成は 20 のディークマン縮合であり、テトラヒドロフラン (THF) 中 −78 ℃で LDA と反応させ、酢酸で処理してエノールエステル 21 とする (c)。エステル基の脱炭酸を行うために、p-トルエンスルホン酸と 2-メトキシプロペンでヒドロキシ基をメトキシプロピル (MOP) エーテル 22 として保護する (d)。ヒドロキシ基を保護しておいて、ジメチルホルムアミド (DMF) 中カリウムチオフェノラートとの反応(バートン脱炭酸 (Barton decarboxylation) の変法)で脱炭酸し、23 とする (e)。続く2段階では MOP エーテルを酸で脱保護してアルコール 24 とし (f)、ベンジルオキシメチル (benzoyloxymethyl, BOM) クロリド、N,N-ジイソプロピルエチルアミン、4級アンモニウム塩 (quat) を用いて、より強い保護基である BOM エーテルで再保護する (g)。ケトン 25 は LDA とクロロトリメチルシランで TMS エノールエーテル 26 とし (h)、続いて MCPBA で酸化してアシロイン 27 を得る (i)。タキソール骨格まであと1つの炭素を残すのみであるが、これはケトンに対して10等量の過剰の臭化メチルマグネシウムを用いるグリニャール反応で導入し、3級アルコール 28 とする (j)。ここで導入した炭素はあとでオキセタンD環になる。バージェス試薬 (Burgess reagent) でアルコールを環外アルケンとし、酸での後処理により脱保護されたアルコール 29 が得られる (k)。

D環の合成
[編集]このセクションではD環の合成を完成させ、B環を適切な置換基で修飾する(式4)。アリルアルコール 29 をピリジン中四酸化オスミウムで酸化しトリオール 30 とする (a)。3つのアルコール基に、次の5つの反応でそれぞれ修飾を施す。まず1級アルコールをクロロトリメチルシランで TMS エーテル 31 として保護し (b)、2級アルコールを塩化トシルと反応させトシラート基を持つ 32 に変換する (c)。不要になった TMS 基は酢酸で脱保護し、33 とする (d)。次の段階で C20 上のヒドロキシ基を求核剤、トシル基を脱離基とした C5 上での反転を伴う求核置換により、オキセタン 34 を生成させる (e)。残っている3級アルコールは無水酢酸、DMAP、ピリジンでアシル化 (35) しておき (f)、アセトニトリル中、フッ化水素・ピリジン錯体で TES を脱保護して C10 上のヒドロキシ基を元に戻す (36, g)。THF 中、−78 ℃でフェニルリチウムを作用させ、炭酸エステルをヒドロキシベンゾエート 37 とする (h)。これでB環の下半分は完成である。上半分のヒドロキシ基は過ルテニウム酸テトラプロピルアンモニウム (TPAP)、N-メチルモルホリンオキシド (NMO) で酸化して ケトン 38 とし、THF中低温でカリウム t-ブトキシドによりエノラートに変換したのち (i)、ベンゼンセレネン酸無水物でさらに酸化してアシロイン 39 とする (j)。これをアシル化してアシルケトン 40 を得る (k)。
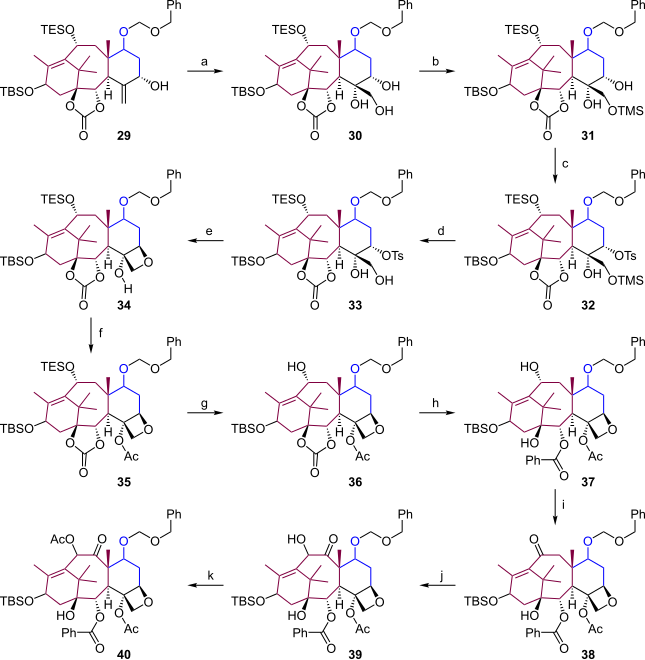
尾部の付加
[編集]本合成法における尾部の付加(式5)は、尾島法を用いるニコラウの尾部付加と同じである。40 の C13 上のヒドロキシ基はトリス(ジメチルアミノ)スルホニウムジフルオロトリメチルシリケート (TASF) で脱保護する (a)。41 のリチウムアルコキシドと尾島ラクタム 42 の反応で尾部を付加させ、43 を得る (b)。TES の脱保護 (c) と、パラジウム炭素触媒存在下の水添での BOM 脱保護 (d) を行い、タキソールを得る。

前駆体の合成
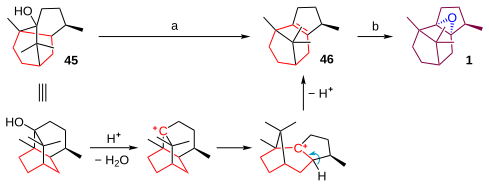
[編集]3環性の化合物パチョロール 45 は、プロトン酸の存在下でカルボカチオンの転位、続いて脱離反応を起こす。この転位の駆動力は環ひずみからの解放である。脱離はザイツェフ則に従う。次の段階で、生成した二重結合をエポキシ化し、パチョレンオキシド 1 を得る。
脚注
[編集]- ^ Holton, R. A.; Somoza, C.; Kim, H. B.; Liang, F.; Biediger, R. J.; Boatman, P. D.; Shindo, M.; Smith, C. C.; Kim, S.; Nadizadeh, H.; Suzuki, Y.; Tao, C.; Vu, P.; Tang, S.; Zhang, P.; Murthi, K. K.; Gentile, L. N.; Liu, J. H. "First total synthesis of taxol. 1. Functionalization of the B ring." J. Am. Chem. Soc. 1994, 116, 1597–1598. DOI: 10.1021/ja00083a066
- ^ Holton, R. A.; Kim, H. B.; Somoza, C.; Liang, F.; Biediger, R. J.; Boatman, P. D.; Shindo, M.; Smith, C. C.; Kim, S.; Nadizadeh, H.; Suzuki, Y.; Tao, C.; Vu, P.; Tang, S.; Zhang, P.; Murthi, K. K.; Gentile, L. N.; Liu, J. H. "First total synthesis of taxol. 2. Completion of the C and D rings". J. Am. Chem. Soc. 1994, 116, 1599–1600. DOI: 10.1021/ja00083a067
- ^ Holton, R. A.; Juo, R. R.; Kim, H. B.; Williams, A. D.; Harusawa, S.; Lowenthal, R. E.; Yogai, S. "A synthesis of taxusin". J. Am. Chem. Soc. 1988, 110, 6558–6560. DOI: 10.1021/ja00227a043


 French
French Deutsch
Deutsch