Alfa-helix


Bij eiwitten is de α-helix een belangrijk element van de secundaire structuur. De α-helix werd voor het eerst gepostuleerd door Linus Pauling, Robert Corey, en Herman Branson in 1951. Hiervoor baseerden zij zich op de bekende kristalstructuren van de aminozuren en op Paulings voorspelling van de vlakke peptidebinding.
De aminozuren komen voor in een helixvorm van ongeveer 5 Å (0,5 nm) breed. Elk aminozuur is verantwoordelijk voor een draaiing van 100° rond de as van de helix, met andere woorden er komen 3,6 aminozuren per draai rond de as voor. Dit komt overeen met een vooruitgang van 1,5 Å (0,15 nm) langs de helixas. De dicht opeengepakte α-helix is een zeer stabiel structureel motief omdat er haast geen vrije ruimte is. De α-helix wordt gestabiliseerd door waterstofbruggen tussen de peptidebindingen van aminozuren die vier residuen uit elkaar liggen: tussen de N-H groep van het nde aminozuur en de C=O van het (n+4)de aminozuur.
Een helix is gewoonlijk geladen: de N-terminus is positief, terwijl de C-terminus negatief geladen is. Deze ladingsopbouw werkt destabiliserend. Aan de N-terminus van de helix komen daarom vaak negatief geladen aminozuren (zoals glutaminezuur) voor. Positief geladen aminozuren, zoals lysine, komen echter minder vaak voor aan de N-terminus. In een schematische voorstelling van eiwitten wordt een α-helix voorgesteld door een gekleurde pijl draaiend rond een centrale as.
- Alfa-helix
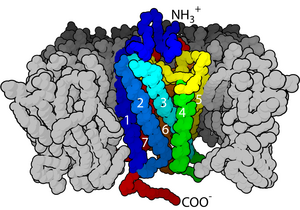
- De membraanreceptor rodopsine met zeven alfa-helixen in het hydrofobe domein
- Wieldiagram van de alfa-helix


 French
French Deutsch
Deutsch