DuPhos

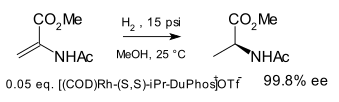
De verschillende verbindingen die samen DuPhos genoemd worden, vormen een groep chirale verbindingen die als ligand worden toegepast in katalysatoren voor asymmetrische synthese. De naam DuPhos is afgeleid van het bedrijf dat de liganden ontwikkelde (DuP, DuPont) en de klasse van verbindingen waar de groep toe behoort: de fosfolanen (Engels: Phospholanes). Deze difosfineligand werd voor het eerst beschreven en toegepast door M.J. Burk[1] en voor het eerst toegepast in de asymmetrische hydrogenering van enkele enamideesters tot uitgangsstoffen voor aminozuren:[2]
Hoewel meer asymmetrische fosfineliganden zoals DIPAMP, BINOL en CHIRAPHOS toen al beschikbaar waren, waren de verbindingen uit de DuPhos-groep effectiever.
Structuur
[bewerken | brontekst bewerken]De liganden bestaan uit twee 2,5-dialkyl gesubstitueerde fosfolaanringen (het fosfor-analog van THF) die via een 1,2-fenylbrug aan alkaar gekoppeld zijn. De alkylgroepen kunnen bestaan uit een methyl-, ethyl-, propyl- of isopropylgroep. Achtereenvolgens worden deze verbindingen aangeduid als Me-DuPhos, Et-DuPhos, Pr-Duphos en iPr-DuPhos.
De verbindingen worden gesynthetiseerd op basis van de chirale diolen. Deze worden omgezet in de cyclische sulfaten. In de volgende synthesestap reageert één molecuul fenylbisfosfine onder invloed van lithium met twee moleculen van het cyclische sulfaat.tot het product leidt. In fosforatomen in DuPhos zijn elektronenrijk, waardoor de resulterende metaalcomplexen reactiever worden dan in fosfanen op basis van een alifatische brug. De fosforatomen zelf vormen ook een bron van chiraliteit (inversie rond het fosforatoom is traag, in tegenstelling met die rond stikstof)[3]
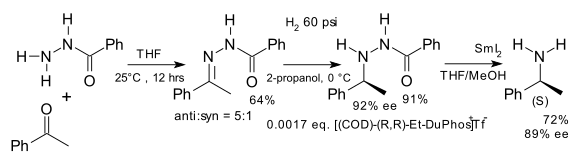
Een vroege toepassing van de DuPhos-liganden was de synthese van chirale, niet in de natuur voorkomende aminozuren via een (formele) reductieve aminering,[4] waarbij benzofenon en het hydrazon van benzoylchloride als uitgangsstof gebruikt werden.[5]:
Oorspronkelijk werd de reactie uitgevoerd met een katalysator op basis van rodium, vanaf 1995 werd ook ruthenium als zodanig toegepast[6] in de reductie van de ketongroep in β-ketoesters:
Toepassingen
[bewerken | brontekst bewerken]Een belangrijke toepassing van de DuPhos-katalysatoren wordt gevonden in de asymmetrische reductie van dehydrowarfarine tot warfarine.[7]
Ook in de synthese van derivaten van tryptofaan vindt DuPhos toepassingen.[8]
Katalyse in polymerisatiereacties
[bewerken | brontekst bewerken]DuPhosliganden worden toegepast als katalysator in de copolymerisatie van eindstandige alkenen met koolstofmonoxide. Hierbij worden chirale polyketonen gevormd die bovendien isotactisch zijn. De eerste onderzoekingen op dit gebied gaan terug tot 1994 met [Pd(Me-DuPhos(MeCN)2)](BF4)2 als katalysator.[9]
BozPhos ligand
[bewerken | brontekst bewerken]Mono-oxidatie van (R,R)-Me-Duphos met boraandimethylsulfide als beschermende groep en waterstofperoxide als oxidator leiden tot BozPhos.[10] Deze ligand wordt toegepast in de koper-gekatalyseerde asymmetrische additie van diorganozinkreagentia aan N-difenylfosfinoylimines.
- ↑ Mark J. Burk. (1991). C2-symmetric bis(phospholanes) and their use in highly enantioselective hydrogenation reactions J.Amer.Chem.Soc.. 113 (22): pag.: 8518–8519 DOI:10.1021/ja00022a047
- ↑ Mark J. Burk, John E. Feaster, William A. Nugent, Richard L. Harlow. (1993). Preparation and use of C2-symmetric bis(phospholanes): production of .alpha.-amino acid derivatives via highly enantioselective hydrogenation reactions J.Amer.Chem.Soc.. 115 (22): pag.: 10125–10138 DOI:10.1021/ja00075a031
- ↑ Karen V. L. Crépy, Tsuneo Imamoto. (2003). Recent Developments in Catalytic Asymmetric Hydrogenation Employing P-Chirogenic Diphosphine Ligands Advanced Synthesis & Catalysis. 345 (1-2): pag.: 79–101 DOI:10.1002/adsc.200390031
- ↑ Mark J. Burk, John E. Feaster. (1992). Enantioselective hydrogenation of the C:N group: a catalytic asymmetric reductive amination procedure J.Amer.Chem.Soc.. 114 (15): pag.: 6266–6267 DOI:10.1021/ja00041a067
- ↑ Mark J. Burk , Jose P. Martinez, John E. Feaster, Nick Cosford. (1994). Catalytic asymmetric reductive amination of ketones via highly enantioselective hydrogenation of the C=N double bond Tetrahedron. 50 (15): pag.: 4399–4428 DOI:10.1016/S0040-4020(01)89375-3
- ↑ J.P. Genêt, V. Ratovelomanana-Vidal, M.C. Caño de Andrade, X. Pfister, P. Guerreiro, J.Y. Lenoir. (1994). Practical asymmetric hydrogenation of β-keto esters at atmospheric pressure using chiral Ru (II) catalysts Tetrahedron Lett.. 36 (27): pag.: 4801–4804 DOI:10.1016/0040-4039(95)00873-B
- ↑ Andrea Robinson, Hui-Yin Li John Feaster. (1996). The first practical asymmetric synthesis of R and S-Warfarin Tetrahedron Lett.. 37 (46): pag.: 8321–8324 DOI:10.1016/0040-4039(96)01796-0
- ↑ R. Scott Hoerrner, David Askin, R.P. Volante, Paul J. Reider. (1998). A highly enantioselective asymmetric hydrogenation route to β-(2R,3S)-methyltryptophan Tetrahedron Lett.. 39 (21): pag.: 3455–3458 DOI:10.1016/S0040-4039(98)00604-2
- ↑ Zhaozhong Jiang, Ayusman Sen. (1995). Palladium(II)-Catalyzed Isospecific Alternating Copolymerization of Aliphatic .alpha.-Olefins with Carbon Monoxide and Isospecific Alternating Isomerization Cooligomerization of a 1,2-Disubstituted Olefin with Carbon Monoxide. Synthesis of Novel, Optically Active, Isotactic 1,4- and 1,5-Polyketones J.Amer.Chem.Soc.. 117 (16): pag.: 4455–4467 DOI:10.1021/ja00121a003
- ↑ Zie:
- Alexandre Côté, Jean-Nicolas Desrosiers, Alessandro A. Boezio, André B. Charette. (2006). Preparation of enantiomerically pure (R,R)-BozPhos Org.Synth.. 83 (1): pag.: 1
- Jean-Nicolas Desrosiers, Alexandre Côté, Alessandro A. Boezio, André B. Charette. (2006). Preparation of enantiomerically enriched (1S)-1-Phenylpropan-1-amine hydrochloride by a catalytic addition of diorganozinc reagents to imines Org.Synth.. 83 (1): pag.: 5


 French
French Deutsch
Deutsch