Isomeer

Isomeren (van het Grieks isos = gelijk, meros = deel) zijn stoffen die met elkaar overeenkomen doordat hun moleculen hetzelfde aantal en dezelfde soort atomen bevatten, maar die van elkaar verschillen door de wijze waarop die atomen onderling zijn verbonden of geschikt. Anders gezegd, isomeren zijn stoffen met dezelfde molecuulformule (brutoformule), maar een andere structuurformule.[1]
De chemische eigenschappen van isomeren zijn doorgaans verschillend.
Soorten isomerie
[bewerken | brontekst bewerken]- Structuurisomeren verschillen doordat de atomen verschillend verbonden werden. Voorbeelden zijn:
- n-butaan en isobutaan (beide C4H10)
- 1-fluorpropaan en 2-fluorpropaan (beide C3H7F; zie afbeelding rechts).
- Valentie-isomeren zijn structuurisomeren waarvan de molecuuldelen verschillend gegroepeerd zijn.
- Stereo-isomeren of geometrische isomeren zijn isomeren waarvan alle paarsgewijze bindingen tussen de atomen gelijk zijn. De verschillen tussen de isomeren liggen in de ruimtelijke indeling.
- Cis-trans-isomeren.
- Optische isomeren of enantiomeren zijn stereomeren die wel elkaars spiegelbeeld zijn.
- Diastereomeren zijn stereomeren die niet elkaars spiegelbeeld zijn. Daarnaast bestaan nog epimeren; dit zijn diastereomeren die in de configuratie slechts in 1 C-atoom verschillen, bijvoorbeeld D-glucose en D-mannose.
- Conformatie-isomeren en configuratie-isomeren, waarbij de eerste ontstaan door de rotatie rond een enkele binding en de tweede het gevolg zijn van het ontstaan van een nieuwe verbinding binnen een molecuul.
Indien twee isomeren snel in elkaar over kunnen gaan, noemt men de twee stoffen tautomeren.
Isomeren kunnen door rotatie als geheel of van de groepen verbonden door een enkele binding niet bedekt worden. De ene isomeer kan dus niet met de andere "samenvallen". Als dit wel zo is, dan is geen isomeer, maar hetzelfde molecuul.
Voorbeelden
[bewerken | brontekst bewerken]- De hierboven al vermelde alcohol en ether:
 |  |
| De twee isomeren van C2H6O: Ethanol en Dimethylether | |
Ethanol (een alcohol) en dimethylether bijvoorbeeld bestaan elk uit 6 waterstofatomen, twee koolstofatomen, en een zuurstofatoom; alleen de volgorde van de bindingen is verschillend.
- De hierboven al vermelde n-butaan en isobutaan:
 | 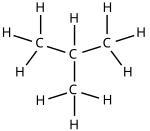 |
Aantal koolstofatomen in en isomeren van alkanen
[bewerken | brontekst bewerken]| alkaan | aantal koolstof | aantal isomeren[2] | incl. stereo- isomeren | details isomerie | |
|---|---|---|---|---|---|
| Methaan | 1 | 1 | |||
| Ethaan | 2 | 1 | |||
| Propaan | 3 | 1 | |||
| Butaan | 4 | 2 | [3] 2 | Zie hierboven | |
| Pentaan | 5 | 3 | [3] 3 | Zie lijst | |
| Hexaan | 6 | 5 | [3] 5 | Zie lijst | |
| Heptaan | 7 | 9 | 11 | Zie lijst | |
| Octaan | 8 | 18 | 24 | Zie lijst | |
| Nonaan | 9 | 35 | 56 | Zie lijst | |
| Decaan | 10 | 75 | Zie lijst | ||
| Undecaan | 11 | 159 | Zie lijst | ||
| Dodecaan | 12 | 355 | Zie lijst | ||
| Tridecaan | 13 | 802 | Zie lijst | ||
| Tetradecaan | 14 | 1855 | Zie lijst | ||
| Pentadecaan | 15 | 4347 | |||
| Hexadecaan | 16 | 10.359 | synoniem: cetaan | ||
| Eicosaan | 20 | 366.319 |
Referenties
[bewerken | brontekst bewerken]- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). samengesteld door A. McNaught en A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). XML on-line gecorrigeerde versie: Goldbook.iupac.org (2006-) door M. Nic, J. Jirat, B. Kosata; updates door A. Jenkins. ISBN 0-9678550-9-8. doi:10.1351/goldbook.
- ↑ Constitutional Isomers of Alkanes. Scribd (23 May 2011). Geraadpleegd op 7 juni 2016.
- ↑ a b c Dit molecuul bevat geen chirale centra.


 French
French Deutsch
Deutsch