Sulfoxide

De sulfoxiden vormen een klasse van organische zwavelverbindingen. Ze bestaan uit een zwavelatoom, waaraan enerzijds via een dubbele binding een zuurstofatoom is gebonden en anderzijs 2 alkyl- of arylgroepen zijn gebonden. Ze dragen de algemene brutoformule R-S(=O)-R', waarbij R en R' de alkyl- of arylgroepen voorstellen.
Sulfoxiden kunnen beschouwd worden als geoxideerde sulfiden. Ze vormen de zwavelanaloga van carbonylverbindingen. Een veelgebruikt sulfoxide, onder meer als oplosmiddel, is dimethylsulfoxide (afgekort tot DMSO). Een voorbeeld van een natuurlijk voorkomend sulfoxide is alliine.
Structuur
[bewerken | brontekst bewerken]Hoewel sulfoxiden lijken op carbonylverbindingen, is de aard van de dubbele binding tussen zwavel en zuurstof anders dan die tussen koolstof en zuurstof. De interactie tussen zwavel en zuurstof is van elektrostatische aard en resulteert in een significant dipolair karakter. De minder efficiënte overlap van de p-orbitalen van koolstof en het grotere zwavel ligt aan de basis hiervan. De negatieve lading ligt hoofdzakelijk op zuurstof (wegens de grotere elektronegativiteit). De resonantiestructuren geven dit weer:
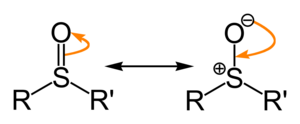
Bij de rechtse resonantiestructuur zit een vrij elektronenpaar op zwavel, wat de functionele groep een typisch tetraëdrische structuur geeft, zoals bij een sp3-gehybridiseerd koolstofatoom.
Chiraliteit
[bewerken | brontekst bewerken]Wanneer de R- en R'-groep verschillend zijn, wordt zwavel een chiraal centrum. Voorbeelden hiervan zijn methylfenylsulfoxide en het natuurlijke, in knoflook voorkomende, alliine.

De energie die nodig is voor inversie rond dit chiraal centrum is hoog genoeg opdat het sulfoxide optisch actief is (in tegenstelling tot bijvoorbeeld amines, waar stikstofinversie optreedt). Er treedt bijgevolg (traag) racemisatie op. Chirale sulfoxide vinden hun toepassing in een aantal geneesmiddelen, zoals esomeprazol en armodafinil.
Reactiviteit
[bewerken | brontekst bewerken]Sulfiden zijn de meest voorkomende precursors voor de organische oxidatie tot sulfoxiden. Dimethylsulfide kan geoxideerd worden tot dimethylsulfoxide, waarbij de oxidatietoestand van zwavel stijgt van -II tot 0. Verdere oxidatie van DMSO leidt tot de vorming van dimethylsulfon, waarbij zwavel oxidatietoestand +II bezit.
Sulfoxiden, zoals DMSO, bezitten een basisch karakter, waardoor het uitstekende liganden zijn en snel gealkyleerd kunnen worden. Alkylsulfoxiden zijn vatbaar voor α-deprotonering door sterke basen, zoals natriumhydride.
Zie ook
[bewerken | brontekst bewerken]Externe links
[bewerken | brontekst bewerken]- (en) Synthese van sulfoxiden door oxidatie van sulfiden (Organic Chemistry Portal)


 French
French Deutsch
Deutsch