Chlorofil A – Wikipedia, wolna encyklopedia
| |||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||
| Wzór sumaryczny | C55H72MgN4O5 | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 893,49 g/mol | ||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||
| Podobne związki | inne chlorofile, porfiryny, feofityna | ||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||

Chlorofil A – organiczny związek chemiczny z grupy chlorofili, występujący w chloroplastach komórek roślinnych o budowie zbliżonej do występującej w przyrodzie porfiryny, biorący udział w procesie fotosyntezy.
W odróżnieniu od innych barwników fotosyntetycznych chlorofil a występuje u wszystkich glonów fotosyntetyzujących, łącznie z sinicami[3].
Chlorofil A znajduje zastosowanie w przemyśle spożywczym jako barwnik spożywczy do barwienia produktów spożywczych.
Budowa
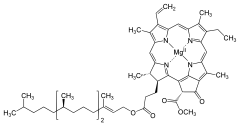
[edytuj | edytuj kod]Chlorofil a jest kompleksem z centralnie związanym koordynacyjnie jonem magnezu z czterema pierścieniami pirolowymi, połączonymi z sobą mostkami metinowymi (=CH−), tworzącymi układ porfiryny. Występujące w cząsteczce chlorofilu a dwie grupy kwasowe są zestryfikowane odpowiednio metanolem i fitolem (C20H39OH), który stanowi długi hydrofobowy ogon kotwiczący cząsteczkę chlorofilu a w dwuwarstwie lipidowej błon biologicznych.
Widmo absorpcyjne chlorofilu a sięga od fal o długości poniżej 400 nm do około 700 nm, przy czym pomiędzy 480 nm a 550 nm ma minimum – co sprawia, że ma on zieloną barwę, a maksima ma przy falach o długości 430 nm i 662 nm, czyli nieco szerzej niż u chlorofilu b, który ma maksima przy falach o długości 453 nm i 642 nm[4]. In vivo sytuacja jest bardziej złożona, a maksima są przesunięte o 10-20 nm w stronę dłuższych fal. U różnych glonów maksimum może przypadać na fale o długości od 660 do 705 nm. Może mieć to związek z agregowaniem się cząsteczek chlorofilu a i wiązaniem z białkami. W tej samej komórce mogą występować formy chlorofilu a, z których jedna ma maksimum absorpcji przy 640 nm, a druga przy 650 nm, mimo braku zauważalnych różnic w budowie[3].
Chlorofile ulegają rozkładowi pod wpływem intensywnego światła, zwłaszcza czerwonego, a chlorofil b jest bardziej na to odporny od chlorofilu a[3].
Zastosowanie chlorofilu jako barwnika
[edytuj | edytuj kod]Chlorofil a (E140, C.I. 75810, naturalna zieleń 3)[5] jest używany jako barwnik w przemyśle spożywczym do produkcji np. zup, sosów, oliwy z oliwek, oleju sojowego, lodów oraz fermentowanych napojów mlecznych. Został uznany za nieszkodliwy w zastosowaniach spożywczych. Rzadko spotykanym działaniem niepożądanym chlorofilu jest nadwrażliwość na światło[6]. Jest również wykorzystywany w produktach takich jak antyperspiranty i płyny do płukania jamy ustnej[6].
Zastosowanie w ocenie stanu środowiska
[edytuj | edytuj kod]
Stężenie chlorofilu a w wodzie jest powszechnie stosowanym miernikiem szacowanej biomasy fitoplanktonu. Mimo że u różnych gatunków i w różnych warunkach fizjologicznych zawartość tego barwnika w komórkach się zmienia, to w warunkach naturalnych po uśrednieniu korelacja biomasy i stężenia chlorofilu a jest dość silna. W przypadku innych zespołów glonów, np. peryfitonu, jest to gorszy wskaźnik[7]. Badania stężenia chlorofilu w powierzchniowych warstwach oceanów są regularnie prowadzone od początku XX wieku różnymi metodami. Początkowo stężenie chlorofili różnych typów w wodzie pobranej ze środowiska było badane głównie metodą spektofotometryczną, później fluorymetryczną. Z czasem rozpoczęto pomiary satelitarne przyżyciowej fluorescencji fitoplanktonu[8]. W monitoringu jakości wód powierzchniowych nadal podstawową metodą jest spektrofotometria chlorofilu wyekstrahowanego z wody przy użyciu etanolu lub acetonu[9]. Inne stosowane rozpuszczalniki to metanol lub eter. Do oczyszczania stosowana jest chromatografia cieczowa, bibułowa lub cienkowarstwowa[7].
Rozwój fitoplanktonu jest wskaźnikiem eutrofizacji, w związku z czym stężenie chlorofilu a jest jedną z jej miar. Według różnych badaczy o eutroficznym stanie jezior świadczy stężenie chlorofilu a powyżej 8–10 mg/m³. Jedna z definicji zakwitu wody daje jako kryterium stężenie chlorofilu a co najmniej 20 mg/m³, nawet gdy sam zakwit nie jest widoczny gołym okiem[7]. Pod koniec XX wieku wartość 10 mg/m³ przez kilkanaście lat obowiązywała w polskiej klasyfikacji jakości wód jako górna granica I klasy czystości powierzchniowych wód śródlądowych, podczas gdy wody o zawartości chlorofilu a powyżej 30 mg/m³ nie spełniały norm czystości[10]. Wraz z wdrażaniem Ramowej dyrektywy wodnej popularność tej miary stanu ekologicznego wód zmalała na rzecz wskaźników fitoplanktonowych różnego rodzaju, gdyż akt ten wymaga nie tylko określenia obfitości fitoplanktonu, lecz również jego składu taksonomicznego. Mimo to, w przypadku wód morskich, w tym przybrzeżnych i przejściowych będących w obszarze obowiązywania RDW, stężenie chlorofilu a po kilkunastu latach interkalibracji metod oceny stanu ekologicznego okazało się jedyną metodą możliwą do powszechnego stosowania i dającą porównywalne wyniki w różnych regionach. Wynika to między innymi z dużej zmienności struktury fitoplanktonu, zależnej od różnych czynników, nie tylko eutrofizacji, co do której to biomasa jest najbardziej powtarzalnym i rzetelnym wskaźnikiem, niezależnym od sezonowej zmienności fitoplanktonu[11]. Również w pierwszej fazie interkalibracji metod oceny stanu ekologicznego europejskich jezior stężenie chlorofilu a było brane jako jeden ze wskaźników. Granica między dobrym a umiarkowanym stanem ekologicznym została wówczas wyznaczona na poziomie od 2,7 mg/m³ w dużych, głębokich, zasadowych jeziorach nizinnych lub wyżynnych strefy alpejskiej do 10,8 mg/m³ w nizinnych płytkich jeziorach o dużej zawartości wapnia strefy centralno-bałtyckiej (obejmującej m.in. polskie jeziora polimiktyczne). Podobne wartości są przyjmowane w prawie amerykańskim i australijskim[9]. W przypadku polskich wód przejściowych i przybrzeżnych w przepisach z roku 2016 granica między bardzo dobrym a dobrym stanem ekologicznym waha się w zależności od akwenu od 1,2 mg/m³ do 15 mg/m³, podczas gdy zły stan ekologiczny jest wyznaczany przez stężenie od powyżej 3,1 mg/m³ do powyżej 50 mg/m³[12].
Stężenie chlorofilu a jest również często jednym ze wskaźników cząstkowych wchodzących w skład złożonych wskaźników jakości wód. W metodzie Phyto-Seen-Index (PSI) opracowanej do oceny stanu jezior w Niemczech oprócz wskaźników opartych ma składzie taksonomicznym fitoplanktonu pod uwagę brana jest średnie sezonowe i maksymalne stężenie chlorofilu a. We wskaźniku PMPL (polski multimetriks fitoplanktonowy) stosowanym w Polsce stężenie chlorofilu a jest jednym ze wskaźników obok biomasy ogólnej fitoplanktonu i biomasy sinic[13]. Wskaźnik opierający się na stężeniu chlorofilu a jest także jednym z metriksów składowych wskaźnika HRPI stosowanego w Chorwacji i na Węgrzech, a w zmodyfikowanej postaci na Łotwie i w Estonii[14]. W badaniach naukowych nad eutrofizacją powszechnie stosowany jest również indeks stanu troficznego Carlsona TSI, gdzie stężenie chlorofilu jest brane pod uwagę wraz ze stężeniem fosforu i widzialnością krążka Secchiego[15].
Przypisy
[edytuj | edytuj kod]- ↑ Chlorophyll a (nr 258253) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2013-06-04]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Chlorofil A (nr 258253) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2013-06-04]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b c Fotosynteza. W: Stefan Gumiński: Fizjologia glonów i sinic. Wrocław: Wydawnictwo Uniwersytetu Wrocławskiego, 1990, s. 28-52. ISBN 83-229-0372-3.
- ↑ Berenika Pokorska, Jakub Urbański: Barwniki fotosyntetyczne. Fundacja BioEdukacji i BioCentrum Edukacji Naukowej. [dostęp 2017-06-06].
- ↑ Food-Info.net: E140: Chlorofil. [dostęp 2010-09-28]. (pol.).
- ↑ a b Bill Statham: E213: Tabele dodatków i składników chemicznych. Warszawa: Wydawnictwo RM, 2006, s. 336. ISBN 978-83-7243-529-3.
- ↑ a b c Barbara Kawecka, Pertti Vesa Eloranta: Zarys ekologii glonów wód słodkich i środowisk lądowych. Warszawa: Wydawnictwo Naukowe PWN, 1994, s. 28–30, 179–184. ISBN 83-01-11320-0.
- ↑ Daniel G. Boyce, Marlon R. Lewis, Boris Worm. Global phytoplankton decline over the past century. „Nature”. 466 (7306), s. 591–596, 2010. DOI: 10.1038/nature09268. PMID: 20671703.
- ↑ a b Sandra Poikāne i inni, Defining Chlorophyll-a Reference Conditions in European Lakes, „Environmental Management”, 6, 45, 2010, s. 1286–1298, DOI: 10.1007/s00267-010-9484-4, PMID: 20401659, PMCID: PMC2885300 (ang.).
- ↑ Rozporządzenie Ministra Ochrony Środowiska, Zasobów Naturalnych i Leśnictwa z dnia 5 listopada 1991 r. w sprawie klasyfikacji wód oraz warunków, jakim powinny odpowiadać ścieki wprowadzane do wód lub do ziemi (Dz.U. z 1991 r. nr 116, poz. 503).
- ↑ Joint Position paper on the only use of Chl a for the establishment of ecological status (Phytoplankton element) in coastal waters. Ecostat. [dostęp 2017-06-06]. (ang.).
- ↑ Rozporządzenie Ministra Środowiska z dnia 21 lipca 2016 r. w sprawie sposobu klasyfikacji stanu jednolitych części wód powierzchniowych oraz środowiskowych norm jakości dla substancji priorytetowych (Dz.U. z 2016 r. poz. 1187).
- ↑ Andrzej Hutorowicz: Ocena stanu ekologicznego jezior z wykorzystaniem fitoplanktonu. W: Biologiczne metody oceny stanu środowiska. Hanna Ciecierska, Maria Dynowska (red.). T. II: Ekosystemy wodne. Olsztyn: Wydawnictwo Mantis, 2013, s. 38–58. ISBN 978-83-62860-19-7.
- ↑ Ute Mischke: XGIG Large River Intercalibration Exercise – Milestone 6 Report Intercalibrating the national classifications of ecological status for very large rivers in Europe Biological Quality Element: Phytoplankton 2. Version – November 2016. Joint Research Centre, listopad 2016. [dostęp 2017-10-01]. (ang.).
- ↑ Robert E. Carlson. A trophic state index for lakes. „Limnology and oceanography”. 22 (2), s. 361–369, 1977. DOI: 10.4319/lo.1977.22.2.0361. (ang.).


 French
French Deutsch
Deutsch