Chromatofor zwierząt – Wikipedia, wolna encyklopedia

Chromatofory – u zwierząt zawierające pigment organella komórkowe spotykane szeroko wśród zwierząt, w tym płazów, ryb, gadów, skorupiaków, głowonogów, a także u bakterii. Dla odmiany u ssaków i ptaków występuje rodzaj komórek zwanych melanocytami, pełniących podobną funkcję.
Chromatofory odpowiadają głównie za kolory skóry i oczu u zwierząt zimnokrwistych. Tworzą się w grzebieniu nerwowym podczas rozwoju zarodkowego. Dojrzałe chromatofory grupuje się w podklasy ze względu na ich kolor w świetle białym: żółte ksantofory, czerwone erytrofory, odbijające światło bądź tęczujące irydofory, białe leukofory, czarne lub brązowe melanofory oraz niebieskie cyjanofory.
Pewne gatunki cechuje zdolność do szybkiej zmiany barwy poprzez mechanizmy obejmujące translokację pigmentu i reorientację odblaskowych płytek w chromatoforach. Proces ten uchodzi za typ kamuflażu[1]. Głowonogi, jak na przykład ośmiornice, mają złożone narządy chromatoforowe pozostające pod kontrolą mięśni, podczas gdy kręgowce, jak kameleonowate, osiągają podobny efekt dzięki sygnałom odbieranym przez komórki, które mogą być dostarczane za pomocą hormonów lub neurotransmiterów. Proces ten może zainicjować zmiana nastroju, temperatury, stres czy widoczne zmiany w lokalnym środowisku.
Chromatofory podlegają też badaniom dotyczącym chorób ludzkich i służą w odkrywaniu nowych leków.
Termin „chromatofor” określać może również kolorowe pęcherzyki związane z błonami spotykane u niektórych form bakterii fotosyntezujących. Nazwa ta to też synonim plastydów u roślin i glonów[2].
Historia
[edytuj | edytuj kod]Arystoteles wspominał zdolność ośmiornicy do zmiany barwy dla kamuflażu bądź sygnalizacji w swej Historia animalium (około 400 p.n.e.). Uczony pisał, że zwierzę upodabniało swój kolor do kamieni, gdy polowało, a także, że zmieniało barwę zaniepokojone[3].
Giosuè Sangiovanni był pierwszym, który opisał magazynujące barwnik komórki u bezkręgowców jako chromoforo we włoskim piśmie naukowym w 1819[4].
Karol Darwin opisał zdolność zmiany barwy u mątwy podczas swej podróży na statku HMS Beagle (1860)[5].
Klasyfikacja
[edytuj | edytuj kod]Termin „chromatofor” od „cromoforo” Sangiovanniego znalazł zastosowanie jako nazwa komórki gromadzącej pigment pochodzącej z grzebienia nerwowego zimnokrwistych kręgowców bądź głowonogów. Słowo to pochodzi z greki od wyrazów khrōma (χρωμα) oznaczającego kolor i phoros (φορος) znaczącego „noszący”. Dla odmiany słowo „chromatocyt” od greckiego cyte (κυτε) znaczącego „komórka” używane jest na określenie komórki ptaków czy ssaków. U zwierząt tych zidentyfikowano tylko jeden rodzaj tych komórek, melanocyty. Dopiero w latach sześćdziesiątych XX wieku chromatofory poznano na tyle dobrze, by można je było sklasyfikować na podstawie ich wyglądu. System ten utrzymał się do tej pory, pomimo że biochemia pigmentu byłaby może bardziej użyteczna w naukowym zrozumieniu funkcji komórek[6].
Cząsteczki odpowiadające za powstawanie barw podzielić można na dwie odrębne grupy: pigmenty biologiczne (biochromes) i te tworzące barwy strukturalne (schemochromes). Do biochromów zaliczają się właściwe pigmenty jak karotenoidy, pterydyny, tetrapirole, flawiny, chinony, barwniki żółciowe, melaniny, indole. Ich cząsteczki selektywnie absorbują światło widzialne o pewnych długościach fali, odbijając światło o innej długości fali, docierające potem do oczu obserwatora[7]. Z kolei barwy strukturalne tworzą się dzięki różnorodnym połączeniom zjawisk rozpraszania, odbicia i dyfrakcji światła. Wiele takich struktur interferuje z pewnymi długościami fali (która wyznacza barwę), przepuszczając inne, z uwagi na swą wielkość, wobec czego często wywołują tęczowanie, tworząc odmienne barwy dla obserwatorów spoglądających z różnych kierunków[8].

Ksantofory i erytrofory
[edytuj | edytuj kod]Chromatofory zawierające duże ilości żółtych barwników pterydynowych nazywane są ksantoforami. Natomiast te gromadzące głównie czerwone lub pomarańczowe karotenoidy zwą się erytroforami[6]. Jednakże pęcherzyki zawierające pterydynę i karotenoidy znajdują się niekiedy w tej samej komórce. W takim przypadku barwa zależy od stosunku pigmentów czerwonych i żółtych[9]. Oznacza to, że rozróżnienie pomiędzy tymi dwoma typami chromatoforów nie jest ostre.
Większość chromatoforów ma zdolność tworzenia pterydyn z guanozyno-5'-trifosforanu. Ksantofory wydają się jednak prezentować dodatkowe ścieżki metaboliczne pozwalające im na gromadzenie żółtego barwnika. Dla kontrastu karotenoidy są metabolizowane i transportowane do erytroforów. Wykazano to po raz pierwszy poprzez hodowlę płazów bezogonowych (zielonych w normalnych warunkach) na diecie składającej się ze świerszczowatych o ograniczonej zawartości karotenu. Brak karotenu w pokarmie oznaczał również brak czerwonego bądź pomarańczowego filtru tworzonego przez erytrofory. W efekcie płazy zamiast zieleni prezentowały barwę niebieską[10].
Irydofory i leukofory
[edytuj | edytuj kod]Irydofory, czasami zwane też guanoforami, to komórki barwnikowe odbijające światło dzięki płytkom bądź krystalicznym schemochromom tworzonym z guaniny[11]. W obliczu światła tworzą one opalizujące barwy dzięki dyfrakcji światła na stosikach płytek. Orientacja schemochromów determinuje naturę obserwowanych kolorów[12]. Poprzez wykorzystanie biochromów jako filtrów światła irydofory osiągają w rezultacie efekt Tyndalla bądź rozpraszanie Rayleigha, tworząc barwy jasnoniebieskie czy jasnozielone[13].
Bliski poprzedniemu typ chromatoforów, leukofory, występuje u niektórych ryb, w szczególności w tapetum lucidum. Podobnie jak irydofory, zużywają one krystaliczne puryny (często guaninę), by odbijać światło. W przeciwieństwie jednak do irydoforów leukofory cechują się kryształami o większej organizacji, co zmniejsza dyfrakcję. Wystawione na działanie światła białego, tworzą biały połysk. Jak w przypadku ksantoforów i erytroforów, rozróżnienie pomiędzy irydoforami i leukoforami u ryb nie zawsze jest oczywiste, ale ogólnie irydofory tworzą barwy opalizujące, metaliczne, podczas gdy leukofory wytwarzając odblaskową biel[13].
Melanofory
[edytuj | edytuj kod]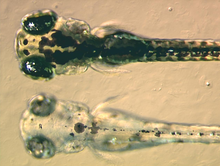
Melanofory zawierają eumelaninę, rodzaj melaniny postrzegany jako brązowy bądź czarny z uwagi na absorbowanie światła. Gromadzą ją pęcherzyki zwane melanosomami, rozlokowane w całej komórce. Euelanina powstaje z tyrozyny na szlaku kilku kalitycznych reakcji. Stanowi związek chemiczny zawierający w swej cząsteczce pierścień dihydroksyindolu, kwasu dihydroksyindolo-2-karboksylowego i pierścień pirolowy[14]. Kluczowym enzymem syntezy melaniny jest tyrozynaza. Gdy białko nie działa prawidłowo, synteza melaniny nie zachodzi, co skutkuje pewnymi typami albinizmu. U pewnych gatunków płazów występują inne barwniki upakowane razem z eumelaniną. Przykładowo u rzekotkowatych Phyllomedusa znaleziono melanofory z barwnikiem koloru głębokiej czerwieni (wina)[15]. Następnie zidentyfikowano go jako pterorodynę, dimer pterydynowy gromadzący się wokół rdzenia eumelanin, obecny także u licznych żab drzewnych z Australii i Papui-Nowej Gwinei. Wydaje się prawdopodobne, że inne, gorzej poznane gatunki mają złożone pigmenty melanoforów, niemniej prawdą jest, że większość zbadanych melanoforów zawiera wyłącznie eumelaninę[16].

Cyjanofory
[edytuj | edytuj kod]Prawie wszystkie jaskrawe barwy niebieskie zwierząt bądź roślin stanowią raczej barwy strukturalne, a nie pigmenty. Jednak pewne odmiany ryby Siniperca chuatsi posiadają pęcherzyki wypełnione cyjanowym biochromem o nieznanej budowie chemicznej. Znajdują się one w komórkach zwanych cyjanoforami[13]. Choć wydają się niezwykłe przez swój ograniczony zasięg pod względem taksonomii, mogą jednakże występować (jak również dalsze nietypowe rodzaje chromatoforów) wśród innych ryb bądź płazów. Przykładowo jasno zabarwione chromatofory o nieokreślonych pigmentach spotyka się u drzewołazowatych czy szklenicowatych[17], a atypowe dichromatyczne chromatofory, nazywane po angielsku terminem erythro-iridophores, wykryto u Pseudochromis diadema[18].
Translokacja pigmentu
[edytuj | edytuj kod]
Wiele gatunków posiadło zdolność translokacji pigmentu wewnątrz swych chromatoforów, co umożliwia im w efekcie zmianę barwy ciała. Proces ten określa się mianem fizjologicznej zmiany barwy. Został on szeroko zbadany w przypadku melanoforów, jako że melanina stanowi najciemniejszy i przez to najlepiej widoczny barwnik. U wielu gatunków o względnie cienkiej skórze skórne melanofory wykazują tendencję do przyjmowania płaskiego kształtu i pokrywania dużej powierzchni. Jednak u zwierząt o grubej skórze, jak dorosłe gady, skórne melanofory tworzą trójwymiarowe połączenia między sobą. Te jednostki chromatoforów skóry (DCU, dermal chromatophore units) składają się z najwyższej warstwy ksantoforów czy erytroforów, pod którymi leży warstwa irydoforów, a w końcu pod nimi napotyka się warstwę melanoforów koszykowatego kształtu, ich wyrostki pokrywają irydofory[19].
Oba rodzaje melanoforów pełnią ważną funkcję w fizjologicznej zmianie barwy. Płaskie melanofory skórne często zachodzą na inne chromatofory. Kiedy więc barwnik jest rozproszony w komórce, skóra zdaje się ciemna. Gdy zaś pigment gromadzi się w okolicy jej centrum, pigmenty innych chromatoforów są wystawione na światło i zaznacza się odcień skóry. Podobnie po agregacji melaniny w DCU skóra wydaje się zielona dzięki żółtym ksantoforom filtrującym bądź rozpraszającym światło z warstwy irydoforowej. Z dyspersją melaniny światło przestaje ulegać rozpraszaniu i skóra przybiera ciemny kolor. Jako że inne chromatofory również wykazują zdolność do translokacji barwnika, zwierzęta dysponujące licznymi rodzajami chromatoforów potrafią tworzyć spektakularne zbiory kolorów skóry, łącząc różne efekty[20][21].

Regulację i mechanikę szybkiej translokacji pigmentu dobrze zbadano u licznych gatunków, w szczególności płazów i ryb doskonałkostnych[13][22]. Pokazano, że procesy te mogą znajdować się pod kontrolą procesów hormonalnych lub neuronalnych. Substancją znaną z wpływu na translokację barwnika jest noradrenalina, działająca poprzez receptor na powierzchni melanoforu[23]. Hormony pierwotnie zaangażowane w regulację translokacji to prawdopodobnie melanokortyna, melatonina i MCH (melanin-concentrating hormone), produkują je głównie odpowiednio przysadka, szyszynka i podwzgórze. Hormony mogą również powstawać w komórkach skóry, działając parakrynowo. Na powierzchni melanoforów hormon aktywuje swoisty dlań receptor metabotropowy związany z białkiem G, który przekazuje sygnał do wnętrza komórki. Melanokortyna powoduje w ten sposób rozproszenie barwnika, podczas gdy melatonina i MCH skutkują jego agregacją[24].
Liczne receptory melanokortyny, MCH i melatoniny zidentyfikowano u ryb[25] i płazów bezogonowych[26]. Zaliczają się doń homologi MC1R[27], receptora melanokortyny znanego z regulacji barwy skóry i włosów u człowieka[28]. Wykazano, że MC1R odpowiada u danio pręgowanego za dyspersję melaniny[29]. Wykazano, że wewnątrz komórki cykliczny adenozyno-3',5'-monofosforan (cAMP) stanowi główny drugi przekaźnik translokacji pigmentu. Poprzez mechanizm nie do końca jeszcze poznany cAMP wpływa na kolejne białka, jak kinaza białkowa A, aktywując białka motoryczne przenoszące pęcherzyki zawierające pigment wzdłuż mikrotubuli i mikrofilamentów[30][31][32].
Adaptacja do środowiska
[edytuj | edytuj kod]Większość ryb, gadów i płazów przechodzi ograniczoną fizjologiczną zmianę barwy w odpowiedzi na zmiany w środowisku. Ten typ kamuflażu najczęściej występuje w postaci nieznacznego pociemnienia bądź pojaśnienia skóry w kierunku odcienia najbliższego środowiska. Pokazano, że proces ten zależy od widzenia, występuje tylko, kiedy zwierzę może widzieć środowisko[33]. Głównym czynnikiem odpowiedzialnym za zmianę barwy jest translokacja melaniny w melanoforach[24].
Rozwój
[edytuj | edytuj kod]
Podczas rozwoju zarodkowego kręgowców chromatofory tworzą się jak wiele innych komórek, z grzebienia nerwowego, parzystej wstęgi komórek powstających z brzegów tuby nerwowej. Posiadają one zdolność do migracji na dużą odległość. Pozwala ona chromatoforom zasiedlać liczne narządy ciała, w tym skórę, oczy, uszy czy mózg. Opuszczając falowo grzebień nerwowy, chromatofory obierają drogę grzbietowo-boczną poprzez skórę, osiągając ektodermę poprzez niewielkie otworki w blaszce podstawnej, bądź drogę brzuszno-przyśrodkową pomiędzy somitami a tubą nerwową. Wyjątek stanowią melanofory siatkówki, nabłonka barwnikowego oka. Nie pochodzą one z grzebienia nerwowego. Zamiast tego wybrzuszenie tuby nerwowej formuje kubki oczne, które tworzą siatkówkę. Kiedy i jak multipotencjalne chromatoforowe komórk prekursorowe (chromatoblasty) rozwijają się w pochodzące od nich podtypy komórek, stanowi przedmiot przyszłych badań. Wiadomo, że w przypadku zarodka danio pręgowanego 3 dni po zapłodnieniu każdy z rodzajów komórek dorosłej ryby – melanofory, ksantofory i irydofory – są już obecne. Badania z użyciem zmutowanych ryb pokazały, że czynniki transkrypcyjne, jak kit, sox10 czy mitf, grają ważną rolę w kontroli różnicowania się chromatoforów[34]. Przy wadliwej funkcji białek kodowanych przez te geny chromatofory mogą być miejscowo bądź całkowicie nieobecne, co skutkuje leucyzmem. Za przykład może stanowić nieprawidłowa forma białka kodowanego przez gen kit u świni domowej, powodująca dominującą barwę białą[35], jak też zespół Waardenburga typu 2 związany z nieprawidłowym microphthalmia-associated transcription factor, przebiegający oprócz braku komórek barwnikowych z mikroftalmią i głuchotą[36].
Zastosowania praktyczne
[edytuj | edytuj kod]Poza badaniami podstawowymi zmierzającymi ku lepszemu poznaniu chromtoforów komórki te bywały używane do różnych celów. Przykładowo larwy danio pręgowanego wykorzystuje się w badaniach nad organizacją chromatoforów i ich komunikacją, w której efekcie powstają dokładnie poziome pasy obserwowane u dorosłej ryby[37]. Wydaje się to użytecznym modelem zwierzęcym dla zrozumienia tworzenia się wzorców na polu ewolucyjnej biologii rozwoju. Biologia chromatoforów wykorzystywana jest także do modelowania stanu bądź chorób ludzkich, w tym czerniaka czy albinizmu. Niedawno zbadano gen odpowiedzialny za złoty pasek danio pręgowanego, Slc24a5, ludzki odpowiednik, którego silnie koreluje z kolorem skóry[38].
Chromatofory służą również jako biomarker ślepoty u gatunków zimnokrwistych, jako że zwierzęta wykazujące pewne zaburzenia widzenia nie potrafią zaadaptować się do jasnego otoczenia[33]. Ludzkie homologi receptorów mediujących translokację pigmentu melanoforów wskazuje się jako zaangażowane w procesy takie jak supresja apetytu czy opalanie się, co czyni z nich atrakcyjne targety molekularne leków[27]. Tak więc firmy farmaceutyczne stworzyły metody szybkiej identyfikacji bioaktywnych związków z użyciem melanoforów platany szponiastej[39]. Inni uczeni stworzyli techniki wykorzystujące melanofory jako bioczujniki[40] i dla szybkiej detekcji chorób, bazujące na odkryciu, że toksyna krztuścowa blokuje agregację barwnika w melanoforach rybich[41]. Proponowano również potencjalne zastosowania militarne bazującej na chromatoforach zmiany barwy, głównie jako rodzaj aktywnego kamuflażu, a nawet niewidzialności[42][43].
Chromatofory głowonogów
[edytuj | edytuj kod]
Płaszczoobrosłe głowonogi posiadają złożone, wielokomórkowe narządy wykorzystywane do szybkiej zmiany barwy. Najlepiej widać to na przykładzie jasno zabarwionych kałamarnic, mątw i ośmiornic. Każda jednostka chromatoforów złożona jest z pojedynczej komórki chromatoforu i licznych mięśni, nerwów, gleju i komórek osłonki[44].
Ośmiornice potrafią angażować chromatofory w złożone, falujące pokazy barwne z wieloma szybko zmieniającymi się kolorami. Neurony zawiadujące chromatoforami leżą głównie w zwoju podprzełykowym. Wzorzec zmiany barwy wynika ze wzorca potencjału czynnościowego, a rozlokowanie dróg przewodzenia impulsów odpowiada rozlokowaniu chromatoforów. Może to wyjaśnić, czemu zmiana koloru przebiega falowo, jako że neurony ulegają aktywacji jeden po drugim[45].
Przypisy
[edytuj | edytuj kod]- ↑ Scott M. Boback & Lynn M. Siefferman. Variation in Color and Color Change in Island and Mainland Boas (Boa constrictor). „Journal of Herpetology”. 44 (4), s. 506–515, 2010. DOI: 10.1670/09-026.1.
- ↑ Chromatofory. [w:] Słownik terminów biologicznych [on-line]. pwn.pl. [dostęp 2014-07-19]. [zarchiwizowane z tego adresu (2009-11-03)]. (pol.).
- ↑ Arystoteles. Historia Animalium. IX, 622a: 2-10. Ok. 400 p.n.e. za: Luciana Borrelli, Francesca Gherardi, Graziano Fiorito. A catalogue of body patterning in Cephalopoda. Firenze University Press, 2006. Abstract Google books
- ↑ Sangiovanni G. Descrizione di un particolare sistema di organi cromoforo espansivo-dermoideo e dei fenomeni che esso produce, scoperto nei molluschi cefaloso. G. Enciclopedico Napoli. 1819; 9:1–13
- ↑ Chapter 1. Habits of a Sea-slug and Cuttle-fish.. W: Darwin, Charles: Journal Of Researches Into The Natural History And Geology Of The Countries Visited During The Voyage Round The World Of H.M.S. 'Beagle' Under The Command Of Captain Fitz Roy, R.N.. John Murray, London, 1860, s. 7.
- ↑ a b JT Bagnara, Cytology and cytophysiology of non-melanophore pigment cells, „International Review of Cytology”, 20, 1966, s. 173–205, DOI: 10.1016/S0074-7696(08)60801-3, ISBN 978-0-12-364320-9, PMID: 5337298.
- ↑ Fox, DL. Animal Biochromes and Structural Colors: Physical, Chemical, Distributional & Physiological Features of Colored Bodies in the Animal World. University of California Press, Berkeley, 1976. ISBN 0-520-02347-1 s. 3-5
- ↑ Fox, DL. Animal Biochromes and Structural Colors: Physical, Chemical, Distributional & Physiological Features of Colored Bodies in the Animal World. University of California Press, Berkeley, 1976. ISBN 0-520-02347-1 s. 10-11
- ↑ J Matsumoto. Studies on fine structure and cytochemical properties of erythrophores in swordtail, Xiphophorus helleri, with special reference to their pigment granules (pterinosomes). „J Cell Biol”. 27 (3), s. 493–504, 1965. DOI: 10.1083/jcb.27.3.493. PMID: 5885426. PMCID: PMC2106771.
- ↑ Bagnara JT. Comparative Anatomy and Physiology of Pigment Cells in Nonmammalian Tissues. W: The Pigmentary System: Physiology and Pathophysiology, Oxford University Press, 1998. ISBN 0-19-509861-7
- ↑ JD. Taylor. The effects of intermedin on the ultrastructure of amphibian iridophores. „Gen Comp Endocrinol”. 12 (3), s. 405–16, 1969. DOI: 10.1016/0016-6480(69)90157-9. PMID: 5769930.
- ↑ RL. Morrison. A transmission electron microscopic (TEM) method for determining structural colors reflected by lizard iridophores. „Pigment Cell Res”. 8 (1), s. 28–36, 1995. DOI: 10.1111/j.1600-0749.1995.tb00771.x. PMID: 7792252.
- ↑ a b c d R. Fujii. The regulation of motile activity in fish chromatophores. „Pigment Cell Res”. 13 (5), s. 300–19, 2000. DOI: 10.1034/j.1600-0749.2000.130502.x. PMID: 11041206.
- ↑ S Ito, K. Wakamatsu. Quantitative analysis of eumelanin and pheomelanin in humans, mice, and other animals: a comparative review. „Pigment Cell Res”. 16 (5), s. 523–31, 2003. DOI: 10.1034/j.1600-0749.2003.00072.x. PMID: 12950732.
- ↑ J.T. Bagnara, JD Taylor, G Prota. Color changes, unusual melanosomes, and a new pigment from leaf frogs. „Science”. 182 (4116), s. 1034–5, 1973. DOI: 10.1126/science.182.4116.1034. PMID: 4748673.
- ↑ J.T. Bagnara. Enigmas of Pterorhodin, a Red Melanosomal Pigment of Tree Frogs. „Pigment Cell Research”. 16 (5), s. 510–516, 2003. DOI: 10.1034/j.1600-0749.2003.00075.x. PMID: 12950730.
- ↑ PA Schwalm, PH Starrett, RW McDiarmid. Infrared reflectance in leaf-sitting neotropical frogs. „Science”. 196 (4295), s. 1225–7, 1977. DOI: 10.1126/science.860137. PMID: 860137.
- ↑ Goda M, Ohata M, Ikoma H, Fujiyoshi Y, Sugimoto M, Fujii R. Integumental reddish-violet coloration owing to novel dichromatic chromatophores in the teleost fish, Pseudochromis diadema. „Pigment Cell Melanoma Res”. 24 (4), s. 614–7, 2011. DOI: 10.1111/j.1755-148X.2011.00861.x. PMID: 21501419.
- ↑ JT Bagnara, JD Taylor, ME Hadley. The dermal chromatophore unit. „The Journal of Cell Biology”. 38 (1), s. 67–79, 1968. DOI: 10.1083/jcb.38.1.67. PMID: 5691979. PMCID: PMC2107474.
- ↑ RE Palazzo, TJ Lynch, SJ Lo, JD Taylor i inni. Rearrangements of pterinosomes and cytoskeleton accompanying pigment dispersion in goldfish xanthophores. „Cell Motil Cytoskeleton”. 13 (1), s. 9–20, 1989. DOI: 10.1002/cm.970130103. PMID: 2543509.
- ↑ MG Porras, A De Loof, M Breuer, H Aréchiga. Procambarus clarkii. „Peptides”. 24 (10), s. 1581–9, 2003. DOI: 10.1016/j.peptides.2003.08.016. PMID: 14706537.
- ↑ SW Deacon, AS Serpinskaya, PS Vaughan, M Lopez Fanarraga i inni. Dynactin is required for bidirectional organelle transport. „The Journal of Cell Biology”. 160 (3), s. 297–301, 2003. DOI: 10.1083/jcb.200210066. PMID: 12551954. PMCID: PMC2172679.
- ↑ S Aspengren, HN Sköld, G Quiroga, L Mårtensson i inni. Noradrenaline- and melatonin-mediated regulation of pigment aggregation in fish melanophores. „Pigment Cell Res”. 16 (1), s. 59–64, 2003. DOI: 10.1034/j.1600-0749.2003.00003.x. PMID: 12519126.
- ↑ a b D. W. Logan, S. F. Burn, I. J. Jackson. Regulation of pigmentation in zebrafish melanophores. „Pigment Cell Research”. 19 (3), s. 206–213, 2006. DOI: 10.1111/j.1600-0749.2006.00307.x. PMID: 16704454.
- ↑ DW Logan, RJ Bryson-Richardson, MS Taylor, P Currie i inni. Sequence characterization of teleost fish melanocortin receptors. „Ann N Y Acad Sci”. 994, s. 319–30, 2003. DOI: 10.1111/j.1749-6632.2003.tb03196.x. PMID: 12851332.
- ↑ D Sugden, K Davidson, KA Hough, MT Teh. Melatonin, melatonin receptors and melanophores: a moving story. „Pigment Cell Res”. 17 (5), s. 454–60, 2004. DOI: 10.1111/j.1600-0749.2004.00185.x. PMID: 15357831.
- ↑ a b DW Logan, RJ Bryson-Richardson, KE Pagán, MS Taylor i inni. The structure and evolution of the melanocortin and MCH receptors in fish and mammals. „Genomics”. 81 (2), s. 184–91, 2003. DOI: 10.1016/S0888-7543(02)00037-X. PMID: 12620396.
- ↑ P Valverde, E Healy, I Jackson, JL Rees i inni. Variants of the melanocyte-stimulating hormone receptor gene are associated with red hair and fair skin in humans. „Nat Genet”. 11 (3), s. 328–30, 1995. DOI: 10.1038/ng1195-328. PMID: 7581459.
- ↑ J. Richardson, P.R. Lundegaard, N.L. Reynolds, J.R. Dorin i inni. mc1r Pathway regulation of zebrafish melanosome dispersion. „Zebrafish”. 5 (4), s. 289–95, 2008. DOI: 10.1089/zeb.2008.0541. PMID: 19133827.
- ↑ J. Snider, F. Lin, N. Zahedi, V. Rodionov i inni. Intracellular actin-based transport: How far you go depends on how often you switch. „Proceedings of the National Academy of Sciences of the United States of America”. 101 (36), s. 13204–9, 2004. DOI: 10.1073/pnas.0403092101. PMID: 15331778. PMCID: PMC516548.
- ↑ VI Rodionov, AJ Hope, TM Svitkina, GG Borisy. Functional coordination of microtubule-based and actin-based motility in melanophores. „Current biology : CB”. 8 (3), s. 165–8, 1998. DOI: 10.1016/S0960-9822(98)70064-8. PMID: 9443917.
- ↑ AS Kashina, IV Semenova, PA Ivanov, ES Potekhina i inni. Protein kinase A, which regulates intracellular transport, forms complexes with molecular motors on organelles. „Current biology : CB”. 14 (20), s. 1877–81, 2004. DOI: 10.1016/j.cub.2004.10.003. PMID: 15498498.
- ↑ a b SC. Neuhauss. Behavioral genetic approaches to visual system development and function in zebrafish. „J Neurobiol”. 54 (1), s. 148–60, 2003. DOI: 10.1002/neu.10165. PMID: 12486702.
- ↑ R.N. Kelsh, B. Schmid, J.S. Eisen. Genetic analysis of melanophore development in zebrafish embryos. „Dev Biol”. 225 (2), s. 277–93, 2000. DOI: 10.1006/dbio.2000.9840. PMID: 10985850.
- ↑ OMIA 000209-9823 : Coat colour, dominant white in Sus scrofa. [w:] OMIA – Online Mendelian Inheritance in Animals [on-line]. University of Sydney. [dostęp 2018-10-18]. (ang.).
- ↑ Ichiro Yajima, Shigeru Sato, Takaharu Kimura, Ken-ichi Yasumoto, Shigeki Shibahara, Colin R. Goding & Hiroaki Yamamoto. An L1 Element Intronic Insertion in the Black-Eyed White (Mitfmi-bw) Gene: The Loss of a Single Mitf Isoform Responsible for the Pigmentary Defect and Inner Ear Deafness. „Human Molecular genetics”. 8 (8), s. 1431-1441, 1999. Oxford Journals. DOI: 10.1093/hmg/8.8.1431. (ang.).
- ↑ RN Kelsh. Genetics and evolution of pigment patterns in fish. „Pigment cell research / sponsored by the European Society for Pigment Cell Research and the International Pigment Cell Society”. 17 (4), s. 326–36, 2004. DOI: 10.1111/j.1600-0749.2004.00174.x. PMID: 15250934.
- ↑ RL Lamason, MA Mohideen, JR Mest, AC Wong i inni. SLC24A5, a putative cation exchanger, affects pigmentation in zebrafish and humans. „Science”. 310 (5755), s. 1782–6, 2005. DOI: 10.1126/science.1116238. PMID: 16357253.
- ↑ CK Jayawickreme, H Sauls, N Bolio, J Ruan i inni. Use of a cell-based, lawn format assay to rapidly screen a 442,368 bead-based peptide library. „J Pharmacol Toxicol Methods”. 42 (4), s. 189–97, 1999. DOI: 10.1016/S1056-8719(00)00083-6. PMID: 11033434.
- ↑ T.P. Andersson, D. Filippini, A. Suska, T.L. Johansson i inni. Frog melanophores cultured on fluorescent microbeads: biomimic-based biosensing. „Biosens Bioelectron”. 21 (1), s. 111–20, 2005. DOI: 10.1016/j.bios.2004.08.043. PMID: 15967358.
- ↑ J.O. Karlsson, R.G. Andersson, P. Askelöf, H. Elwing i inni. The melanophore aggregating response of isolated fish scales: a very rapid and sensitive diagnosis of whooping cough. „FEMS Microbiol Lett”. 66 (2), s. 169–75, 1991. PMID: 1936946.
- ↑ Dave Hansford, Cuttlefish Change Color, Shape-Shift to Elude Predators, Wellington, New Zealand: National Geographic News, 2008 [zarchiwizowane z adresu 2013-01-29], Cytat: [...] cuttlefish have instead relied on invisibility, a talent that may have applications for human technology. Norman said the military has shown interest in cuttlefish camouflage with a view to one day incorporating similar mechanisms in soldiers' uniforms..
- ↑ I. Lee, Nanotubes for noisy signal processing, „PhD Thesis”, University of Southern California, 2005, ISBN 978-0-542-20415-9, Bibcode: 2005PhDT.......105L.
- ↑ RA Cloney, E Florey. Ultrastructure of cephalopod chromatophore organs. „Zeitschrift fur Zellforschung und mikroskopische Anatomie (Vienna, Austria : 1948)”. 89 (2), s. 250–80, 1968. DOI: 10.1007/BF00347297. PMID: 5700268.
- ↑ LS Demski. Chromatophore systems in teleosts and cephalopods: a levels oriented analysis of convergent systems. „Brain, behavior and evolution”. 40 (2–3), s. 141–56, 1992. DOI: 10.1159/000113909. PMID: 1422807.


 French
French Deutsch
Deutsch