Immunoglobuliny A – Wikipedia, wolna encyklopedia

1. łańcuch H
2. łańcuch L
3. łańcuch J
4. fragment wydzielniczy
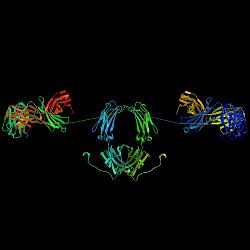
Immunoglobuliny A, IgA – klasa immunoglobulin, która charakteryzuje się w swojej budowie obecnością łańcucha ciężkiego α.
Budowa
[edytuj | edytuj kod]Wzór domenowy łańcucha α to: VH + CH1 + region zawiasowy + CH2 + CH3 + ogon (zob. budowa przeciwciał).
We krwi IgA występuje przede wszystkim (80–95%) w postaci monomerycznej[1], a wydzielana na powierzchnię błon śluzowych, nazywana wydzielniczą immunoglobuliną A (SIgA), w postaci dimerycznej (rzadziej trimerycznej lub tetramerycznej).
Główna rola fizjologiczna IgA polega na udziale w reakcjach immunologicznych i odpornościowych w obrębie błon śluzowych.
Ilość IgA syntetyzowanej w organizmie człowieka w ciągu doby jest większa niż wszystkich pozostałych immunoglobulin razem wziętych. Mimo że, stężenie tej immunoglobuliny w osoczu krwi jest niewielkie, zdecydowana jej większość wydzielana jest na powierzchni błon śluzowych i surowiczych[1].
W IgA występują dwa izotypy:
- dominująca w osoczu podklasa IgA1, zazwyczaj obecna pod postacią monomerów, ale także dimerów, trimerów czy nawet tetramerów. Immunoglobuliny tej podklasy mają wydłużony region zawiasowy, zbudowany z 20 reszt aminokwasowych.
- dominująca w przewodzie pokarmowym podklasa IgA2, to w większości formy dimeryczne, wydzielane na powierzchnię błon śluzowych. Immunoglobuliny tej podklasy mają skrócony region zawiasowy, zbudowany z tylko 7 reszt aminokwasowych, co czyni je bardziej odpornymi na trawienie przez proteazy. IgA2 nie są degradowane przez enzymy trawienne w jelicie, ani przez proteazy bakteryjne i w związku z tym lepiej spełniają swą obronną funkcję.
Wydzielnicza forma immunoglobuliny A powstaje w wyniku współdziałania lokalnie występujących plazmocytów i szczególnej formy receptora dla fragmentu Fc tego przeciwciała – receptor dla polimerycznych form immunoglobulin (pIgR). Polimeryczne przeciwciała połączone za pomocą polipeptydowego łańcucha J, wiążącego części ogonowe IgA, są wydzielane na powierzchnię błon śluzowych ze specyficznym dla tych przeciwciał fragmentem wydzielniczym (SC). SC i pIgR uczestniczą w specjalnym procesie transportu IgA, transcytozie, z podstawnej i bocznej powierzchni komórek nabłonkowych na powierzchnię błon śluzowych[1]. IgA wydzielnicze znajduje się w wielu wydzielinach surowiczych i śluzowych, na przykład w: ślinie, łzach, treści jelita, drogach moczowo-płciowych i oddechowych.
Funkcja immunoglobulin A
[edytuj | edytuj kod]Immunoglobulina A jest najważniejszą i dominującą nad innymi klasami immunoglobulin w wydzielinie śluzowo-surowiczej nosa, gardła, zatok obocznych nosa, oskrzeli, jelit, dróg moczowo-płciowych oraz w siarze, ślinie, łzach. W samej tylko błonie śluzowej przewodu pokarmowego produkowane jest w ciągu doby 3–6 g immunoglobuliny A[2] Jest jednym z podstawowych humoralnych mechanizmów odpornościowych.
IgA odgrywa rolę w mechanizmach odpornościowych w obrębie błon śluzowych:
- przewodu pokarmowego (układ GALT)
- dróg oddechowych
- układu moczowo-płciowego
IgA wydzielnicza wykazuje następujące działania:
- hamowanie adhezji komórek bakteryjnych do powierzchni błony śluzowej
- zdolność do aglutynacji komórek bakteryjnych
- adsorpcja antygenów pokarmowych
- neutralizacja wirusów, toksyn i enzymów wytwarzanych przez różne drobnoustroje
Produkcja IgA w błonie śluzowej wynosi u człowieka 40–60 mg/kg/dobę i ilościowo przekracza łączną produkcję wszystkich pozostałych klas immunoglobulin[1][3][4]. Stężenie IgA w krwi i wydzielinie błon śluzowych wzrasta stopniowo z wiekiem i dopiero po 12 roku życia osiąga poziom porównywalny z osobami dorosłymi[5].
Immunoglobulina A przeciwdziała kolonizacji błon śluzowych przez drobnoustroje chorobotwórcze.
Immunoglobulina A ułatwia niektórym gatunkom bakterii, np. Bacteroides fragilis, który jest składnikiem fizjologicznej mikrobioty ssaków, zasiedlanie śluzu wyściełającego błonę śluzową jelit[6].
Zobacz też
[edytuj | edytuj kod]Przypisy
[edytuj | edytuj kod]- ↑ a b c d J. Gołąb, M. Jakóbisiak, M. Lasek: Immunologia. Warszawa: Wydawnictwo Naukowe PWN, 2002, s. 10. ISBN 978-83-01-17108-7.
- ↑ Fagarasan S, Honjo T Intestinal IgA synthesis: regulation of front-line body defences. Nat Rev Immunol. 2003;3:63–72.
- ↑ Brandtzaeg P., Farstad IN., Haraldsen G. Regional specialization in the mucosal immune system: primed cells do not always home along the same track. „Immunol Today”. 6 (20), s. 267–277, czerwiec 1999. PMID: 10354552.
- ↑ van Egmond M., Damen CA., van Spriel AB., Vidarsson G., van Garderen E., van de Winkel JG. IgA and the IgA Fc receptor. „Trends Immunol”. 4 (22), s. 205–211, kwiecień 2001. PMID: 11274926.
- ↑ Wolska-Kuśnierz B, Gregorek H, Zapaśnik A i wsp. Wartości referencyjne stężeń immunoglobulin G, A, M i D w surowicy zdrowych dzieci i osób dorosłych, mieszkańców województwa mazowieckiego. Standardy Med. 2010;7(3):524-532.
- ↑ G.P. Donaldson i inni, Gut microbiota utilize immunoglobulin A for mucosal colonization, „Science”, 2018, eaaq0926, DOI: 10.1126/science.aaq0926 (ang.).


 French
French Deutsch
Deutsch