Mnemiopsis leidyi – Wikipedia, wolna encyklopedia
| Mnemiopsis leidyi | |||
| A. Agassiz, 1865[1] | |||
 M. leidyi w wodach Oslofiordu. | |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Gromada | |||
| Rząd | |||
| Rodzina | |||
| Rodzaj | Mnemiopsis | ||
| Gatunek | Mnemiopsis leidyi | ||
| Synonimy | |||
| |||
| Zasięg występowania | |||
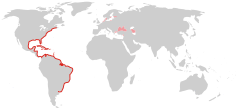 Zasięg występowania M. leidyi – kolorem czerwonym zaznaczono obszar pierwotnego występowania, różowym – akweny skolonizowane w wyniku zawleczenia. | |||
Mnemiopsis leidyi – gatunek żebropława, jedyny znany gatunek monotypowego rodzaju Mnemiopsis, występujący pierwotnie w przybrzeżnych wodach zachodniego Atlantyku. Od lat 80. XX w. rozprzestrzenia się w innych akwenach świata. Obojnak zdolny do samozapłodnienia. Posiada lucyferazę, jest zdolny do bioluminescencji. Wykazuje duże zdolności do regeneracji utraconych części ciała. Drapieżnik o dużej plastyczności fenotypowej, jego inwazje doprowadziły do katastrof ekologicznych w ekosystemach Morza Czarnego i Morza Kaspijskiego. Zawleczony do Bałtyku, występuje m.in. w wodach Zatoki Gdańskiej.
Taksonomia
[edytuj | edytuj kod]Gatunek należy do rodziny Bolinopsidae w rzędzie Lobata, gromadzie żebropławów ramieniowych (Tentaculata)[2]. Opisał go Alexander Agassiz na podstawie osobników schwytanych w Buzzards Bay koło wyspy Naushon (na południowy zachód od Cape Cod). Agassiz włączył ten gatunek do ustanowionego przez swojego ojca, Louisa Agassiza, rodzaju Mnemiopsis[1], nazwanego tak ze względu na podobieństwo do żebropławów z rodzaju Mnemia[3]. Według autora od gatunku M. gardeni, opisanego przez L. Agassiza, różnił się jedynie dłuższymi płatami gębowymi. W ramach rodzaju Mnemiopsis wyróżniano, oprócz M. leidyi i M. gardeni, jeszcze jeden gatunek – M. mccradyi. Obecnie jednak uważa się, że te trzy gatunki to w istocie formy ekologiczne jednego gatunku, przejawiającego duży polimorfizm fenotypowy, któremu przypisuje się nazwę M. leidyi[4][5].
Cechy morfologiczne
[edytuj | edytuj kod]

Ciało owalne, lekko spłaszczone, długości: 7–12 cm, średnicy: 2,5–5 cm. Korpus przedłużają płaty gębowe: obok dwóch głównych występują cztery mniejsze, z wiciami na obrzeżach, w trakcie ruchu płaty zamykają całkowicie otwór gębowy. Wargi szczeliny gębowej kurczliwe, w środkowej części z fałdem ciągnącym się do końcowej części kanału gardłowego. Dookoła zewnętrznego krańca warg przebiegają cztery kanały utworzone z końców kanału gardłowego[6]. Aparat czułkowy ulokowany nad wargami gębowymi. Wzdłuż boków ciała ciągną się cztery bruzdy, utworzone z kępek rzęsek, uchodzące do warg gębowych – służących do chwytania zdobyczy[4]. Zwierzę porusza się dzięki uderzeniom rzęsek znajdujących się na jego powierzchni. Ciało przezroczyste[1][7].
Organizm zdolny do bioluminescencji. Światło produkują wyspecjalizowane komórki (fotocyty), rozłożone nierównomiernie wzdłuż bruzd, pomiędzy komórkami z rzęskami a komórkami jamy gastralnej, i zawierające lucyferazę[8][9]. Specyficzna dla żebropławów forma lucyferyny – mnemiopsyna – została wyizolowana i opisana po raz pierwszy właśnie u tego gatunku. Dyfrakcja produkowanego przez fotofory światła na rzęskach bruzd daje efekt iryzacji. Światło jest emitowane przez fotocyty po ich stymulacji przez bodziec zewnętrzny lub wewnętrzny[10]. Fale pobudzenia luminescencji mogą rozchodzić się w obydwu kierunkach od miejsca stymulacji w rzędach fotocytów. Zdolność do produkcji światła zaobserwowano już u najwcześniejszych stadiów rozwojowych tego żebropława. W odróżnieniu od fotoprotein krążkopławów kompleks produkujący światło u żebropławów, w tym u Mnemiopsis, ulega fotoinhibicji pod wpływem światła słonecznego. Kompleks fotoprotein tego krążkopława nie tylko produkuje światło, ale również odbiera bodźce świetlne i bierze udział w przekazywaniu sygnału do układu nerwowego[9].
Na końcu apikalnym ciała (po stronie przeciwnej do otworu gębowego) znajduje się statocysta, płaty gębowe sięgają aż do wysokości statocysty. Gonady (obojnacze) ułożone wzdłuż kanałów układu trawiennego: rzędy spermatoforów znajdują się naprzeciwko rzędów jajników. Gatunek wykazuje bardzo duży polimorfizm fenotypowy[11].
Występowanie
[edytuj | edytuj kod]Pierwotnie wzdłuż atlantyckich wybrzeży Ameryk: od 42°N do 46°S. Występuje w płytkich wodach przybrzeżnych, zatokach, estuariach, na głębokości od 2 do 30 m, zwykle ponad termokliną, w strefach zasobnych w zooplankton (11–200 mg węgla organicznego/m3), który stanowi jego pokarm. Populacje osiągają przeciętne zagęszczenia do 12 osobników na m3 [12][13][14].
Ekspansja
[edytuj | edytuj kod]W latach 80. XX w. został zawleczony z wodą balastową przez statki zawijające do portów Morza Czarnego, gdzie wkrótce stał się gatunkiem dominującym w pelagialu[15]. Zagęszczenie osobników M. leidyi w tym akwenie osiągnęło w szczytowym momencie inwazji w 1988 r. ponad 400 osobników/m3, (średnio 304 osobniki/m3 w strefie otwartego morza), a biomasa lokalnie osiągała do 2 kg/m3[16][14] – według relacji świadków morze zamieniło się w „galaretowatą breję”[17], ale wkrótce ich liczebność zmalała, ponieważ żebropławy te wyjadły w krótkim czasie większość zooplanktonu, stanowiącego ich pokarm[18]. Całkowitą biomasę M.leidyi w M. Czarnym w szczytowym momencie rozrostu populacji w 1989 roku oszacowano na około 840 mln ton[16].
W roku 1999 gatunek został zawleczony do Morza Kaspijskiego[19][20], wkrótce też przedostał się przez Morze Marmara[21] na Morze Śródziemne[22] i do Morza Azowskiego[23]. W 2006 stwierdzono jego obecność w Morzu Północnym[7] i w Cieśninach Duńskich oraz w Bałtyku[24][25][26]. Zagęszczenie populacji w Bałtyku i Morzu Północnym nie przekracza 100 osobników /m³[26], ale gatunek dalej rozprzestrzenia się w tych akwenach – w 2007 roku stwierdzono jego obecność w Zatoce Puckiej[27], przy wybrzeżach Gotlandii i w Zatoce Ryskiej[26][28].
Biologia i ekologia
[edytuj | edytuj kod]Zajmowane siedliska
[edytuj | edytuj kod]Jest organizmem eurytopowym, eurytermicznym – toleruje temperatury od 0 do 32 °C z optimum termicznym ok. 20 °C, euryhalinowym – toleruje zasolenie w granicach 5–38 g/l[12][14]. Znosi niską (0,2–0,3 mg/l) zawartość tlenu w wodzie[14]. Swobodnie unosi się w toni wodnej, prądy wodne mogą przenosić go na duże odległości. Nie podejmuje dobowych migracji pionowych, choć nocą częściej przebywa przy powierzchni[14]. Według jednej z prac naukowych młodociane osobniki mogą podejmować migracje pionowe o stosunkowo niewielkiej amplitudzie, w celu uniknięcia zbyt mocnego nasłonecznienia[29].
Odżywianie
[edytuj | edytuj kod]Drapieżnik, aktywnie poluje na ofiary, pływając z otworem gębowym skierowanym do przodu. Wykorzystuje rzędy rzęsek (cilia) do generowania ciągłego przepływu, który kieruje duże objętości wody wraz z przebywającymi w niej organizmami planktonowymi wokół płatów czułków (tentillae), gęsto pokrytych kolloblastami, do których przyklejają się ofiary. Mechanizm ten jest bardzo wydajny – niemal 100% potencjalnych ofiar jest przechwytywanych z tego strumienia. Ponadto stosunkowo niewielka prędkość generowanego przepływu i jego laminarny charakter powodują, że potencjalne ofiary nie są w stanie na podstawie mechanorecepcji wykryć zagrożenia. Dlatego M.leydyi jest w stanie bez problemów polować nawet na duże widłonogi (Copepoda), dysponujące efektywnymi mechanizmami wykrywania zaburzeń ruchu wody, generowanych przez zbliżającego się drapieżnika, i bardzo dużą prędkością ucieczki[30]. Taka taktyka polowania (ang. stealth) uważana jest za jedną z przyczyn ekologicznego sukcesu tego żebropława[30]. Żeruje on całą dobę, prędkość przemieszczania się polującego osobnika wynosi od 0,2 do 1,2 cm/s[31]. W skład pokarmu wchodzą: małe organizmy planktonowe (głównie skorupiaki: widłonogi i wioślarki, ale także równonogi i przedstawiciele rzędu Cumacea), jaja i larwy bezkręgowców unoszące się w pelagialu, ikra ryb i narybek[32][33][34][35]. Średnia wielkość cząstek pokarmu wchodzących w skład jego diety wynosi od 0,75 do 1 mm[36], maksymalna: 2–3,5 mm[31][36][37].
Rozmnażanie
[edytuj | edytuj kod]Obojnak, zdolny do samozapłodnienia – jeden osobnik może stać się założycielem nowej populacji[38][39]. Dojrzałość płciową osiąga przy wymiarach ciała powyżej 26 mm, stwierdzono jednak także przypadki pedogenezy – osiągania dojrzałości płciowej przez larwy i osobniki młodociane, o długości ciała mniejszej niż 12 mm[38][39]. Liczba wytwarzanych jednocześnie jaj zależy od dostępności pokarmu i temperatury, jeden duży osobnik może wyprodukować 2–14 tys. jaj. Rozród wykazuje cykl dobowy: uwalnianie jaj i spermy następuje wieczorem, z maksimum około północy, zapłodnienie jest zewnętrzne[38][12]. Jaja po uwolnieniu pęcznieją w kontakcie z wodą morską. Rozwój złożony, z larwą wolnopływającą[12].
Osobniki M. leidyi wykazują dużą zdolność do regeneracji uszkodzonych części ciała, odbudowują ubytki nawet wtedy, gdy utracą 75% ciała[40][41].
Genetyka
[edytuj | edytuj kod]Genom M. leydyi został zsekwencjonowany, jego wielkość określono na 150 Mbp, zidentyfikowano w nim 16548 genów[42][43]. Analizy filogenetyczne z użyciem sekwencji genowych tego żebropława wykazały, że to żebropławy właśnie, a nie gąbki, jak dotychczas przypuszczano, są taksonem siostrzanym dla wszystkich pozostałych zwierząt – jako pierwsze oddzieliły się od linii ewolucyjnej, która dała później początek pozostałym typom zwierząt[42][44]. Z analiz tych wynika, że komórki mezodermalne żebropławów nie są homologiczne do tych występujących u trójwarstwowców, okazuje się natomiast, że u Ctenophora, Porifera i Placozoa występują geny homologiczne do genów odpowiedzialnych za rozwój i funkcjonowanie układu nerwowego u Bilateria[44]. Mitochondrialny DNA M. leidyi ma wielkość 10 kbp, co stawia go wśród najmniejszych spośród znanych cząsteczek mitochondrialnego DNA zwierząt. Genom mitochondrialny tego gatunku utracił wiele genów (m.in. wszystkie mitochondrialne kopie genów tRNA, gen atp6 został przeniesiony do genomu jądrowego)[45]. Drugorzędowa struktura mitochondrialnego rRNA jest uproszczona w porównaniu do odpowiednich cząsteczek rRNA u innych zwierząt. W genomie M. leidyi nie stwierdzono obecności mikroRNA ani genów białek jądrowych Drosha i Pasha, związanych z syntezą mikroRNA. Pod tym względem żebropławy wykazują podobieństwo do Placozoa, nie wiadomo jednak, czy jest to cecha pierwotna, czy też geny te zostały utracone[46].
Interakcje międzygatunkowe
[edytuj | edytuj kod]Wchodzi w skład diety niektórych ptaków i ryb (Peprilus alepidotus, Peprilus triacanthus), jednak jedynymi drapieżnikami mogącymi regulować jego liczebność są duże żebropławy i scyfomeduzy. Żebropław Beroe ovata, choć odżywia się także innymi meduzami i żebropławami, może żerować prawie wyłącznie na M. leidyi, co jest wykorzystywane w walce z niekontrolowanym wzrostem liczebności tego żebropława[12][39].
W Morzu Czarnym okazał się sprawniejszym konkurentem w zdobywaniu pokarmu niż inni zooplanktonożercy, doprowadzając do drastycznej redukcji liczebności (a okresowo do całkowitego wyeliminowania) chełbi (Aurelia aurita) oraz strzałek (Sagitta setosa) z pelagialu[14].
Na osobnikach tego żebropława pasożytują larwy ukwiałów z rodzaju Edwardsiella[47], na płotkach rzęsek rozwijają się gęste zespoły pasożytniczych i komensalicznych pierwotniaków (Trichodina ctenophorii, Protoodinium chattoni)[48]. Przedstawiciele tego żebropława są też żywicielami pośrednimi pasożytniczych nicieni z rodzaju Hysterothylacium[49].
Osobniki tego żebropława po kontakcie z czułkami polujących na nie scyfomeduz Chrysaora quinquecirrha przyśpieszają prędkość pływania o ok. 300–600%, dzięki czemu są w stanie uciec w ok. 97% przypadków. Duże osobniki M. leidyi, nawet jeśli zostaną schwytane przez tę scyfomeduzę, zwykle unikają śmierci kosztem utraty całości lub części płatów gębowych, które potem ulegają regeneracji[41][50].
Znaczenie
[edytuj | edytuj kod]Zawleczenie M. leidyi do Morza Czarnego i do Morza Kaspijskiego było, obok postępującej eutrofizacji, przyczyną ekologicznej katastrofy, która zrujnowała tamtejsze ekosystemy[18][20][51][52]. M. leidyi znalazł w Morzu Czarnym dogodne warunki do rozwoju, co wobec braku żerujących na nim drapieżników doprowadziło do niekontrolowanego wzrostu liczebności jego populacji. M. leidyi stał się gatunkiem dominującym w zooplanktonie tych mórz (i nadal takim pozostaje, choć jego udział zmalał z ponad 90% do 75%), co zmieniło strukturę sieci troficznej i przepływ energii i materii w ekosystemie[53]. Pojawiający się masowo M. leidyi wyjadł zooplankton, będący podstawą diety ważnych gospodarczo gatunków ryb czarnomorskich (śledzi, szprotów, tiulek i sardeli). Spowodowało to drastyczną redukcję pogłowia tych ryb, pogłębioną dodatkowo przez wyjadanie ikry i narybku[54][53]. Straty w rybołówstwie poniesione z tego powodu w końcu lat 80. XX w. oszacowano na 300–400 mln dolarów[17]. Ponieważ żaden autochtoniczny gatunek nie odżywiał się M. leidyi, olbrzymia biomasa zgromadzona w ciałach jego osobników pozostawała niedostępna dla wyższych pięter łańcucha troficznego, ciała obumarłych osobników opadały na dno i, rozkładając się, pogłębiały deficyty tlenowe, eliminując także organizmy bentosowe i przyczyniając się do rozwoju saprofagicznych bakterii[51][16][52]. Sytuacja w Morzu Czarnym ulega nieznacznej poprawie, m.in. dzięki introdukcji drapieżnego żebropława Beroe ovata, występującego w Morzu Śródziemnym, który jest w stanie włączyć M. leidyi do swojej diety. Beroe ovata stał się w Morzu Czarnym monofagiem, odżywiającym się niemal wyłącznie M. leidyi, co przyczyniło się do okresowej redukcji liczebności intruza, jednak nie udało się go całkowicie wyeliminować[55].
Nie wiadomo, jakie będą konsekwencje inwazji M. leidyi w Bałtyku. Wprawdzie niska temperatura i niskie zasolenie Bałtyku nie stanowią przeszkody dla rozprzestrzeniania tego gatunku, jednak pozostają poza zakresem warunków dla niego optymalnych. Tempo reprodukcji w centralnych basenach Bałtyku jest o wiele niższe niż w cieśninach duńskich i południowo-zachodniej części morza, jednak wskutek ruchów mas wody osobniki z tych populacji mogą łatwo przedostawać się do innych części Bałtyku[56]. Obecność M. leidyi odkrywa się w coraz to nowych basenach Bałtyku i okresowo jego zagęszczenia zwiększają się[57]. Naukowcy badający skład taksonomiczny zooplanktonu w oparciu o markery molekularne nie stwierdzili występowania M. leidyi w północnej części Bałtyku i zasugerowali, że niektóre z dotychczasowych doniesień o jego obecności mogą wynikać z błędnego oznaczenia przynależności systematycznej podobnego żebropława – Mertensia ovum[58]).
Podejrzewa się możliwość wyjadania przez M. leidyi narybku i ikry bałtyckiego dorsza oraz szprota[59].
Przypisy
[edytuj | edytuj kod]- ↑ a b c Agassiz A. 1865. North American Acalephae. Illustrated catalog of the Museum of Comparative Zoology; 2. str.: 20–23, Cambridge Univ. Pr., Boston, USA. pp. 234. html.
- ↑ Jacob van der Land: WoRMS taxon details: Mnemiopsis leidyi A. Agassiz, 1865. [w:] World Register of Marine Species [on-line]. 2008-01-04. [dostęp 2014-09-12]. (ang.).
- ↑ Agassiz L. 1860. Contribution of the natural history of the United States of America. Truber & Co. Boston 3: 321. html.
- ↑ a b Seravin L. N. 1994. The systematic revision of the genus Mnemiopsis (Ctenophora, Lobata). Zoologitczeskij Żurnal 73: 9–18.
- ↑ Bayha K.M., McDonald J.H. and Gaffney P.M. 2003. Molecular systematics of the invasive Ctenophore Mnemiopsis sp. University of Delaware. Proceedings of The Third International Conference on Marine Bioinvasions, str. 11.
- ↑ Fewkes J. W. 1881. Studies of the jelly-fish of Narraganset Bay. Bulletin of Museum of Comparative Zoology Vol. 8: 141–182.
- ↑ a b Faasse, Marco A. & Bayha, Keith M. 2006. The ctenophore Mnemiopsis leidyi A. Agassiz 1865 in coastal waters of the Netherlands: an unrecognized invasion?. Aquatic Invasions 1(4): 270–277.
- ↑ Freeman G., Reynolds G. T. 1973. The development of bioluminescence in the ctenophore Mnemiopsis leidyi. Development Biology 31, 1: 61–100
- ↑ a b Schnitzler C.E., Kevin Pang, Meghan L. Powers, Adam M. Reitzel, Joseph F. Ryan, David Simmons, Takashi Tada, Morgan Park, Jyoti Gupta, Shelise Y. Brooks, Robert W. Blakesley, Shozo Yokoyama, Steven H.D. Haddock, Mark Q. Martindale and Andreas D. Baxevanis. 2012. Genomic organization, evolution, and expression of photoprotein and opsin genes in Mnemiopsis leidyi: a new view of ctenophore photocytes. BMC Biology 10: 107 [1].
- ↑ Anctil M. 1985. Cholinergic and monoaminergic mechanisms associated with control of bioluminescence in the ctenophore Mnemiopsis leidyi. J. Exp. Biol. 119: 225–238.
- ↑ Hansson, Hans G. 2006. Ctenophores of the Baltic and adjacent Seas - the invader Mnemiopsis is here! Aquatic Invasions 1(4): 295–298.
- ↑ a b c d e Kremer P.M. 1994. Patterns of abundance for Mnemiopsis in US coastal waters: a comparative overview. ICES Journal of Marine Sciences 51: 347–354.
- ↑ Harbison G. R., Madin L. P., Swanberg N. R. 1978. On the natural history and distribution of oceanic ctenophores. Deep-Sea Research 25: 233–256.
- ↑ a b c d e f Purcell J. E., Shiganova T. A., Decker M. B. Houde E. D. 2001. The ctenophore Mnemiopsis leidyi in native and exotic habitats: U. S. estuaries versus the Black Sea basin. Hydrobiologia 451: 145–176.
- ↑ V. Ye. Zaika, N. G. Sergeyeva. Morphology and development of Mnemiopsis mccradyi (Ctenophora, Lobata) in the Black Sea. „Zoologiczeskij Żurnal”. 69 (2), s. 5–11, 1990.
- ↑ a b c Graham W.M. & Bayha K.M. 2007. Biological invasions by marine jellyfish. W: Biological invasions; ed: Nentwig. Ecological Studies vol. 193, pp. 441. Springer-Verlag, Berlin. Str.240–241.
- ↑ a b Alien Marine Species in Black Sea: Recent Invasions, dostęp: 20 lutego 2013, jęz. ang, jęz. ros.
- ↑ a b Ahmet E. Kideys, Fall and Rise of the Black Sea Ecosystem, „Science”, 297 (5586), 2002, s. 1482–1484, DOI: 10.1126/science.1073002, ISSN 0036-8075, PMID: 12202806 (ang.).
- ↑ Ivanov V.P., Kamakin A.M., Ushivtsev V.B., Shiganova T.A., Zhukova O.P., Aladin N., Wilson S.I., Harbison G.R. & Dumont H.J. 2000. Invasion of the Caspian Sea by the comb jellyfish Mnemiopsis leidyi (Ctenophora). Biological Invasions 2: 255–258.
- ↑ a b Shiganova T. A. Kamakin A. M., Ushivtzev V. B., Zhukova O. 2001. New Invasion of ctenophore Mnemiopsis in the Caspian Sea. Oceanology 41(4): 542–549.
- ↑ Shiganova T.A. 1993. Ctenophore Mnemiopsis leidyi and ichthyoplankton in the Sea of Marmara in October of 1992. Oceanology 33: 900–903
- ↑ Kideys A.E. and Niermann U. 1994. Occurrence of Mnemiopsis along the Turkish coasts (from northeastern Mediterranean to Istanbul). ICES Journal of Marine Science 51: 423–427.
- ↑ Vinogradov M.E., Shushkina E.A., Musayeva E.I., and Sorokin P.Y. 1989. A newly acclimated species in the Black Sea: the ctenophore Mnemiopsis leidyi (Ctenophora: Lobata). Oceanology 29(2): 220–224.
- ↑ Javidpour, Jamileh; Sommer, Ulrich & Shiganova, Tamara A. 2006. First record of Mnemiopsis leidyi A. Agassiz 1865 in the Baltic Sea. Aquatic Invasions 1(4): 299–302.
- ↑ Oliveira, Otto M. P. 2007. The presence of the ctenophore Mnemiopsis leidyi in the Oslofjorden and considerations on the initial invasion pathways to the North and Baltic Seas. Aquatic Invasions 2(3): 185–189.
- ↑ a b c Kube, Sandra; Postel, Lutz; Honnef, Christopher & Augustin, Christina B. 2007. Mnemiopsis leidyi in the Baltic Sea - distribution and overwintering between autumn 2006 and spring 2007. Aquatic Invasions 2: 137–145.
- ↑ Janas U., Zgrundo A. 2007. First records of Mnemiopsis leidyi A. Agassiz, 1865 in the Gulf of Gdansk (southern Baltic Sea). Aquatic Invasions 2(4): 450–454.
- ↑ Lehtiniemi M., Pääkkönen J.-P., Flinkman J., Katajisto T., Gorokhova E., Karjalainen M., Viitasalo S., Björk H. 2007. Distribution and abundance of the American comb jelly (Mnemiopsis leidyi) - A rapid invasion to the northern Baltic Sea during 2007. Aquatic Invasions 4(2): 445–449.
- ↑ Haraldsson M., Båmstedt U., Tiselius P., Titelman J., Aksnes D.L. 2014. Evidence of diel vertical migration in Mnemiopsis leidyi. PlosOne DOI: 10.1371/journal.pone.0086595
- ↑ a b Colin S.P., J.H. Costello, L.J. Hansson, J. Titelmand & J.O. Dabiri. 2010. Stealth predation and the predatory success of the invasive ctenophore Mnemiopsis leidyi. PNAS 107(40): 17223–17227, doi: 10.1073/pnas.1003170107, html.
- ↑ a b Larson R. J. 1988. Feeding and Functional Morphology of the Lobate Ctenophore Mnemiopsis mccradyi. Estuarine, Coastal and Shelf Science 27: 495–502.
- ↑ Nelson Th. C. 1925. On the occurrence and food habitat of ctenophores in New Jersey Island coastal waters. Biological Bulletin 48: 92–111.
- ↑ Main R. J. 1928. Feeding mechanism of Mnemiopsis. Biologial Bulletin 55: 69–78.
- ↑ Tzikhon-Lukanina E. A., Reznichenko O. G., Lukasheva T. A. 1992. What ctenophore Mnemiopsis eats in the Black Sea inshore waters? Oceanology 32: 724–729.
- ↑ Sullivan L.J. 2014. Apparent diel feeding by the ctenophore Mnemiopsis leidyi A. Agassiz 1865 (Ctenophora, Lobata). J. Plankton Res. 36 doi: 10.1093/plankt/fbu047
- ↑ a b Tzikhon-Lukanina E. A., Reznichenko O. G., Lukasheva T. A. 1991b. Quantitative aspects of feeding in the Black Sea ctenophore Mnemiopsis leidyi. Oceanology 31: 272–276.
- ↑ Rowshantabari M., Finenko G.A., Kideys A. E. & Kiabi B. 2012. Effect of temperature on clearance rate, daily ration and digestion time of Mnemiopsis leidyi from the southern Caspian Sea. Caspian J. Env. Sci. 10(2): 157–167. pdf
- ↑ a b c Baker J. D., Reeve M. R. 1974. Laboratory culture of lobate ctenophore Mnemiopsis mccradyi with notes on feeding and fecundity. Marine Biology 31, 1: 61–100.
- ↑ a b c Shiganova T. A., Mirzoyan Z. A., Studenikina E. A., Volovik S. P., Siokoi-Frangou I., Zervoudaki S., Christou E. D., Skirta A. Y., Dumont H. 2001. Population development of the invader ctenophore Mnemiopsis leidyi in the Black Sea and other seas of the Mediterranean basin. Marine Biology 139: 431–445.
- ↑ Coonfield B.R. 1936. Regeneration in Mnemiopsis leidyi, Agassiz. Biological Bulletin 71: 421–428.
- ↑ a b Kreps T. A., Purcell J. E., Heidelberg K. B. 1997. Escape of the ctenophore Mnemiopsis leidyi from the scyphomedusa predator Chrysaora quinquecirrha. Marine Biology 128(3): 441–446. DOI 10.1007/s002270050110
- ↑ a b J.F. Ryan i inni, The Genome of the Ctenophore Mnemiopsis leidyi and Its Implications for Cell Type Evolution, „Science”, 6164, 342, 2013, s. 1242592, DOI: 10.1126/science.1242592.
- ↑ National Human Genome Research Institute: Mnemiopsis Genome Project Portal. 2012. [dostęp 2013-12-13].
- ↑ a b A. Rokas. My Oldest Sister Is a Sea Walnut?. „Science”. 342 (6164), s. 1327–1329, 2013. DOI: 10.1126/science.1248424.
- ↑ W. Pett i inni, Extreme mitochondrial evolution in the ctenophore ''Mnemiopsis leidyi'': Insight from mtDNA and the nuclear genome., „Mitochondrial DNA”, 4, 22, 2011, s. 130–142, DOI: 10.3109/19401736.2011.62461.
- ↑ E.K. Maxwell, J.F. Ryan, C.E. Schnitzler, W.E. Browne i inni. MicroRNAs and essential components of the microRNA processing machinery are not encoded in the genome of the ctenophore Mnemiopsis leidyi. „BMC Genomics”. 13 (1), s. 714, 2012. DOI: 10.1186/1471-2164-13-714. PMID: 23256903. PMCID: PMC3563456.
- ↑ Selander E., Møller L.F., Sundberg P., Tiselius P. 2010. Parasitic anemone infects the invasive ctenophore Mnemiopsis leidyi in the North East Atlantic. Biological Invasions 12(5): 1003–1009, doi: 10.1007/s10530-009-9552-y
- ↑ Moss A.G., Estes A.M., Muellner L.A., Morgan D.D. 2001. Protistan epibionts of the ctenophore Mnemiopsis mccradyi Mayer. Developments in Hydrobiology 155: 295–304.
- ↑ Purcell J. E. & M. N. Arai. 2001. Interactions of pelagic cnidarians and ctenophores with fish: a review. Hydrobiologia 451(1–3): 27–44. DOI 10.1023/A:1011883905394
- ↑ Purcell J.E., Cowan J.H. 1995. Predation by the scyphomedusan Chrysaora quinquecirrha on Mnemiopsis leidyi ctenophores. Marine Ecology-Progress Series 129(1–3): 63–70.
- ↑ a b Shiganova T. A. 1997. Mnemiopsis leidyi abundance in the Black Sea and its impact on the pelagic community. W: Ozsoy E., Mikaelyan A. (ed.), Sensitivity of North Sea, Baltic Sea and Black Sea to Antropogenic and Climatic Changes. Kluwer Academic Publishers, Dordrecht-Boston-London; str: 117–130.
- ↑ a b Mee, L. 2007. Ożywianie martwych stref. Świat Nauki 185(1): 61–67.
- ↑ a b Shiganova T. A., 1998. Invasion of the Black Sea by the ctenophore Mnemiopsis leidyi and recent changes in pelagic community structure. W: Coombs S. (ed.). Fisheries Oceanography - GLOBEC Special Issue, 7: 305–310. pdf
- ↑ Kideys A.E. 1994. Recent dramatic changes in the Black Sea ecosystem: The reason for the sharp decline in Turkish anchovy fisheries. Journal of Marine Systems 5(2): 171–181. DOI: 10.1016/0924-7963(94)90030-2
- ↑ Sziganowa T.A., Musajewa E.I., Bulgakowa I.V., Mirzojan Z.A., Martyniuk M.L. 2003. Izwiestija Akademii Nauk. Seria Biologiczeskaja. Rossijskaja Akademija Nauk 2003(2): 225–235.
- ↑ Jaspers C., Møller L.F., Kiørboe T. 2011. Salinity Gradient of the Baltic Sea Limits the Reproduction and Population Expansion of the Newly Invaded Comb Jelly Mnemiopsis leidyi. PlosOne 6(8): e24065. doi:10.1371/journal.pone.0024065
- ↑ Schaber M., Haslob H., Huwer B., Harjes A., Hinrichsen H-H., Koster F.W., Storr-Paulsen M., Schmidt J.O., Voss R. 2011. The invasive ctenophore Mnemiopsis leidyi in the central Baltic Sea: seasonal phenology and hydrographic influence on spatio-temporal distribution patterns. J. Plankton Res. doi:10.1093/plankt/fbq167
- ↑ Gorokhova E., Lehtiniemi M., Viitasalo-Frösen S., Haddock S.H.D. 2009. Molecular evidence for the occurrence of ctenophore Mertensia ovum in the northern Baltic Sea and implications for the status of the Mnemiopsis leidyi invasion. Limnol. Oceanogr. 54(6): 2025–2033.
- ↑ Haslob H., Clemmesen C., Schaber M., Hinrichsen H.-H., Schmidt J., Voss R., Kraus G. and Köster F. W. 2007. Invading Mnemiopsis leidyi as a potential threat to Baltic fish. Marine Ecology Progress Series, 349: 303–306. DOI 10.3354/meps07283
Linki zewnętrzne
[edytuj | edytuj kod]- Gatunki obce w faunie Polski: Mnemiopsis leidyi. Instytut Ochrony Przyrody PAN, Kraków, Autor: M.M. Sapota, Red: Z. Głowaciński, H. Okarma, J. Pawłowski, W. Solarz.
- Stephan Faris. Jellyfish: A Gelatinous Invasion (ang. Galaretowata inwazja). „Time”, s. 49–50, 2.10.2009.
- M. leidyi w DAISIE. europe-aliens.org. [zarchiwizowane z tego adresu (2014-03-23)]. Delivering Alien Invasive Species Inventories for Europe (baza informacji o gatunkach inwazyjnych w Europie; html; ang.)
- Animales del mundo. Daniel Garcia, Oceanografico del Valencia – nagranie z pływającymi w toni wodnej osobnikami M. leidyi.


 French
French Deutsch
Deutsch