Hidrônio – Wikipédia, a enciclopédia livre
| Hidrônio Alerta sobre risco à saúde | |
|---|---|
 |  |
 |  |
| Nome IUPAC | oxônio |
| Outros nomes | íon hidrônio ou hidroxônio |
| Identificadores | |
| Número CAS | |
| Propriedades | |
| Fórmula molecular | H3O+ |
| Massa molar | 19,02 g mol-1 |
| Acidez (pKa) | 0 |
| Compostos relacionados | |
| Outros aniões/ânions | Hidroxila (OH-) |
| Outros catiões/cátions | Íon halônio (H2X+, sendo X um halogênio, e seus derivados) Amônio (NH4+) Sulfônio (S+R3) Hidrogênio protonado molecular (H3+) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Hidrônio, hidroxônio (português brasileiro) ou hidrónio, hidroxónio (português europeu) é o nome usual para a forma mais simples de um catíon oxônio e se representa simplesmente por H3O+, ou ainda, para explicitar o meio aquoso solvente universal, por H3O+(aq).
Em estado livre, ocorre quase sempre em solução aquosa, como resultado da protonação de uma molécula de água por solvatação de um ácido, mas pode também existir em estado sólido, formando um sal com um ácido forte. No meio interestelar, é um íon molecular[1] abundante, resultando da interação de moléculas de água com a radiação cósmica.
Nomenclatura
[editar | editar código-fonte]Segundo a nomenclatura da International Union of Pure and Applied Chemistry (IUPAC), relativa à química orgânica, o íon H3O+ deve ser designado por oxônio. O termo hidroxônio pode também ser empregado para evitar qualquer ambiguidade.
Um projeto de norma da IUPAC preconiza o uso do termo oxônio , no contexto específico de química orgânica, e oxidano, no contexto de química inorgânica.
Um íon oxônio é qualquer íon que envolva um cátion oxigênio trivalente. Por exemplo, um grupo hidroxila protonado é um íon oxônio, mas não é um hidrônio.
Ácidos e acidez
[editar | editar código-fonte]Hidrônio é o cátion formado a partir da molécula de água na presença de cátions hidrogênio (H+). Esses hidrônios não existem em estado livre, como formas livres, senão como espécies químicas solvatadas e são, em si, extremamente reativos. Um ácido (doador protônico) é geralmente a fonte desses hidrônios. Contudo, água exibe caráter anfótero (isto é, comportar quer como levemente ácida, quer como levemente alcalina). Assim, os hidrônios existem mesmo em água quimicamente pura, ou seja, isenta de impureza.
Esse processo singular em que a água reage com água, resultando na produção de íons hidrônio (cátions, H+) e, na mesma medida, íons hidroxila (ânions OH–), é chamado autoionização da água.
Autoionização da água
[editar | editar código-fonte]Os íons hidrônio resultantes são relativamente poucos e têm vida curta como espécies químicas, apresentando feição sui generis, assim como os correspondentes íons hidroxila, em pares conjugados daqueles. Com efeito, por estarem em equilíbrio dinâmico com a água molecular, a esta retornam, por recombinação, e vice-versa, conforme se descreve a seguir:
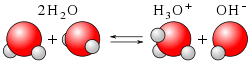
- Inicialmente ocorre a dissociação de uma molécula de água :
- Depois, uma segunda molécula de água solvata o próton liberado :
- Enfim, o próton solvatado obtido, denominado íon hidrônio, é hidratado em solução. Chega-se assim ao esquema geral da reação:
De vida curta, a concentração efetiva de hidrônios é a base para a determinação do pH das soluções aquosas. De fato, quanto maior for a sua concentração, em desfavor da concentração de íons hidroxila, mais ácida é a solução (menor é o pH: pH <7); inversamente, quanto menor for a concentração dos íons hidrônio, em favor da concentração de íons hidroxila, mais alcalina (básica) é a solução (maior é o pH: pH > 7).
O hidrônio é muito ácido: a 25 °C, seu pKa é 0.[2] É também, entre as espécies químicas conhecidas, a mais ácida que pode existir em meio aquoso (supondo-se haver quantidade suficiente de água para dissolução). De fato, qualquer ácido forte ionizar-se-á e — no modelo de Brønsted-Lowry — doará prótons tais que venham a protonar moléculas de água, formando íons hidrônio, e isso vem a ser a solvatação protônica. A acidez do hidrônio é o padrão implícito para se aferir a "força ácida" de um ácido em solução aquosa: ácidos fortes precisam ser melhores doadores de prótons que o íon hidrônio. Em caso contrário, uma quantidade expressiva de ácido iria permanecer em estado não ionizado, e isso o desqualificaria como ácido. Diferentemente, pois, dos íons hidrônio resultantes da autoionização em equilíbrio dinâmico da água pura, os íons hidrônio que surgem da dissolução de um ácido em meio aquoso são, dinamicamente, bem mais duráveis, persistentes e mais concentrados — isso na exata medida da "força ácida" do ácido que venha estar em solução aquosa. Por exemplo, soluções aquosas de ácido perclórico exibem mais "força ácida específica" (acidez por unidade de concentração) do que as de mesma concentração com ácido sulfúrico, e estas ainda mais que as correspondentes com ácido clorídrico.
O pH de uma solução é usualmente referido como "a medida da concentração hidrogeniônica da solução". Entretanto, visto que os íons hidrogênio, em solução aquosa, entram em solvatação protônica - da qual resultam íons hidrônio — então, efetivamente, o pH vem a ser "a medida da concentração hidroniônica da solução", o que, em grandeza numérica, mantém os valores, pois há uma correspondência biunívoca entre íons hidrogênio (imediatamente antes da solvatação) e íons hidrônio (imediatamente após a solvatação): a cada íon hidrogênio ainda não solvatado corresponde um íon hidrônio e vice-versa. A questão de se referir a função pH à concentração hidroniônica vem a ser um rigor de maior consistência química, pelo fato de reportar à natureza da composição da espécie química que se está a medir.
Solvatação
[editar | editar código-fonte]Cientistas já tem por caracterizada plenamente a solvatação do íon hidrônio em água, em parte pelo fato de existirem muitos significados de solvatação. De fato, um estudo do fenômeno decréscimo no ponto de congelamento (um dos efeitos coligativos ou, conforme mais frequente, uma das propriedades coligativas) permitiu definir que a hidratação média do íon hidrônio em água assume aproximadamente a configuração H3O+(H2O)6:[3] em média, efetivamente, cada íon hidrônio é solvatado por seis moléculas de água, que, dessa forma, tornam-se inaptas à solvatação de outra qualquer espécie química eventualmente presente (ou a posteriormente adicionada) como soluto. Tal número constitui-se, pois, numa espécie de reserva de solvatação especificamente dedicada ao íon hidrônio.
Algumas estruturas são bem maiores: a configuração H3O+(H2O)20 (dita mágica devido à sua elevada estabilidade, ao ser comparada com outras com números também elevados de moléculas de água) permite definir que o íon hidrônio encaixa-se em núcleo dodecaédrico.[4]
Contudo, simulações mais recentes sobre dinâmica molecular, baseadas nos princípios quânticos elementares, tem mostrado que, em média, o próton hidratado reside na superfície do domínio H3O+(H2O)20,[5] confirmado por várias outras investigações experimentais.

Duas outras estruturas bem conhecidas são os cátions Zundel e os cátions Eigen. Uma estrutura de solvatação proposta para o cátion Eigen apresenta o íon hidrônio localizado no centro de um complexo iônico H9O4+, na qual o hidrônio é fortemente hidrogênio-ligado a três moléculas de água vizinhas.[6]
Na estrutura de solvatação Zundel H5O2+, o complexo iônico é tal que o próton acha-se compartilhado por duas moléculas de água próximas.[7] Trabalhos recentes indicam que ambos esses complexos iônicos representam estruturas ideais num defeito de rede de ligações de hidrogênio.[8]
Achou-se um íon hidrônio monômero em fase líquida numa solução não-aquosa superácida fracamente nucleofílica (HF-SbF5SO2), com ressonância magnética nuclear Oxigênio-17 de alta resolução..[9]
Em 2007, Markovitch & Agmon calcularam, pela primeira vez, as entalpias e as energias livres das várias ligações de hidrogênio no entorno de um cátion hidrônio em água líquida protonada[10] em temperatura ambiente, bem como propuseram a implementação para um mecanismo de captura protônica. Usando dinâmica molecular, eles se tornaram capazes de provar que as ligações de hidrogênio no entorno dum íon hidrônio (formado por três ligantes de água no primeiro núcleo de solvatação do hidrônio) são bastante fortes comparadas às da água em si.
Sais sólidos de hidrônio
[editar | editar código-fonte]Para muitos ácidos fortes, é possível formar cristais dos correspondentes sais de hidrônio relativamente estáveis. Algumas vezes, esses sais se chamam ácidos mono-hidratos. Como regra, qualquer ácido cuja constante de ionização seja da ordem de 109 ou superior pode realizá-lo. Doutro lado, ácidos cuja contante de ionização seja inferior à 109 geralmente não conseguem formar sais hidrônicos (H3O+) estáveis. Por exemplo, ácido clorídrico (HCl) tem constante de ionização da ordem de 107, e suas misturas (soluções) com água em qualquer medida (razão) são líquidas em temperatura ambiente. Contudo, ácido perclórico (HClO4) apresenta constante de ionização da ordem de 1010 e, assim, se ácido perclórico anidro líquido é misturado com água em razão de 1:1, forma-se um perclorato de hidrônio sólido.
O íon hidrônio também forma compostos estáveis com o superácido carborano H(CB11H(CH3)5Br6) ]. Cristalografia de Raios-X mostra uma simetria C3v para o íon hidrônio, cada próton interagindo com um átomo de bromo de três ânions carborano, 320 pm distantes em média. O sal H3O ]H(CB11HCl11) ] é também solúvel em benzeno. No crescimento dos cristais a partir de uma solução benzênica, o solvente (benzeno) co-cristaliza-se e um cátion H3O.(benzeno)3 separa-se completamente do correspondente ânion. No cátion, três moléculas de benzeno envolvem o hidrônio, formando interações pi-catiônicas com os átomos de hidrogênio. A menor distância (não-ligante) do ânion baseado em cloro para o cátion baseado em oxigênio é 348 pm.
Ver também
[editar | editar código-fonte]Referências
[editar | editar código-fonte]- Notas
- ↑ Íon molecular é o íon formado pela remoção de um ou mais elétrons de uma molécula (formando um íon positivo) ou pela adição de um ou mais elétrons a uma molécula (formando um íon negativo). Anteriormente chamado íon pseudomolecular ou íon quase-molecular, esses termos estão obsoletos. Portanto, íon molecular é uma molécula intacta ionizada sem adição ou retirada de componente, mas somente de elétrons. Ver Nomenclatura de espectrometria de massas em Língua Portuguesa[ligação inativa]. Química Nova, vol. 34, n° 10, 1875-1887, 2011.
- ↑ Meister, Erich; Willeke, Martin; Angst, Werner; Togni, Antonio; Walde, Peter (2014). "Confusing Quantitative Descriptions of Brønsted-Lowry Acid-Base Equilibria in Chemistry Textbooks – A Critical Review and Clarifications for Chemical Educators". Helv. Chim. Acta. 97 (1): 1–31. doi:10.1002/hlca.201300321
- ↑ Zavitsas, A. A. (2001) Properties of water solutions of electrolytes and nonelectrolytes. J. Phys. Chem. B 105 7805-7815.
- ↑ Hulthe, G.; Stenhagen, G.; Wennerström, O. & C-H. Ottosson, C-H. (1997) Water cluster studied by electrospray mass spectrometry. J. Chromatogr. A 512 155-165.
- ↑ Iyengar, S. S. ;Petersen, M. K.; Burnham, C. J.; Day, T. J. F.; Voth, G. A. (2005) The Properties of Ion-Water Clusters. I. The Protonated 21-Water Cluster. J. Chem. Phys. 123 084309.
- ↑ Zundel, G. & Metzger, H. (1968) Energiebänder der tunnelnden Überschuß-Protonen in flüssigen Säuren. Eine IR-spektroskopische Untersuchung der Natur der Gruppierungen H5O2+ Z. Phys. Chem. 58 225-245.
- ↑ Wicke, E.; Eigen, M. & Ackermann, Th. (1954) Über den Zustand des Protons (Hydroniumions) in wäßriger Lösung. Z. Phys. Chem. 1 340-364.
- ↑ Marx, D.; Tuckerman, M. E.; Hutter, J. & Parrinello, M. (1999) The nature of the hydrated excess proton in water. Nature 397 601-604.
- ↑ Mateescu, Gheorghe D. & Benedikt, George M. (1979) Water and related systems. 1. The hydronium ion (H3O+). Preparation and characterization by high resolution oxygen-17 nuclear magnetic resonance. Journal of the American Chemical Society , 101(14), 3959-60.
- ↑ Structure and energetics of the hydronium hydration shells. Omer Markovitch and Noam Agmon J. Phys. Chem. A; 2007; 111(12) pp 2253 - 2256; [1]
- Bibliografia
- FERREIRA, Aurélio Buarque de Holanda. Dicionário da Língua Portuguesa. Rio de Janeiro: Positivo, 2010
- BARTHELMESS, Arthur.. Química. (Coleção em seis volumes, Da Iniciação à Físico-química moderna). Curitiba (Pr, Brasil): Semeador, 1972.
- FELTRE, Ricardo & YOSHINAGA, Setsuo. Atomística. São Paulo (SP, Brasil): Moderna, 1973.
- Microsoft do Brasil. Enciclopédia Encarta 2001. São Paulo: Microsoft do Brasil, 2001.


 French
French Deutsch
Deutsch

