Mostarda nitrogenada 2 – Wikipédia, a enciclopédia livre
| Mostarda nitrogenada 2 Alerta sobre risco à saúde | |
|---|---|
 | |
 | |
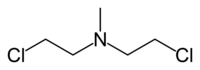
| Nome IUPAC | 2-cloro-N-(2-cloroetil)-N-etilmetano-1-amina |
| Outros nomes | HN-2. Mostarda nitrogenada 2. Clorometina. Caryolisina; Cloroetazina; Embikhin; mustargen; mustine. |
| Identificadores | |
| Número CAS | |
| SMILES |
|
| Propriedades | |
| Fórmula molecular | C5H11Cl2N |
| Massa molar | 156,05354 g mol−1 |
| Densidade | 1.1118 g/cm3 |
| Ponto de fusão | -10°C para -70°C |
| Ponto de ebulição | 140 °C |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Mostarda nitrogenada 2[1][2][3][4][5] ou HN2, É um liquido branco para marrom, oleoso e viscoso, possui quase nenhum cheiro, quando impuro, possui cheiro de peixe, destilados de mostardas nitrogenadas tendem a possuir um cheiro de Arenque, HN-2 possui um ponto de fusão de -10 graus Celsius podendo chegar a -70 graus Celsius (mediante pureza). Destilado a 75 graus Celsius perante vácuo de 15 milímetros de mercúrio ou a 89 graus Celsius em 17 mmHg. Estoques antigos contendo HN2 sem solvente apresentavam HN2 em uma espécie e forma de massa semissólida ocasionada pela polimerização. Levemente solúvel em água, com uma proporção de dissolução de 1% para cada 100 mililitros de água, tornando a reagir com ela de forma lenta, produzindo geralmente, sais derivados e similares do Cloreto de Metildietanolamônio e Cloreto de Clorometildietanolamônio, com posterior polimerização destes em ambiente, HN2 puro tende a se polimerizar sozinho para os íons Cloreto de 1-(2-cloroetil)-1-metilaziridin-1-io, com estabilização quando parte se polimeriza para o Cloreto de 1,4-bis(2-cloroetil)-1,4-metilpiperazino-1,4-dio, utiliza-se Clorofórmio ou Diclorometano para impedir tal polimerização e prolongar sua vida em estoque. É solúvel comumente em Clorofórmio, tetracloreto de carbono, dimetilformamida e sulfeto de carbono.
Degradação
[editar | editar código-fonte]HN2 é um agente persistente em ambiente, podendo persistir nele de 5 a 7 dias em condições normais, traços deste agente já persistiram por mais de 1 mês. estoques antigos contendo HN2 sem solvente, possuíam HN2 em uma espécie e forma de massa semissólida ocasionada pela polimerização, HN2 puro tende a se polimerizar sozinho para os íons Cloreto de 1-(2-cloroetil)-1-metilaziridin-1-io, com estabilização quando parte se polimeriza para o Cloreto de 1,4-bis(2-cloroetil)-1,4-metilpiperazino-1,4-dio, utiliza-se Clorofórmio ou Diclorometano para impedir tal polimerização e prolongar sua vida em estoque.
Toxicidade[6]
[editar | editar código-fonte]É vesicante, causando queimaduras químicas rapidamente, a aspiração sua causa a morte, é um potente agente alquilante, sendo assim, um potente agente cancerígeno. HN2 é mais potente e efetivo que HD (Mostarda de enxofre). Uma vez que os indivíduos expostos a um agente HN2 não mostram efeitos sintomáticos imediatos, principalmente nos olhos, mas áreas contaminadas podem parecer completamente normais, é possível que as vítimas recebam doses altas inadvertidamente.
Em 4 a 12 horas após a exposição às vítimas apresentam comichão e irritação intensa com o surgimento gradual de vesículas na pele, contendo um líquido. Isto são queimaduras químicas e são muito debilitantes. Os sintomas provenientes da intoxicação por HN podem surgir imediatamente após a contaminação, continuando a aparecer até 12 horas após a exposição.
E como se não bastasse, a substância ainda pode permanecer ativa por bastante tempo, por isso os soldados que tinham suas roupas e equipamentos contaminados morriam envenenados. Se os olhos do indivíduo tiverem sido expostos ficarão afetados começando com conjuntivite e progredindo para cegueira temporária e rapidamente causando feridas graves.
Se o HN for inalado em concentrações elevadas causa sangramento e formação de vesículas também nas vias respiratórias danificando a mucosa e causando edema pulmonar. Dependendo do nível de contaminação, as queimaduras com o HN2 variam entre primeiro e segundo grau, podendo chegar a ser tão severas e desfigurantes como as de terceiro grau. As queimaduras severas podem ser fatais, ocorrendo à morte alguns dias ou até semanas após exposição.
Uma exposição moderada muito provavelmente não mata, contudo, a vítima necessita de longos períodos de tratamento médico. Os efeitos mutagênicos e carcinogênicos do HN implicam que as vítimas que recuperam das queimaduras químicas têm um risco aumentado de desenvolver câncer, as chances de desenvolver câncer são maiores que a exposição por Gás mostarda e variantes.
Sua dose letal é de 2350 miligramas, 4000 miligramas causam a morte em imediato. 7500 para 8000 miligramas causam a morte em imediato em menos de 24 horas, 80 miligramas na face causa severas complicações e efeitos sistêmicos faciais, 200 miligramas causam formações de bolhas de 4 horas em diante, 1 miligrama do agente em qualquer parte do corpo já causa efeitos vesicantes.
Síntese
[editar | editar código-fonte]HN2 é produzido a partir da reação de Metilamina com Óxido de etileno em refluxo até não haver mais refluxo no aparelho, logo é colocado a Metilaminadietanol para reagir com Cloro gasoso e Enxofre, o Enxofre irá absorver o Cloro e formará Dicloreto de enxofre e posteriormente reagirá com os radicais hidroxilos e formará Monóxido de enxofre e Cloreto de hidrogênio, a reação utiliza Clorofórmio como solvente perante refluxo, logo é retirado os subprodutos e lavado os cristais de Mostarda nitrogenada hidroclórica e depois feita reagir com Carbonato de sódio até tornar liquida, logo os sais são dissolvidos em água e a parte inferior (HN2) é separada por funil de separação. 
Referências
- ↑ «mechlorethamine». PubChem. 25 de março de 2005. Consultado em 27 de setembro de 2017
- ↑ «CDC - The Emergency Response Safety and Health Database: Blister Agent: NITROGEN MUSTARD HN-2 - NIOSH». www.cdc.gov (em inglês). 8 de novembro de 2017. Consultado em 10 de março de 2018
- ↑ «004 Vesicants». www.brooksidepress.org. Consultado em 10 de março de 2018
- ↑ Ledgard, Jared. «A Laboratory History of Chemical Warfare Agents» (PDF). Consultado em 7 de março de 2018
- ↑ «TOXNET». toxnet.nlm.nih.gov (em inglês). Consultado em 6 de abril de 2018
- ↑ «NITROGEN MUSTARD HN-2 : Blister Agent». The National Institute for Occupational Safety and Health (NIOSH). Consultado em 27 de setembro de 2017


 French
French Deutsch
Deutsch