Permanganat
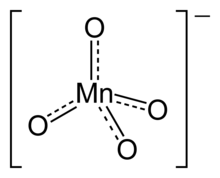
Permanganat este denumirea dată oricărui compus chimic care conține ionul MnO−
4. În acest ion, manganul are starea de oxidare +7, fapt pentru care permanganații sunt agenți oxidanți puternici. Ionul are o geometrie moleculară tetraedrică.[1] Soluțiile de permanganat sunt de culoare mov-violet și sunt stabile în mediu neutru sau ușor alcalin. Ecuația corectă a unei reacții redox în care este implicat ionul permanganat depinde de ceilalți parteneri de reacție, de mediu și de agentul reducător folosit. De exemplu, tricloroetanul (C2HCl3) este oxidat în prezența permanganatului de sodiu cu formare de dioxid de carbon (CO2), dioxid de mangan (MnO2), ioni de sodiu (Na+), ioni hidroniu (H+) și ioni clorură (Cl−).[2]
Obținere
[modificare | modificare sursă]
Proprietăți
[modificare | modificare sursă]Permanganații sunt sărurile acidului permanganic și au o colorație mov-violet. Ionul permanganat (VII) este un agent oxidant puternic, similar ionului perclorat (cu care se aseamănă și ca structură moleculară). De aceea, permanganații sunt utilizați în analiza cantitativă, în titrările redoxometrice cunoscute sub numele de permanganometrie.
Descompunere termică
[modificare | modificare sursă]Permanganații nu sunt foarte stabili din punct de vedere termic. De exemplu, permanganatul de potasiu se descompune la 230 °C cu formare de manganat de potasiu, dioxid de mangan și oxigen gazos:
- 2 KMnO4 → K2MnO4 + MnO2 + O2
Comportament în soluție
[modificare | modificare sursă]Într-o soluție acidă, ionul permanganat (VII) este redus la starea de oxidare +2, în care se regăsește ionul incolor de mangan (II) (Mn2+):
- 8 H+
+ MnO−
4 + 5 e− → Mn2+ + 4 H2O
Într-o soluție puternic bazică, ionul permanganat (VII) este redus la starea de oxidare +6, specifică ionului manganat, MnO2−
4, colorat în verde:
- MnO−
4 + e− → MnO2−
4
În mediu neutru, supus reducerii, poate ajunge la starea de oxidare +4, la dioxid de mangan, MnO2, brun:
- 2 H2O + MnO−
4 + 3 e− → MnO2 + 4 OH−
Caracter oxidant puternic
[modificare | modificare sursă]Permanganații pot oxida mulți compuși organici: din amine se obțin nitroderivați,[3][4] din alcooli se obțin cetone,[5] din aldehide se obțin acizi carboxilici,[6][7] din alchene terminale se obțin acizi carboxilici,[8] din acid oxalic se obține dioxid de carbon,[9] și din alchene se obțin dioli vicinali.[10]

Vezi și
[modificare | modificare sursă]Referințe
[modificare | modificare sursă]- ^ Sukalyan Dash, Sabita Patel & Bijay K. Mishra (). „Oxidation by permanganate: synthetic and mechanistic aspects”. Tetrahedron. 65 (4): 707–739. doi:10.1016/j.tet.2008.10.038.
- ^ http://geocleanse.com/permanaganate.asp
- ^ A. Calder, A. R. Forrester1, and S. P. Hepburn (), „2-methyl-2-nitrosopropane and its dimer”, Org. Synth., 6: 803; Collective Volume, 52, p. 77
- ^ Nathan Kornblum and Willard J. Jones (), „4-nitro-2,2,4-trimethylpentane”, Org. Synth., 5: 845; Collective Volume, 43, p. 87
- ^ J. W. Cornforth (), „Ethyl pyruvate”, Org. Synth., 4: 467; Collective Volume, 31, p. 59
- ^ R. L. Shriner and E. C. Kleiderer (), „Piperonylic acid”, Org. Synth., 2: 538; Collective Volume, 10, p. 82
- ^ John R. Ruhoff (), „n-heptanoic acid”, Org. Synth., 2: 315; Collective Volume, 16, p. 39
- ^ Donald G. Lee, Shannon E. Lamb, and Victor S. Chang (), „Carboxylic acids from the oxidation of terminal alkenes by permanganate: nonadecanoic acid”, Org. Synth., 7: 397; Collective Volume, 60, p. 11
- ^ Kovacs KA, Grof P, Burai L, Riedel M (). „Revising the Mechanism of the Permanganate/Oxalate Reaction”. J. Phys. Chem. A. 108 (50): 11026. Bibcode:2004JPCA..10811026K. doi:10.1021/jp047061u.
- ^ E. J. Witzemann, Wm. Lloyd Evans, Henry Hass, and E. F. Schroeder (), „dl-glyceraldehyde ethyl acetal”, Org. Synth., 2: 307; Collective Volume, 11, p. 52


 French
French Deutsch
Deutsch