Политиазил — Википедия
Политиазил | |
|---|---|
Общие | |
| Хим. формула | (SN)x |
Физические свойства | |
| Состояние | Бронзовый цвет, металлический блеск |
Термические свойства | |
| Т. субл. | В вакууме: 135 ℃ |
| Т. разл. | На воздухе: 240 ℃ |
Структура | |
| Кристаллическая структура | почти плоский цепочечный полимер |
Классификация | |
| Номер CAS | 56422-03-8 |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
Политиазил (полимерный нитрид серы) — полимер, соединение серы и азота, имеющее цвет от золотистого до бронзового, синий — в тонких слоях[1][2].
Соединение получено впервые в 1910 году полимеризацией кристаллического динитрида дисеры (S2N2) при комнатной температуре[1][3].
Свойства
[править | править код]Политиазил, будучи неорганическим полимером, является проводником электричества[1]. В 1975 г. в результате охлаждения до крайне низких температур (ниже 0,26 K) были открыты сверхпроводящие свойства полимера[4][5].
При нагревании на воздухе разлагается со взрывом при температуре ~240 °C, в вакууме легко возгоняется при температуре ~135 °C[1].
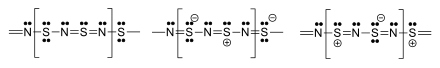
Нерастворим в воде и органических растворителях, медленно разлагается под воздействием щелочей[2].
Получение
[править | править код]Политиазил синтезируется благодаря термической полимеризации димера — намного менее стабильного, чем политиазил[1], — динитрида дисеры (S2N2), получить который в свою очередь можно из циклического тетрамера тетранитрида тетрасеры (S4N4). Произвести переход из циклического тетрамера в димер можно при нагревании в вакууме паров S4N4 благодаря использованию в качестве катализатора нагретое серебро в виде «ваты»[7].
- S4N4 + 8 Ag → 4 Ag2S + 2 N2
- S4N4 (Ag2S катализатор) → 2 S2N2 (при 250-300°C) → S2N2
- S2N2 (при 0 °C, сублимируется на поверхности) → термическая полимеризация → (SN)x
Вышеописанные реакции были хорошо изучены и показали, что исходные вещества, наряду с промежуточными, очень чувствительны к условиям реакций, в которых они проводятся[1].
Использование
[править | править код]Благодаря его способности проводить электрический ток, политиазил используется в светодиодах, транзисторах, катодах батарей, фотоэлементах[7].
Примечания
[править | править код]- ↑ 1 2 3 4 5 6 Н. Н. Гринвуд, А. Эрншо, 1997, с. 727.
- ↑ 1 2 Турова, 1997, с. 21.
- ↑ Burt Frank Playfair. XCIX.—A new sulphide of nitrogen // Journal of the Chemical Society, Transactions. — 1910. — Vol. 97. — P. 1171. — ISSN 0368-1645. — doi:10.1039/CT9109701171.
- ↑ Labes M. M., Love P., Nichols L. F. Polysulfur nitride - a metallic, superconducting polymer // Chemical Reviews. — 1979. — Февраль (т. 79, № 1). — С. 1—15. — ISSN 0009-2665. — doi:10.1021/cr60317a002.
- ↑ Harry R. Allcock. Introduction to Materials Chemistry. — John Wiley & Sons, 2011. — С. 131. — ISBN 978-1-118-21098-7.
- ↑ Okada Mayumi, Tanaka Kazuyoshi, Takata Akira, Yamabe Tokio. Examination of electronic phase of the Hartree-Fock solution of an isolated polythiazyl chain // Synthetic Metals. — 1993. — Июль (т. 59, № 2). — С. 223—230. — ISSN 0379-6779. — doi:10.1016/0379-6779(93)91029-2.
- ↑ 1 2 Ronald D. Archer. Inorganic and Organometallic Polymers. — John Wiley & Sons, 2001. — С. 213. — ISBN 978-0-471-24187-4.
Литература
[править | править код]- Н. Н. Гринвуд, А. Эрншо. Химия элементов = Chemistry of the Elements. — 2-е изд. — Butterworth-Heinemann, 1997. — ISBN 0080379419.
- Турова Н. Я. Неорганическая химия в таблицах. — М.: Высший химический колледж Российской академии наук, 1997. — 115 с.


 French
French Deutsch
Deutsch

