Зелёный флуоресцентный белок — Википедия
| Зелёный флуоресцентный белок | |
|---|---|
![Структура ЗФБ медузы Aequorea victoria[1]](http://upload.wikimedia.org/wikipedia/commons/thumb/2/20/PDB_1ema_EBI.jpg/274px-PDB_1ema_EBI.jpg) Структура ЗФБ медузы Aequorea victoria[1] | |
| Идентификаторы | |
| Символ | ЗФБ, GFP |
| Pfam | PF01353 |
| Pfam clan | CL0069 |
| InterPro | IPR011584 |
| SCOP | 1ema |
| SUPERFAMILY | 1ema |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |


Зелёный флуоресцентный белок (ЗФБ) (англ. green fluorescent protein, GFP) — белок, выделенный из медузы Aequorea victoria, который флуоресцирует в зелёном диапазоне при освещении его светом от синего до ультрафиолетового диапазона. В настоящее время ген белка широко используется в качестве светящейся метки в клеточной и молекулярной биологии для изучения экспрессии клеточных белков. Разработаны модификации белка для применения в биосенсорах. Созданы цельные светящиеся животные (например, свиньи), у которых ЗФБ внедрён в геном и передаётся по наследству. Созданы также ЗФБ-содержащие вирусные векторы, позволяющие локально вводить желаемый ген в организм животного и прослеживать экспрессируемый белок. В 2008 году Осаму Симомура, Мартин Чалфи и Роджер Тсиен (Цянь) получили Нобелевскую премию по химии «за открытие и разработку зелёного флуоресцентного белка».
Структура и свойства
[править | править код]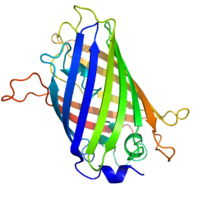
Зелёный флуоресцентный белок характеризуется двумя пиками поглощения при длинах волн 395 нм (основной) и 475 нм (минорный) и пиком флуоресценции на 498 нм. Белок состоит из 238 аминокислот и имеет молекулярную массу 26,9 кДа. Белок представляет собой типичную бета-складчатую структуру (см. например, липокалин), формирующую «бочонок» или «цилиндр» из 11 поворотов первичной последовательности, внутри которого находится флюорофор. Оболочка цилиндра защищает флюорофор от гашения его флуоресценции компонентами микроокружения. Кроме этого, внутренняя структура молекулы вызывает специфические реакции циклизации трипептида Ser65-Tyr66-Gly67, что приводит к образованию флюорофора. Этот процесс называется созреванием и включает несколько этапов, каждый из которых формирует промежуточный или конечный продукты с различными спектральными свойствами.
Кристаллическая структура белка была расшифрована в 1996 году в лаборатории Ремингтона. Она прояснила механизм образования флюорофора и роль окружающих аминокислот. Это позволило получать мутантные GFP с повышенной устойчивостью, с различной флуоресценцией и другими улучшенными свойствами по сравнению с диким типом.
История
[править | править код]Зелёный флуоресцентный белок был выделен вместе с другим светящимся белком экворином из медузы Aequorea victoria Осаму Симомурой, который в 1960 году приехал из Японии в Принстонский университет и начал изучать биолюминесценцию медузы. В 1960—1970-е года он выделил оба белка и изучал механизм их свечения. Оказалось, что в A. victoria взаимодействие ионов кальция с экворином вызывает голубое свечение белка. Часть этой биолюминесценции переносится на зелёный флуоресцентный белок, который поглощает синий свет и испускает флуоресценцию зелёного цвета, что в целом приводит к зелёному сдвигу в свечении медузы.
Однако применение ЗФБ в молекулярной биологии началось лишь в 1990-х годах. В 1992 году Дуглас Прэшер проклонировал и просеквенировал ДНК белка, после чего из-за недостатка финансирования вынужден был закрыть проект и разослал полученную ДНК в несколько лабораторий, в том числе в лабораторию Мартина Чалфи. Мартин Чалфи экспрессировал последовательность в Escherichia coli и Caenorhabditis elegans и опубликовал результаты в журнале Science в 1994. Месяц спустя были опубликованы независимые результаты из лаборатории Фредерика Цудзи (Frederick Tsuji). Оказалось, что GFP принимал нативную конформацию и образовывал флуорофор при комнатной температуре и без добавления дополнительных кофакторов, что обеспечило возможность использования белка в качестве маркёра в клетках многих организмов.
ЗФБ в искусстве
[править | править код]
Фосс-Андре Юлиан (Julian Voss-Andreae), художник немецкого происхождения, специализирующийся на «белковых скульптурах», создал скульптуры, основанные на структуре ЗФБ, в том числе работы «Зелёный флуоресцентный белок» (2004) высотой 1,7 м и «Стальная медуза» (2006) высотой 1,4 м. Последняя была установлена на биологической станции Лаборатории Фрайди-Харбор (Friday Harbor Laboratories) Вашингтонского университета (University of Washington), где в 1962 году Осама Симомура открыл ЗФБ.
См. также
[править | править код]- Жёлтый флуоресцентный белок
- Красный флуоресцентный белок
- Зелёные светящиеся поросята
- Флуоресценция в биологических исследованиях
Примечания
[править | править код]- ↑ Ormö M, Cubitt AB, Kallio K, Gross LA, Tsien RY, Remington SJ (September 1996). "Crystal structure of the Aequorea victoria green fluorescent protein". Science. 273 (5280): 1392—5. Bibcode:1996Sci...273.1392O. doi:10.1126/science.273.5280.1392. PMID 8703075. S2CID 43030290.
Ссылки
[править | править код]- Нобелевскую премию по химии присудили за зелёный флуоресцентный белок
- Флуоресцентные белки Архивная копия от 6 декабря 2011 на Wayback Machine
- Introduction to fluorescent proteins
- History, uses, and structure of GFP
- Brief summary of landmark GFP papers
- Interactive Java applet demonstrating the chemistry behind the formation of the GFP fluorophore
- Tsien Lab @ UCSD
- Video of Nobel Prize lecture of Roger Tsien on fluorescent proteins
- Excitation and emission spectra for various fluorescent proteins
- Timeline
- Some factoids about Aequorea, the jellyfish source of GFP
- Video introduction to GFP, from the «Secrets of the Sequence» educational video series
- Доктор биологических наук Дмитрий Чудаков о флуоресцентном красителе


 French
French Deutsch
Deutsch