Uranhexafluorid – Wikipedia
| Uranhexafluorid | |
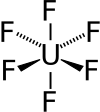  | |
| Systematiskt namn | Uran(IV)hexafluorid |
|---|---|
| Övriga namn | Hex |
| Kemisk formel | UF6 |
| Molmassa | 352,02 g/mol |
| Utseende | Färglösa kristaller |
| CAS-nummer | 7783-81-5 |
| SMILES | F[U](F)(F)(F)(F)F |
| Egenskaper | |
| Densitet | 5,09 g/cm³ |
| Löslighet (vatten) | Hydrolys |
| Smältpunkt | 64,8 °C (Trippelpunkt) |
| Kokpunkt | 56,5 °C (Sublimerar) |
| Faror | |
| Huvudfara | |
| NFPA 704 | |
| LD50 | 50 mg/kg |
| SI-enheter & STP används om ej annat angivits | |
Uranhexafluorid (UF6), även känd som hex, är en kemisk förening av uran och fluor. Uranhexafluorid är ett flyktigt vitt fast ämne som reagerar med vatten och frigör frätande fluorvätesyra. Föreningen reagerar milt med aluminium och bildar ett tunt ytskikt av AlF3 som motstår ytterligare reaktioner från föreningen. UF6 används för att anrika uran, som produceras för tillverkning av bränsle för kärnreaktorer och kärnvapen. Uranhexafluorid korroderar även de flesta metaller.
Framställning
[redigera | redigera wikitext]Malen uranmalm — U3O8 eller "yellow cake" — löses i salpetersyra och ger en lösning av uranylnitrat UO2(NO3)2. Rent uranylnitrat erhålls genom lösningsmedelsextraktion och behandlas sedan med ammoniak för att framställa ammoniumdiuranat ("ADU", (NH4)2U2O7). Reduktion med väte ger UO2, som omvandlas med fluorvätesyra (HF) till urantetrafluorid, UF4. Oxidation av detta med fluor ger UF6.
Under kärnupparbetning reageras uran med klortrifluorid för att ge UF6:
- U + 2 ClF3 → UF6 + Cl2
Egenskaper
[redigera | redigera wikitext]Fysiska egenskaper
[redigera | redigera wikitext]Vid atmosfärstryck sublimerar uranhexafluorid vid 56,5 °C.[2] Det fasta tillståndets struktur bestämdes genom neutrondiffraktion vid 77 K och 293 K.[3][4]
- Kul-och-stick-modell av enhetscellen för uranhexafluorid[5]
- Bindningslängder och vinklar för gasformig uranhexafluorid[6]
Kemiska egenskaper
[redigera | redigera wikitext]Det har visat sig att uranhexafluorid är en oxidant[7] och en Lewissyra som kan binda till fluor. Till exempel rapporteras reaktionen av koppar(II)fluorid med uranhexafluorid i acetonitril bilda koppar(II)heptafluorouranat(VI), Cu(UF7)2.[8]
Polymera uran(VI)fluorider som innehåller organiska katjoner har isolerats och karakteriserats genom röntgendiffraktion.[9]
Användning i kärnbränslecykeln
[redigera | redigera wikitext]
Som en av de mest flyktiga uranföreningarna är uranhexafluorid relativt bekväm att bearbeta och används i båda de viktigaste urananrikningsmetoderna, nämligen gasdiffusion och gascentrifugmetoden. Eftersom trippelpunkten för UF6 — 64 °C och 152 kPa[10] — ligger nära omgivningsförhållandena kan fasövergångar uppnås i en bearbetningsanläggning med litet termodynamiskt arbete.
Fluor har bara en enda naturligt förekommande stabil isotop, så isotopologer av UF6 skiljer sig åt i sin molekylvikt baserat enbart på den närvarande uranisotopen.[11] Denna skillnad är grunden för den fysiska separationen av uranisotoper vid anrikning. Omvandlingsfaktorn för 238U-isotopen för UF6 ("hex") till "U-massa" är .676.[12]
Gasdiffusion kräver cirka 60 gånger så mycket energi som gascentrifugprocessen. Gasdiffusionsproducerat kärnbränsle producerar 25 gånger mer energi än vad som används i diffusionsprocessen, medan centrifugproducerat bränsle producerar 1 500 gånger mer energi än vad som används i centrifugprocessen.
Anrikning av uran ger upphov till stora mängder utarmat uranhexafluorid, eller DUF6, som en avfallsprodukt. Långtidsförvaring av DUF6 utgör miljö-, hälso- och säkerhetsrisker på grund av dess kemiska instabilitet. När UF6 utsätts för fuktig luft reagerar den med vattnet i luften för att producera UO2F2(uranylfluorid) och HF (vätefluorid) som båda är mycket frätande och giftiga. År 2005 var 686 500 ton DUF6 inrymt i 57 122 lagringscylindrar nära Portsmouth, Ohio, Oak Ridge, Tennessee, och Paducah, Kentucky.[13][14] Förvaringscylindrar måste regelbundet inspekteras med avseende på tecken på korrosion och läckage. Stålcylindrarnas beräknade livslängd mäts i årtionden.[13][14]
Referenser
[redigera | redigera wikitext]- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Uranium hexafluoride, 18 december 2022.
Noter
[redigera | redigera wikitext]- ^ Uranium(VI) fluoride
- ^ Brickwedde, Ferdinand G.; Hoge, Harold J.; Scott, Russell B. (1948). ”The Low Temperature Heat Capacities, Enthalpies, and Entropies of UF4 and UF6”. J. Chem. Phys. 16 (5): sid. 429–436. doi:. Bibcode: 1948JChPh..16..429B.
- ^ J. H. Levy; John C. Taylor; Paul W. Wilson (1976). ”Structure of Fluorides. Part XII. Single-Crystal Neutron Diffraction Study of Uranium Hexafluoride at 293 K”. J. Chem. Soc., Dalton Trans. (3): sid. 219–224. doi:.
- ^ J. H. Levy, J. C. Taylor and A. B. Waugh (1983). ”Neutron Powder Structural Studies of UF6, MoF6 and WF6 at 77 K”. Journal of Fluorine Chemistry 23: sid. 29–36. doi:.
- ^ J. C. Taylor, P. W. Wilson, J. W. Kelly: „The structures of fluorides. I. Deviations from ideal symmetry in the structure of crystalline UF6: a neutron diffraction analysis", Acta Crystallogr., 1973, B29, p. 7–12; doi:10.1107/S0567740873001895.
- ^ Kimura, Masao; Schomaker, Werner; Smith, Darwin W.; Bernard (1968). ”Electron‐Diffraction Investigation of the Hexafluorides of Tungsten, Osmium, Iridium, Uranium, Neptunium, and Plutonium”. J. Chem. Phys. 48 (8): sid. 4001–4012. doi:. Bibcode: 1968JChPh..48.4001K. https://authors.library.caltech.edu/71173/. Arkiverad 11 januari 2023 hämtat från the Wayback Machine.
- ^ G. H. Olah; J. Welch (1978). ”Synthetic methods and reactions. 46. Oxidation of organic compounds with uranium hexafluoride in haloalkane solutions”. J. Am. Chem. Soc. 100 (17): sid. 5396–5402. doi:.
- ^ J. A. Berry; R. T. Poole; A. Prescott; D. W. A. Sharp; J. M. Winfield (1976). ”The oxidising and fluoride ion acceptor properties of uranium hexafluoride in acetonitrile”. J. Chem. Soc., Dalton Trans. (3): sid. 272–274. doi:.
- ^ S. M. Walker; P. S. Halasyamani; S. Allen; D. O'Hare (1999). ”From Molecules to Frameworks: Variable Dimensionality in the UO2(CH3COO)2·2H2O/HF(aq)/Piperazine System. Syntheses, Structures, and Characterization of Zero-Dimensional (C4N2H12)UO2F4·3H2O, One-Dimensional (C4N2H12)2U2F12·H2O, Two-Dimensional (C4N2H12)2(U2O4F5)4·11H2O, and Three-Dimensional (C4N2H12)U2O4F6”. J. Am. Chem. Soc. 121 (45): sid. 10513–10521. doi:.
- ^ ”Uranium Hexafluoride: Source: Appendix A of the PEIS (DOE/EIS-0269): Physical Properties”. web.evs.anl.gov. https://web.evs.anl.gov/uranium/guide/ucompound/propertiesu/hexafluoride.cfm.
- ^ ”Uranium Enrichment and the Gaseous Diffusion Process”. Uranium Enrichment and the Gaseous Diffusion Process. USEC Inc. http://www.usec.com/v2001_02/HTML/Aboutusec_enrichment.asp. Arkiverad 19 oktober 2007 hämtat från the Wayback Machine. ”Arkiverade kopian”. Arkiverad från originalet den 19 oktober 2007. https://web.archive.org/web/20071019081831/http://www.usec.com/v2001_02/HTML/Aboutusec_enrichment.asp. Läst 11 januari 2023.
- ^ TranslatorsCafé (1 February 2021). ”Unit converter molar mass calculator”. Unit converter molar mass calculator. Mississauga, Ontario, Canada: ANVICA Software Development. https://www.translatorscafe.com/unit-converter/en-US/molar-mass/?q=UF6.
- ^ [a b] ”How much depleted uranium hexafluoride is stored in the United States?”. Depleted UF6 FAQs. Argonne National Laboratory. https://web.evs.anl.gov/uranium/faq/mgmt/faq23.cfm.
- ^ [a b] ”Documents”. Documents. http://web.ead.anl.gov/uranium/documents/index.cfm. Arkiverad 16 februari 2008 hämtat från the Wayback Machine. ”Arkiverade kopian”. Arkiverad från originalet den 16 februari 2008. https://web.archive.org/web/20080216013118/http://web.ead.anl.gov/uranium/documents/index.cfm. Läst 11 januari 2023.
Vidare läsning
[redigera | redigera wikitext]- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil A, p. 121–123.
- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, p. 71–163.
- R. DeWitt: Uranium hexafluoride: A survey of the physico-chemical properties, Technical report, GAT-280; Goodyear Atomic Corp., Portsmouth, Ohio; 12. August 1960; doi:10.2172/4025868.
- Ingmar Grenthe, Janusz Drożdżynński, Takeo Fujino, Edgar C. Buck, Thomas E. Albrecht-Schmitt, Stephen F. Wolf: Uranium Arkiverad 2012-01-18, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, p. 253–698; doi:10.1007/1-4020-3598-5_5 (p. 530–531, 557–564).
- US-Patent 2535572: Preparation of UF6; 26. December 1950.
- US-Patent 5723837: Uranium Hexafluoride Purification; 3. March 1998.
Externa länkar
[redigera | redigera wikitext] Wikimedia Commons har media som rör Uranhexafluorid.
Wikimedia Commons har media som rör Uranhexafluorid.- Simon Cotton (Uppingham School, Rutland, UK): Uranium Hexafluoride.
- Uranium Hexafluoride (UF6) – Physical and chemical properties of UF6, and its use in uranium processing – Uranium Hexafluoride and Its Properties Arkiverad 2012-01-27
- Import of Western depleted uranium hexafluoride (uranium tails) to Russia [dead link 30 June 2017]
- Uranium Hexafluoride in www.webelements.com


 French
French Deutsch
Deutsch
![Kul-och-stick-modell av enhetscellen för uranhexafluorid[5]](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c6/Uranium-hexafluoride-unit-cell-3D-balls.png/180px-Uranium-hexafluoride-unit-cell-3D-balls.png)
![Bindningslängder och vinklar för gasformig uranhexafluorid[6]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/4c/Uranium_hexafluoride_dimensions.svg/180px-Uranium_hexafluoride_dimensions.svg.png)