二氧化硒 - 维基百科,自由的百科全书
| 二氧化硒 | |
|---|---|
 | |
 | |
 | |
| 英文名 | Selenium dioxide |
| 别名 | 氧化硒(IV) |
| 识别 | |
| CAS号 | 7446-08-4 |
| PubChem | 24007 |
| ChemSpider | 22440 |
| SMILES |
|
| InChI |
|
| InChIKey | JPJALAQPGMAKDF-UHFFFAOYAQ |
| UN编号 | 3283 |
| RTECS | VS8575000 |
| 性质 | |
| 化学式 | SeO2 |
| 摩尔质量 | 110.96 g·mol⁻¹ |
| 外观 | 白色晶体 |
| 密度 | 3.95 g/cm3 (固) |
| 沸点 | 315 ℃(升华) |
| 溶解性(水) | 39.50 g/100 ml (25 ℃) |
| pKa | 2.62 (H2SeO3 ⇌ HSeO3− + H+) 8.32 (HSeO3− ⇌ SeO32− + H+) |
| 结构 | |
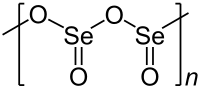
| 晶体结构 | 链状结构 |
| 配位几何 | 三配位 |
| 危险性 | |
| 欧盟危险性符号 | |
| 警示术语 | R:R23/25, R33, R50/53 |
| 安全术语 | S:S1/2, S20/21, S28, S45, S60, S61 |
| NFPA 704 | |
| 闪点 | 不可燃 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
二氧化硒是一种无机化合物,化学式为SeO2。它是白色晶体,加压液化后可以得到黄色液体,常压下加热至317℃升华,得到绿色蒸气。它和空气中的灰尘接触后,遇光即被还原为硒单质而变红。对热稳定。
制取
[编辑]硒在空气中燃烧,硒与硝酸、过氧化氢反应氧化,或亚硒酸脱水都可以得到二氧化硒。
性质
[编辑]二氧化硒可溶于水,生成亚硒酸;溶于碱则生成亚硒酸盐。它是有机合成中的氧化剂,可用于烯丙位氧化、[2]Riley氧化反应等。环己酮发生反应得到1,2-环己二酮,[3]三聚乙醛反应得到乙二醛。[4]烯丙位氧化的通式如下:
- ; R、R'、R" = 烷基、芳基
用途
[编辑]有机合成
[编辑]在有机合成中SeO2是一种重要的试剂。它氧化三聚乙醛生成乙二醛[4],氧化环己酮则得到1,2-环己二酮[5],自身均被还原为硒单质,呈现红色无定形体,很容易过滤出来[5]。此反应叫做Riley氧化反应。二氧化硒还常用在烯丙基的氧化中[2],其反应机理如下:

该反应的通式为:
- R2C=CR'-CHR"2 + [O] → R2C=CR'-C(OH)R"2
参见
[编辑]参考资料
[编辑]- ^ 美国专利#2,616,791。
- ^ 2.0 2.1 Coxon, J. M.; Dansted, E.; Hartshorn, M. P. (1988). "Allylic Oxidation with Hydrogen Peroxide–Selenium Dioxide: trans-Pinocarveol". Org. Synth.; Coll. Vol. 6: 946.
- ^ Hach, C. C. Banks, C. V.; Diehl, H. (1963). "1,2-Cyclohexanedione Dioxime". Org. Synth.; Coll. Vol. 4: 229.
- ^ 4.0 4.1 Ronzio, A. R.; Waugh, T. D. (1955). "Glyoxal Bisulfite". Org. Synth.; Coll. Vol. 3: 438.
- ^ 5.0 5.1 Hach, C. C. Banks, C. V.; Diehl, H. (1963). "1,2-Cyclohexanedione Dioxime". Org. Synth.; Coll. Vol. 4: 229.


 French
French Deutsch
Deutsch





![{\displaystyle {\rm {\ R_{2}C\!=\!CR'\!-\!CHR''_{2}+[O]\rightarrow R_{2}C\!=\!CR'\!-\!C(OH)R''_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee83203ef459fd771f19b6640989eb90f97c1e03)