药物不良反应 - 维基百科,自由的百科全书
| 药物不良反应 | |
|---|---|
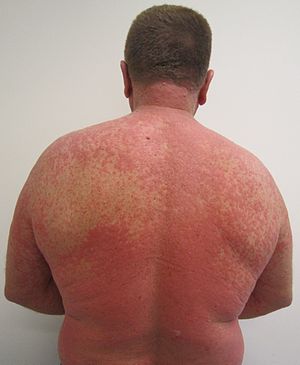 | |
| 藥物引起的紅疹 | |
| 类型 | 不良反应、醫源病、不良事件[*]、藥效[*] |
| 分类和外部资源 | |
| ICD-10 | T88.7、Y40、Y59 |
| DiseasesDB | 295 |
藥物不良反應(英語:adverse drug reaction,ADR)是指服用藥物引起的有害、非預期的結果[1][2]。这种作用一般與治疗无关,且对患者的治疗不利[3]。藥物不良反應可能在單次或長期使用後發生,或因兩種或多種藥物併用後引起。 它含義與「副作用」不同,因為副作用可以有益或有害[4]。藥物不良反應研究是藥物警戒學領域的關注重點[4]。不良事件(AE)是指在使用藥物期間發生的任何意外和不適,不論該事件是否與藥物的使用有關[1]。藥物不良反應是一種特殊類型的不良事件,因它的發生與藥物使用間具有因果關係[4]。藥物不良反應是藥物有關的傷害中的其中一類。其它藥物有關的傷害,包括:未服用處方藥物,又稱為不依從性[5]。藥物的不依從性也可以導致死亡和其他負面結果[5]。但藥物不良反應,必需有使用藥物[4]。
不良反应是药物所具有的两重性之一,完全没有不良反应的药物並不存在[3]。同时,只有一定比例的藥物使用者會發生不良反应,不是所有使用者都会出现不良反应;每个發生不良反应的患者,發生不良反应的表现和程度也不一定相同,其中的个体差异性很大。不良反应包括六个方面,即副作用、毒性反应、過敏反应、继发性反应、后遗效应和致畸作用。
分類
[编辑]傳統分類
[编辑]- A 型(Augmented,增強的):與藥理效應增強有關,因此,與劑量相關且可預測[6]
- A 型反應,約占所有藥物不良反應的 80%,通常是藥物主要藥理效應的結果(例如,使用抗凝血劑華法林時出血)或藥物的治療指數偏低(例如,地高辛引起的噁心),因此是可以預測的。它們與劑量有關,通常輕微,儘管嚴重時可能可能致命(例如,華法林引起的顱內出血)。這類反應常源於不合適的劑量,特別是藥物代謝不良時。「副作用」通常可能算是輕微的 A 型反應[7]。
- B 型(Bizarre,不尋常的):B 型反應與藥物的藥理機轉無關,劑量愈高發生的機會不一定愈高,常常不可預測,因此被稱為特異體質性[6]。這類反應可能源自人體或環境特性[8],且常與免疫或發炎反應有關。
A 和 B 型反應是在 1970 年代提出[9],當這兩種類型不足以區分所有藥物不良反應時,也依序產生其他類型[10]。
藥物不良反應的其他類型分別是 C 型(Chronic,慢性的)、D 型(Delayed,延遲的)、E 型(End-of-treatment,停藥後的)和 F 型(Failure of efficacy,治療失敗)[11]。C 型是慢性藥物不良反應,與長期使用後的累積劑量有關,因此,與使用的「劑量」及「持續時間有關」;D 型為延遲型藥物不良反應,雖劑量有關,但與藥物累積無關,只是常在用藥後的數月或數年後才發生;E 型是戒斷型藥物不良反應,如:停用成癮藥物後,發生的反應;F 型是治療失敗型藥物不良反應。藥物不良反應也依時間的相關性、劑量相關性和易感性分類,這些統稱為 DoTS 分類[11]。
嚴重性
[编辑]美国食品药品监督管理局將發生以下結果的患者定義為嚴重不良事件 [12]:
- 死亡
- 危及生命
- 住院(初次或延長)
- 殘疾 - 患者身體功能/結構、身體活動或生活品質,發生顯著的、持續的或永久的變化、損傷、損壞或失能。
- 先天異常
- 需要治療處置,以防止永久的失能或傷害
嚴重性是一種衡量不良事件嚴重度的方式[13]。在討論不良事件時,非常嚴重(severe)和嚴重(serious)在技術上完全不同[13]。 它們容易混淆,且不能互換使用,使用時需小心[13]。嚴重性通常表示患者的結果(如:負面結果,包括:殘疾、長期的不良反應和死亡)[13]。
如果頭痛引起劇烈疼痛,則頭痛是非常嚴重的。有類似「視覺模擬量表」的工具可以幫助臨床醫生評估嚴重性。另一方面,頭痛並不是非常嚴重(但可能發生蛛网膜下腔出血、硬膜下血肿、甚至是偏頭痛也可能暫時符合標準),除非它同時符合上述的嚴重性標準。
在藥物不良反應中,報告不良反應的嚴重性很重要[13]。
不良反應的六個面向
[编辑]副作用
[编辑]副作用(side effect):指药物在治疗剂量下使用所产生的与治疗无关的不适反应(例如:有人使用抗組織胺藥後會嗜睡)
副作用的表现一般较轻,常為可逆的功能性变化。产生原因常與药物的选择性低,作用范围广有關,在治疗中只利用其中的部分作用,而其余的作用就成了副作用。副作用是个相对概念,针对不同疾病而改变该药物的治疗目的时,副作用可与治疗作用相互转化。如阿托品类药物可抑制腺体分泌,解除平滑肌痉挛,加快心率等作用。在全身麻醉中使用阿托品抑制患者腺体的分泌,但也因同時具有解除平滑肌痉挛和加快心率的作用,造成患者腹胀或尿潴留等副作用。而在使用阿托品解除平滑肌痉挛时,因其抑制腺体分泌和加快心率引起的口干和心悸则成为了副作用[3]。
毒性反应
[编辑]毒性反应(toxic reaction)是指用药剂量过大或长期用药引起的不良反应。因药物剂量过大而立即发生的毒性称为急性毒性(acute toxicity);因长期用药而逐渐表现出的毒性作用称为慢性毒性(chronic toxicity)[3]。
毒性反应与副作用在性质和程度上不同。其主要表现在对中枢神经系统、消化系统、循环系统等系统,及肝功能、肾功能等器官造成功能性或器质性的损害,对患者的危害程度较大[3]。
毒性反应一般仅在超过规定用药剂量时才会出现,个别患者由于其遗传缺陷、病理状态或与其他药物合并使用等原因时,在治疗剂量下使用药物就已会出现毒性反应[3]。
每种药物都有其独特的毒性反应,是可预期的。在临床使用对肝、肾功能有损害的药物时,应定时的对患者的肝肾功能进行检测,并注意用药的剂量大小和间隔时间,适时停药换药[3]。
過敏反应
[编辑]過敏反应(allergic reaction)是机体受到药物刺激后,产生异常的免疫反应引起之生理功能障碍或组织损伤[3]。
某些具有半抗原性的低分子物质能与机体内的高分子载体蛋白结合形成完全抗原,如抗生素、磺胺类药物、阿司匹林等。而某些生物制剂本身就是完全抗原,即可引起免疫反应。该免疫反应与剂量的大小关系不大,与患者的体质有关。变态反应仅出现于少数具过敏体质患者身上,其反应的类型和程度也不尽相同,不易预知[3]。
過敏反应通常分为4个类型:
速發型
[编辑]- I型過敏反應
Ⅰ型过敏反应是由于青霉素、普鲁卡因、链霉素、头孢菌素、有机碘、免疫血清等过敏原引起的过敏反应,如过敏性休克、外源性支气管哮喘、麻疹、血管神经性水肿、食物过敏等[3]。
- II型細胞毒殺過敏反應
Ⅱ型溶细胞反应是由于奎宁、磺胺类药物、氯霉素、硫脲嘧啶、甲基多巴等药物引起的抗红细胞的自身抗体反应,如自體免疫溶血性貧血、嗜中性白血球低下、特发性血小板减少性紫癜、输血反应等[3]。
- III型免疫复合物反应
Ⅲ型免疫复合物反应,如血清病、类风湿性关节炎、内源性支气管哮喘等[3]。
迟發型
[编辑]- IV型過敏反应
Ⅳ型過敏反应是由于磺胺类药物、氯霉素等药物所致的過敏反应,如接触性皮炎、药热、移植排斥反应[3]。
继发性反应
[编辑]继发性反应(secondary reaction)是由于药物治疗作用引起的不良后果。如长期使用四环素类广谱抗生素造成的会导致肠道内的菌群平衡遭到破坏,以致于一些耐药性的葡萄球菌大量繁殖而引起葡萄球菌假性肠炎;或使白色念珠菌等真菌大量繁殖。这样的继发性感染也称为二重感染[3]。
后遗效应
[编辑]后遗效应(residual effect)是有些药物在停药后血药浓度已经降低到最低有效浓度以下,但仍能残存生物效应。如长期服用长时间作用的巴比妥类催眠药后,次晨会出现困倦、头昏、乏力等类似宿醉的后遗作用。少数药物大剂量使用,偶尔可能导致永久性耳聋,如呋塞米、链霉素等[3]。
致畸作用
[编辑]致畸作用(teratogeneisis)是有些药物会影响胎儿的正常发育而导致畸胎。如沙利度胺(Thalidomide)会导致胎儿四肢短小[3]。
位置
[编辑]不良反应可能是局部的,例如:局限在某一特定位置;或是全身性的,當藥物由循環系統產生不良反應。
例如,一些降眼壓藥物會引起全身性反應[14],儘管它們是以眼藥水的形式局部使用,但仍有一部分進入全身循環。
機轉
[编辑]
隨著研究更清楚地顯示藥物使用時產生的生物化學反應,B 型藥物不良反應變少,而發現更多屬於 A 型。常見的機轉包括:
藥物動力學異常
[编辑]共病狀態
[编辑]各種疾病,特別是那些導致腎或肝功能不全,可能會改變藥物的代謝。可參考資料,瞭解疾病狀態造成的藥物代謝變化[15]。
癡呆症患者的共病狀況用藥適宜性工具(英語:The Medication Appropriateness Tool for Comorbid Health Conditions in Dementia,(MATCH-D))[16]準則提醒失智症患者更有可能經歷不良反應,且他們不大可能可靠地說明症狀[17]。
遺傳因素
[编辑]药物基因组学包括以基因預測可能潛在的藥物不良反應[18]。然而,藥物基因組學不限於(任何類型)不良事件,並討探基因是如何影響藥物的其他反應,例如:低效/無效,或預期/正常反應(特別是根據藥物的代謝)[18]。
藥物代謝異常可能源自遺傳因素,影響到第一相氧化或第二相結合反應[19][20]。
第一相反應
[编辑]第一相反應包括由細胞色素P450進行的代謝[21]。由於遺傳了異常的等位基因或由於藥物交互作用,患者的細胞色素P450的代謝可能出現異常。可在表格中查詢影響到P450反應的藥物交互作用[22][23]。遺傳了異常的丁酰膽鹼酯酶(偽膽鹼酯酶)可能會影響藥物的代謝,例如,琥珀胆碱[24]。
第二相反應
[编辑]N-乙酰轉移酶會使一些藥物發生結合反應並促進排泄,而遺傳了異常的酶可能會影響藥物的代謝,例如:异烟肼、肼屈嗪和普鲁卡因胺[23][24]。
遺傳了異常的硫嘌呤甲基转移酶,可能會影響硫嘌呤類藥物的代謝,如:巯嘌呤和硫唑嘌呤[23]。
蛋白結合
[编辑]蛋白結合產生的交互作用通常短暫且輕微,直到達到新的穩態[25][26]。主要適用於肝臟首過效應代謝不多的藥物。血漿中與藥物結合的主要蛋白有[27]:
一些與華法林發生藥物交互作用的藥物,就是由於蛋白結合的變化[27]。
藥物相互作用
[编辑]藥物加成效應
兩種或更多種藥物,如果在體內有相同的作用機轉,同時使用時可能會產生毒性或不良反應的加成效應。例如,同時使用多種會延長QT間期的藥物,像是抗心律失常药,如索他洛爾和一些大環內酯類抗生素,如全身性阿奇霉素[29]。另一個例子是血清素上升產生的毒性,又稱血清素综合症[30]。若合併使用會增加血清素的藥物,可能會導致血清素毒性(雖然,單獨使用一種會增加血清素濃度的藥物,在治療劑量,也曾出現產生毒性的案例)[30]。一些可能導致血清素毒性的藥物,包括单胺氧化酶抑制剂,选择性5-羟色胺再摄取抑制剂和三环类抗抑郁药[30]。
代謝改變
某些藥物可以抑制或誘導關鍵药物代谢酶或藥物運輸蛋白,當與其他利用相同蛋白的藥物併用時,可能導致毒性或療效下降等不良反應。例如:當患者同時服用細胞色素 P450 3A4(CYP3A4)抑制劑,如:抗生素克拉黴素,和另一種由 CYP3A4 代謝的藥物,如:抗凝剂阿哌沙班,將增加阿哌沙班的血中濃度與嚴重出血的風險[31]。此外,克拉黴素是一種通透性糖蛋白(P-gp)的外排幫浦抑制劑(efflux pump inhibitor, EPI),當與阿哌沙班(P-gp 的底質,會透過它排出)併用時,會增加阿哌沙班的吸收,產生與 CYP3A4 抑制相同的不良反應[31]。
評估因果關係
[编辑]以因果關係評估來確定藥物是否引起了懷疑的藥物不良反應[4]。有許多不同的方法用於判斷因果關係,包括納蘭霍算法、威努萊特算法和世界衛生組織的因果關係評估標準。每種方法的使用都有其利弊,且應用時大多數需要一定的專業判斷[32]。除非透過挑戰-去挑戰-再挑戰方式(停用和再開始使用懷疑的藥物)確認,否則不應將藥物不良反應標記為「確定」[4]。懷疑的藥物不良反應,它的發病時間序很重要,因為其他物質或因素可能被認為是原因;共同處方的藥物和潛在的精神疾患可能是藥物不良反應的因素[4] 。
將因果關係歸因於特定的藥物通常很困難,除非是在臨床研究或大型數據庫中發現不良事件。兩種方法各有難處,且可能充滿錯誤。即使在臨床研究中,也可能會錯過一些藥物不良反應,因為要找到特定的藥物不良反應,特別是那些罕見的,就需要大量的受試個案。精神病相關的藥物不良反應需透過評估人群的問卷中,分組收集通常因此常常缺失[33][34]。
監控機構
[编辑]許多國家都有官方機構監控藥物的安全和反應。國際層級上,世界衛生組織下的烏普薩拉監控中心[35]。歐洲聯盟運營的歐洲藥品管理局(EMA)[36]。在美國,食品藥品監督管理局(FDA)負責監控上市後研究[37]。FDA 的報告系統名為FDA 不良事件報告系統,個人也能用它報告藥物不良事件[37]。醫療專業人員、消費者和製藥業都可以利用這個系統提交不良事件[37]。在加拿大銷售的健康產品,由加拿大衛生部轄下的加拿大警戒計劃負責監控不良反應[38]。醫療專業人員和消費者都可利用這個系統報告[38]。在澳大利亞,由治療商品管理局 (TGA) 進行治療產品的上市後監控[39]。在英國,在1964年成立名為黃牌計劃的監控系統[40],來監控藥物和其他健康產品的安全[41]。
流行病學
[编辑]2011 年美國醫療研究和品質機構 (AHRQ) 的一項研究發現,鎮靜劑和安眠药是醫院中見的藥物不良事件主要來源。大約 2.8% 在入院時已存在及 4.4% 發生在住院期間的不良反應是由鎮靜劑或安眠藥引起[42]。AHRQ 的第二個研究發現,2011 年在美國醫院住院期間發生,可以確認特定原因的藥物不良事件中包括類固醇、抗生素、鴉片類/麻醉藥和抗凝剂。城市地區的教學與非教學醫院相比,病人有較高比率發生與抗生素和鴉片類/麻醉藥的藥物不良事件。在私立、非營利醫院接受治療的病人,與在不論是公立或私立的營利醫院相比,發生藥物不良事件的比率較高[43]。
藥物相關傷害(Medication related harm,MRH)常見於老年人出院後,但受限於不一致的研究方法和缺乏風險因素數據,我們對藥物相關傷害的流行病學缺乏一個清晰的理解。發生率占參與者的 0.4% 到 51.2%,其中 35% 到 59% 的傷害是可預防的。出院後 30 天內的藥物相關傷害發生率,每 1000 個出院患者中約有 167 到 500 事件 (約占人數的 17-51%)[44]。
2011 年在美國,阿片剂和麻醉藥物的藥物不良事件,女性比男性的發生率高;而男性患者發生抗凝剂的不良事件率較高。每 1000 名 65 歲或以上的老人中就有接近 8 位在住院期間經歷了四種最常見的不良事件之一(類固醇、抗生素、鴉片類/麻醉劑和抗凝劑)[43]。一個研究顯示,48% 的患者對至少一種藥物有藥物不良反應,且藥師的參與有助於發現藥物不良反應[45]。
2012 年,麥肯錫公司總結在 50-100 百萬可預防的錯誤相關藥物不良事件的成本約在 180-1150 億美元間[46]。
2016 年,《美國醫學會雜誌》 發表的一篇研究報告 2013-2014 年美國各地急诊室的藥物不良事件統計數據[47]。此研究估計因藥物不良事件到急診的盛行率是每 1000 人中有 4 件[47],其中有 57.1% 是女性;此外,其中 17.6% 來自抗凝血劑,16.1% 來自抗生素,13.3% 來自糖尿病藥物[47]。
历史上重大的药物不良反应事件
[编辑]- 反应停事件:20世纪50年代,由德国研制、用于缓解妊娠反应的新药沙利度胺在欧洲和日本等20多个国家造成了12000多个胎儿缺手缺臂畸形,还致1300人患多發性神經炎,1961年反应停被禁用。而由于FDA复杂和严格的新药申报手续,该药直至1961年仍未获准在美国本土上市,使美国无数家庭免受其害。反应停事件之后世界各国纷纷制定严格的药物不良反应申报程序,如英国的「黃牌計劃」,这些申报制度为安全用药收集了重要的基本数据[48][49]。
- 苯甲醇-臀肌挛缩症:由于苯甲醇具有止痛作用,20世纪后期,苯甲醇广泛用作青霉素钾盐的溶劑,以减缓青霉素钾盐肌肉注射所导致的剧痛。2005年SFDA发文禁止苯甲醇作为青霉素钾的注射溶媒。多年后,单中国大陆就发生注射部位臀大肌萎缩者约为1000万例,主要临床表现为步态异常,双侧并列呈八字形,不能翘“二郎腿”,站立式双下肢轻度外旋,双膝分开呈现“蛙形腿”,体检时可见臀部注射部位皮肤凹陷或臀部正常外形消失。[50]
參見
[编辑]参考文献
[编辑]- ^ 1.0 1.1 1. Glossary. Guideline For Good Clinical Practice. International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use. 1996-06-10 [2022-04-16]. (原始内容存档于2023-03-18).
- ^ Adverse Drug Reaction (Code C142385). Enterprise Vocabulary Services. National Cancer Institute. 2019-05-28 [2023-10-27]. (原始内容存档于2023-10-28).
- ^ 3.00 3.01 3.02 3.03 3.04 3.05 3.06 3.07 3.08 3.09 3.10 3.11 3.12 3.13 3.14 3.15 李端 殷明. 药理学. 人民卫生出版社. 9-11. ISBN 978-7-117-08905-0
- ^ 4.0 4.1 4.2 4.3 4.4 4.5 4.6 Nebeker JR, Barach P, Samore MH. Clarifying adverse drug events: a clinician's guide to terminology, documentation, and reporting
 . Improving patient care. Annals of Internal Medicine. May 2004, 140 (10): 795–801 [2024-01-09]. PMID 15148066. S2CID 32296353. doi:10.7326/0003-4819-140-10-200405180-00009. (原始内容存档于2023-10-28).
. Improving patient care. Annals of Internal Medicine. May 2004, 140 (10): 795–801 [2024-01-09]. PMID 15148066. S2CID 32296353. doi:10.7326/0003-4819-140-10-200405180-00009. (原始内容存档于2023-10-28). - ^ 5.0 5.1 Why You Need to Take Your Medications as Prescribed or Instructed. Food and Drug Administration. 2016-02-16 [2023-10-27]. (原始内容存档于2024-01-16).
- ^ 6.0 6.1 Coleman JJ, Pontefract SK. Adverse drug reactions. Clinical Medicine. October 2016, 16 (5): 481–485. PMC 6297296
 . PMID 27697815. doi:10.7861/clinmedicine.16-5-481
. PMID 27697815. doi:10.7861/clinmedicine.16-5-481  .
. - ^ Ritter JM. A Textbook of Clinical Pharmacology and Therapeutics. Great Britain: CRC Press. 2008: 62. ISBN 978-0-340-90046-8.
- ^ Iasella CJ, Johnson HJ, Dunn MA. Adverse Drug Reactions: Type A (Intrinsic) or Type B (Idiosyncratic). Clinics in Liver Disease. February 2017, 21 (1): 73–87. PMID 27842776. doi:10.1016/j.cld.2016.08.005.
- ^ Rawlins MD, Thompson JW. Pathogenesis of adverse drug reactions.. Davies DM (编). Textbook of adverse drug reactions.. Oxford: Oxford University Press. 1977: 10.
- ^ Aronson JK. Drug therapy. Haslett C, Chilvers ER, Boon NA, Colledge NR, Hunter JA (编). Davidson's principles and practice of medicine 19th. Edinburgh: Elsevier Science. 2002: 147–163.
- ^ 11.0 11.1 Aronson JK, Ferner RE. Joining the DoTS: new approach to classifying adverse drug reactions. BMJ. November 2003, 327 (7425): 1222–1225. PMC 274067
 . PMID 14630763. doi:10.1136/bmj.327.7425.1222.
. PMID 14630763. doi:10.1136/bmj.327.7425.1222. - ^ What is a Serious Adverse Event?. U.S. Food & Drug Administration. 2016-02-01 [2023-04-17]. (原始内容存档于2018-01-25).
- ^ 13.0 13.1 13.2 13.3 13.4 ICH E2A Clinical safety data management: definitions and standards for expedited reporting - Scientific guideline (PDF). European Medicines Agency. 1995-06-01 [2023-04-30]. (原始内容存档 (PDF)于2022-07-28) (英语).
- ^ Rang HP. Pharmacology. Edinburgh: Churchill Livingstone. 2003. ISBN 978-0-443-07145-4. Page 146
- ^ Clinical Drug Use. [2007-09-18]. (原始内容存档于2007-11-01).
- ^ MATCH-D Medication Appropriateness Tool for Comorbid Health conditions during Dementia. www.match-d.com.au. [2019-06-01]. (原始内容存档于2019-05-18).
- ^ Page AT, Potter K, Clifford R, McLachlan AJ, Etherton-Beer C. Medication appropriateness tool for co-morbid health conditions in dementia: consensus recommendations from a multidisciplinary expert panel. Internal Medicine Journal. October 2016, 46 (10): 1189–1197. PMC 5129475
 . PMID 27527376. doi:10.1111/imj.13215.
. PMID 27527376. doi:10.1111/imj.13215. - ^ 18.0 18.1 Roden DM, Van Driest SL, Brunton LL, Knollmann BC. Pharmacogenetics and Pharmacogenomics. Goodman & Gilman's the pharmacological basis of therapeutics 14th. New York: McGraw Hill. 2023. ISBN 978-1-264-25807-9. OCLC 1323328254.
- ^ Phillips KA, Veenstra DL, Oren E, Lee JK, Sadee W. Potential role of pharmacogenomics in reducing adverse drug reactions: a systematic review. JAMA. November 2001, 286 (18): 2270–9. PMID 11710893. doi:10.1001/jama.286.18.2270.
- ^ Goldstein DB. Pharmacogenetics in the laboratory and the clinic. The New England Journal of Medicine. February 2003, 348 (6): 553–6. PMID 12571264. doi:10.1056/NEJMe020173.
- ^ Hakkola J, Hukkanen J, Turpeinen M, Pelkonen O. Inhibition and induction of CYP enzymes in humans: an update. Archives of Toxicology. November 2020, 94 (11): 3671–3722. PMC 7603454
 . PMID 33111191. doi:10.1007/s00204-020-02936-7.
. PMID 33111191. doi:10.1007/s00204-020-02936-7. - ^ Flockhart DA, Thacker D, McDonald C, Desta Z. The Flockhart Cytochrome P450 Drug-Drug Interaction Table.. Division of Clinical Pharmacology. Indiana University School of Medicine. 2021 [2023-05-01]. (原始内容存档于2023-03-27).
- ^ 23.0 23.1 23.2 Weinshilboum R. Inheritance and drug response. The New England Journal of Medicine. February 2003, 348 (6): 529–537. PMID 12571261. doi:10.1056/NEJMra020021
 .
. - ^ 24.0 24.1 Evans WE, McLeod HL. Pharmacogenomics--drug disposition, drug targets, and side effects. The New England Journal of Medicine. February 2003, 348 (6): 538–49. PMID 12571262. doi:10.1056/NEJMra020526.
- ^ DeVane CL. Clinical significance of drug binding, protein binding, and binding displacement drug interactions. Psychopharmacology Bulletin. 2002, 36 (3): 5–21. PMID 12473961.
- ^ Benet LZ, Hoener BA. Changes in plasma protein binding have little clinical relevance. Clinical Pharmacology and Therapeutics. March 2002, 71 (3): 115–21. PMID 11907485. S2CID 6948454. doi:10.1067/mcp.2002.121829.OVID full text summary table at OVID (页面存档备份,存于互联网档案馆)
- ^ 27.0 27.1 Sands CD, Chan ES, Welty TE. Revisiting the significance of warfarin protein-binding displacement interactions. The Annals of Pharmacotherapy. October 2002, 36 (10): 1642–4 [2007-09-18]. PMID 12369572. S2CID 20855578. doi:10.1345/aph.1A208. (原始内容存档于2008-09-07).
- ^ Kim J, Parish AL. Polypharmacy and Medication Management in Older Adults. The Nursing Clinics of North America. September 2017, 52 (3): 457–468. PMID 28779826. doi:10.1016/j.cnur.2017.04.007.
- ^ Drug-Induced Prolongation of the QT Interval and Torsades de Pointes. Lexicomp. 2023-04-29 [2023-05-02]. (原始内容存档于2024-01-18).
- ^ 30.0 30.1 30.2 Curry SC, O'Connor AD, Graeme KA, Kang AM. Chapter 13: Neurotransmitters and Neuromodulators. Nelson LS, Howland MA, Lewin NA, Smith SW, Goldfrank LR, Hoffman RS (编). Goldfrank's toxicologic emergencies 11th. McGraw Hill. 2019. ISBN 978-1-259-85961-8 (英语).
- ^ 31.0 31.1 Mar PL, Gopinathannair R, Gengler BE, Chung MK, Perez A, Dukes J, et al. Drug Interactions Affecting Oral Anticoagulant Use. Circulation: Arrhythmia and Electrophysiology. June 2022, 15 (6): e007956. PMC 9308105
 . PMID 35622425. doi:10.1161/CIRCEP.121.007956.
. PMID 35622425. doi:10.1161/CIRCEP.121.007956. - ^ Davies EC, Rowe PH, James S, Nickless G, Ganguli A, Danjuma M, et al. An Investigation of Disagreement in Causality Assessment of Adverse Drug Reactions. Pharm Med. 2011, 25 (1): 17–24 [2011-06-02]. S2CID 37301370. doi:10.1007/bf03256843. (原始内容存档于2012-07-01).
- ^ Holvey C, Connolly A, Taylor D. Psychiatric side effects of non-psychiatric drugs. British Journal of Hospital Medicine. August 2010, 71 (8): 432–6. PMID 20852483. doi:10.12968/hmed.2010.71.8.77664.
- ^ Otsubo T. [Psychiatric complications of medicines]. Ryoikibetsu Shokogun Shirizu. 2003, (40): 369–73. PMID 14626141.
- ^ Uppsala Monitoring Centre. The WHO Programme for International Drug Monitoring. who-umc.org. [2023-04-17]. (原始内容存档于2023-12-02) (英语).
- ^ Pharmacovigilance: post-authorisation. European Medicines Agency. 2018-09-17 [2023-04-17]. (原始内容存档于2023-09-26) (英语).
- ^ 37.0 37.1 37.2 Questions and Answers on FDA's Adverse Event Reporting System (FAERS). U.S. Food & Drug Administration. 2018-06-04 [2023-04-16]. (原始内容存档于2024-01-10).
- ^ 38.0 38.1 Canada Vigilance Program. Government of Canada. 2008-01-24 [2023-04-16]. (原始内容存档于2023-12-04) (English).
- ^ How we regulate medicines. Australian Government Department of Health and Aged Care Therapeutic Goods Administration. 2019-06-20 [2023-05-02]. (原始内容存档于2023-12-31).
- ^ Yellow Card Scheme looks to the future at 50th anniversary forum. GOV.UK. [2023-04-30]. (原始内容存档于2023-09-27) (英语).
- ^ Information | Making medicines and medical devices safer. yellowcard.mhra.gov.uk. [2023-04-30]. (原始内容存档于2023-11-27).
- ^ Weiss AJ, Elixhauser A. Origin of Adverse Drug Events in U.S. Hospitals, 2011 (HCUP Statistical Brief #158). Rockville, MD: Agency for Healthcare Research and Quality. July 2013 [2024-01-14]. PMID 24228291. (原始内容存档于2016-04-07).
- ^ 43.0 43.1 Weiss AJ, Elixhauser A. Characteristics of Adverse Drug Events Originating During the Hospital Stay, 2011 (HCUP Statistical Brief #164). Rockville, MD: Agency for Healthcare Research and Quality. October 2013 [2013-11-11]. (原始内容存档于2016-12-24).
- ^ Parekh N, Ali K, Page A, Roper T, Rajkumar C. Incidence of Medication-Related Harm in Older Adults After Hospital Discharge: A Systematic Review (PDF). Journal of the American Geriatrics Society. September 2018, 66 (9): 1812–1822 [2024-01-14]. PMID 29972591. S2CID 49678401. doi:10.1111/jgs.15419. (原始内容存档 (PDF)于2023-07-09).
- ^ Yeung EY. Adverse drug reactions: a potential role for pharmacists. The British Journal of General Practice. October 2015, 65 (639): 511.1–511. PMC 4582849
 . PMID 26412813. doi:10.3399/bjgp15X686821.
. PMID 26412813. doi:10.3399/bjgp15X686821. - ^ Ebel T, George K, Larsen E, Neal E, Shah K, Shi D. Strength in unity:The promise of global standards in healthcare (PDF). gs1.org. McKinsey & Company. October 2012 [2022-10-28]. (原始内容存档 (PDF)于2022-06-19).
- ^ 47.0 47.1 47.2 Shehab N, Lovegrove MC, Geller AI, Rose KO, Weidle NJ, Budnitz DS. US Emergency Department Visits for Outpatient Adverse Drug Events, 2013-2014. JAMA. November 2016, 316 (20): 2115–2125. PMC 6490178
 . PMID 27893129. doi:10.1001/jama.2016.16201.
. PMID 27893129. doi:10.1001/jama.2016.16201. - ^ Vargesson, Neil. “Thalidomide-induced teratogenesis: history and mechanisms.” Birth defects research. Part C, Embryo today : reviews vol. 105,2 (2015): 140–56. doi:10.1002/bdrc.21096
- ^ Bren L. Frances Oldham Kelsey: FDA Medical Reviewer Leaves Her Mark on History. FDA Consumer (U.S. Food and Drug Administration). 2001-02-28 [2009-12-23]. (原始内容存档于2011-06-29).
- ^ 李俊. 临床药理学.Clinical Pharmacology(第五版). 北京: 人民卫生出版社. 2013-3 [2017-9]. ISBN 978-7-117-16993-6 (中文(中国大陆)).
延伸閱讀
[编辑]- Incidence of adverse drug reactions in human immune deficiency virus-positive patients using highly active antiretroviral therapy (页面存档备份,存于互联网档案馆) PMC 3312730



 French
French Deutsch
Deutsch