Tinción , la enciclopedia libre

Una tinción o coloración es una técnica auxiliar utilizada en microscopía para mejorar el contraste en la imagen vista al microscopio. Los colorantes y tinturas son sustancias que usualmente se utilizan en biología y medicina para resaltar estructuras en tejidos biológicos que van a ser observados con la ayuda de diferentes tipos de microscopios. Los diferentes colorantes pueden ser utilizados para aumentar la definición y examinar grandes cortes de tejido (resaltando por ejemplo fibras musculares o tejido conectivo), poblaciones celulares (por ejemplo clasificando diferentes células sanguíneas) o incluso para resaltar orgánulos dentro de células individuales.
En bioquímica, esto implica agregar un colorante específico (esto significa que se una de manera selectiva ya sea a ADN, proteínas, lípidos, carbohidratos, etc.) a un sustrato para cualificar o cuantificar la presencia de un determinado compuesto. Tanto la tinción como el marcado fluorescente pueden servir para los mismos propósitos.
Diferentes tipos de tinciones biológicas son utilizadas también para marcar células en citometría de flujo y para marcar proteínas o ácidos nucleicos en electroforesis en gel.
Las tinciones no están limitadas a su uso en materiales biológicos, también pueden ser utilizadas para estudiar la morfología de otros materiales (por ejemplo, las estructuras lamelares de polímeros semicristalinos de las estructuras de dominio de bloques de copolímeros).
Tinción in vivo e in vitro
[editar]Una tinción in vivo (tinción vital) es el proceso de teñir tejidos vivos. Al provocar que determinadas células o estructuras adquieran los colores de contraste, se puede estudiar su ubicación y morfología mientras están desempeñando su función. El propósito más común es revelar detalles de la citoestructura que de otra manera no resultarían evidentes, sin embargo, la tinción vital puede revelar además donde aparece un determinado producto químico o donde se lleva a cabo una determinada reacción química dentro de las células o tejidos.
A menudo estas tinciones son llamadas tinciones vitales. Se introducen en el organismo mientras las células aún se encuentran vivas. Para conseguir el efecto deseado, el colorante usualmente se utiliza en soluciones muy diluidas que van entre 1:5.000 a 1:50.000. A pesar de esto las tinciones son eventualmente tóxicas para los organismos, algunas más que otras.
Una tinción in vitro o "supravital" involucra el coloreo de células o estructuras que han sido removidas de su contexto biológico. Se utiliza a menudo una combinación de varios colorantes para revelar más detalles y características de las que se obtendrían con la utilización de uno solo. Combinados con protocolos específicos de fijación y de preparación de muestras, los científicos y profesionales de la salud pueden utilizar estas técnicas estandarizadas como una herramienta diagnóstica repetible y consistente. Una contratinción es una tinción que consigue que las células o estructuras sean más visibles, cuando no se consigue que sean totalmente visibles con la tinción principal.
Por ejemplo, el cristal violeta tiñe únicamente a las bacterias Gram positivas en la tinción de Gram. Se utiliza una contratinción de safranina (que colorea todas las células), para permitir también la identificación de bacterias Gram negativas.
Es de notar que muchas tinciones pueden ser utilizadas tanto en células vivas como en células fijadas.
Métodos de tinción in vitro
[editar]Preparación
[editar]Las etapas preparatorias involucradas en una tinción van a depender del tipo de análisis planeado; bajo estas premisas se puede considerar que algunos o todos de los siguientes pasos podrían requerirse.
- Fijación: de por sí, esta etapa puede consistir en varios pasos. La fijación es una modificación de las propiedades fisicoquímicas de las proteínas que forman una célula o tejido y que tiene por finalidad preservar las formas de las células o tejidos tanto como sea posible. A veces se puede utilizar una fijación por calor para matar, adherir y alterar un espécimen de modo que acepte la tinción. La mayor parte de las veces se utiliza un fijador químico. Los fijadores químicos en general causan la formación de enlaces cruzados entre proteínas, o entre proteínas y otras sustancias presentes en la muestra, incrementando su resistencia mecánica. Entre los fijadores químicos más comunes se encuentran el formaldehído, etanol, metanol, y/o el ácido pícrico. Pequeños bloques de tejido pueden ser embebidos en parafina o algún polímero, proceso conocido como inclusión, para incrementar su resistencia y estabilidad, y para hacer más fácil cortarlos en rodajas extremadamente delgadas, ya que cuanto más delgado es un corte histológico, más definición se obtiene en las imágenes microscópicas.
- Permeabilización este paso implica el tratamiento de las células con un surfactante suave. Este tipo de tratamiento tiene como finalidad disolver la membrana celular para permitir que las grandes moléculas de colorante puedan acceder a las estructuras del interior de las células.
- Montaje frecuentemente implica adherir los cortes histológicos a un portaobjetos de vidrio para su observación al microscopio o análisis. En algunos casos, se puede cultivar a las células directamente sobre le portaobjetos. En muestras de células sueltas, como las que se presentan en un extendido de sangre o de fluidos biológicos, la muestra puede ser aplicada directamente sobre el portaobjetos. Para piezas de tejido de mayor tamaño, se utiliza un micrótomo que corta la muestra en rodajas sumamente delgadas. Estas rodajas son luego adheridas al portaobjetos por medio de una substancia que funciona como pegamento, ya sea una resina transparente, gelatina o clara de huevo. El montaje tiene por finalidad aumentar la resistencia mecánica de una muestra que de otra manera sería extremadamente frágil, para que soporte el proceso de teñido conservando lo más posible su estructura original.
Tinción adecuada
[editar]En su forma más simple, el verdadero proceso de tinción puede implicar la inmersión de la muestra (antes o después de la fijación y el montaje) en la solución colorante, seguido del aclarado que es un lavado para eliminar el exceso de colorante y la observación. Muchos tintes, sin embargo, requieren del uso de un mordiente, esto es, un compuesto químico que reacciona con el colorante para formar un precipitado coloreado insoluble. Cuando la solución de colorante en exceso se elimina durante el aclarado, la tinción mordentada permanece.
La mayoría de los colorantes utilizados en microscopía se encuentran disponibles como colorantes certificados. Esto significa que los colorantes ofrecidos por el fabricante han sido evaluados por un organismo independiente, la Biological Stain Commission, y que este organismo ha determinado que el producto ofrecido cumple o excede ciertos estándares de pureza, concentración de sustancia colorante y desempeño en las técnicas de tinción empleadas. Estos estándares son publicados detalladamente en la revista Biotechnic & Histochemistry.[1] Muchos colorantes presentan una composición diferente entre diferentes fabricantes. La utilización de colorantes certificados elimina una fuente de resultados inesperados.[2]
Tinción directa
[editar]Hablamos de tinción directa cuando el colorante interacciona directamente con el sustrato, sin otro tratamiento previo.
Tinción indirecta
[editar]Se denomina de este modo a las tinciones que hacen uso de un mordiente. Un mordiente habitual es el ácido tánico.[3]
Afinidad de diferentes tejidos por diferentes colorantes
[editar]Cuando un tejido u estructura subcelular presenta una afinidad por un determinado colorante se suele designar por los sufijos -filo o -fílico. Por ejemplo, los tejidos que se tiñen con azure suelen ser nombrados como azurófilos o azurofílicos. También puede ser utilizado para designar propiedades tintoriales más generalizadas, por ejemplo los tejidos que se tiñen con colorantes de naturaleza ácida (por ejemplo la eosina) suelen ser denominados como acidofílicos, basofílicos cuando se tiñen con colorantes de naturaleza básica (tales como por ejemplo el azul de metileno o la hematoxilina), y anfifílicos cuando aceptan ambos colorantes.[4] Por el contrario, los tejidos cromófobos no toman colorante con facilidad.
Tinción negativa
[editar]Un método sencillo de tinción para bacterias, que además es un claro caso de cromofobia y que por lo tanto funciona aun cuando los métodos de tinción positiva fallan, es la tinción negativa. Esto puede ser conseguido simplemente extendiendo la muestra en un portaobjetos y aplicando directamente sobre ella una gota de nigrosina o tinta china y cubriendo luego la muestra humedecida con un cubreobjetos. Luego de esto, los microorganismos pueden ser observados fácilmente por medio de microscopía en campo claro como inclusiones claras muy bien contrastadas contra el medio oscuro que las rodea.[5] Adicionalmente, la tinción negativa es una técnica suave que no destruye a los microorganismos, permitiendo por lo tanto un recultivo posterior para el estudio de patógenos.
Colorantes
[editar]La mayoría de los colorantes son compuestos orgánicos que tienen alguna afinidad específica por los materiales celulares. Muchos colorantes utilizados con frecuencia son moléculas cargadas positivamente (cationes) y se combinan con intensidad con los constituyentes celulares cargados negativamente, tales como los ácidos nucleicos y los polisacáridos ácidos. Ejemplos de colorantes catiónicos son el azul de metileno, el cristal violeta y la safranina. Otros colorantes son moléculas cargadas negativamente (aniones) y se combinan con los constituyentes celulares cargados positivamente, tales como muchas proteínas. Esos colorantes incluyen la eosina, la fucsina ácida y el rojo Congo. Otro grupo de colorantes son sustancias liposolubles; los colorantes de este grupo se combinan con los materiales lipídicos de la célula, usándose a menudo para revelar la localización de las gotículas o depósitos de grasa. Un ejemplo de colorante liposoluble es el negro Sudán. Si se desea simplemente incrementar el contraste de las células para la microscopía, son suficientes los procedimientos simples de tinción. El azul de metileno es un buen colorante simple que actúa sobre todas las células bacterianas rápidamente y que no produce un color tan intenso que oscurezca los detalles celulares. Es especialmente útil para detectar la presencia de bacterias en muestras naturales, puesto que la mayor parte del material no celular no se tiñe.
Colorantes histológicos más comunes
[editar]Los diferentes colorantes reaccionan o se concentran en diferentes partes de las células o tejidos, y estas propiedades son utilizadas como una ventaja para revelar partes o áreas específicas. Algunos de los colorantes biológicos más comunes se listan más abajo. A menos que se indique lo contrario la mayoría de estos colorantes se utilizan con células y tejidos fijados. Las tinciones vitales (que pueden ser utilizadas con organismos vivos) se encuentran destacadas.
Azul brillante de Coomassie
[editar]Azul de Coomassie (también conocido como Coomassie blue) es un colorante que tiñe en forma no específica a todas las proteínas con un fuerte color azul. Se utiliza frecuentemente para teñir las corridas de proteínas en las electroforesis en gel.
Azul de metileno
[editar]El azul de metileno se utiliza para teñir células de animales y vegetales, para hacer más visibles sus núcleos. También sirve para la observación de estructuras fúngicas en forma natural (Micelio)
Azul de Nilo
[editar]El Nile Blue o Nile blue A, es decir, azul Nilo, tiñe los núcleos de color azul. También puede ser utilizado para teñir células vivas.
Bismarck brown
[editar]Bismarck brown (Marrón Bismarck, también conocido como Bismarck brown Y o Manchester brown) imparte un color amarillo a las mucinas ácidas. Se puede utilizar con células vivas.
Bromuro de etidio
[editar]El bromuro de etidio (BE) se intercala en el ADN y le otorga un color rojo naranja fluorescente. A pesar de que no es capaz de teñir células vivas ya que no atraviesa las membranas intactas, puede ser utilizado para identificar células que se encuentran en las etapas finales de la apoptosis, ya que tales células poseen unas membranas mucho más permeables. Por el mismo motivo, el bromuro de etidio es utilizado como un marcador de apoptosis en poblaciones celulares y para localizar las bandas de ADN en una corrida en electroforesis en gel. Este colorante puede ser utilizado en combinación con naranja de acridina (NA) en el conteo de células viables. Esta tinción combinada BE/NA le otorga a las células vivas un color verde fluorescente mientras que las células apoptóticas aparecen con la distintiva fluorescencia rojo-naranja.
Carmín de Best
[editar]El carmín es un colorante natural de origen animal, de un intenso color rojo que puede ser utilizado como sal de litio para teñir glicógeno, mientras que las sales de alumbre-carmín son colorantes que se adhieren al núcleo. Las tinciones con carmín requieren del uso de un mordiente, que usualmente es aluminio o alumbre.
Cristal violeta
[editar]El cristal violeta, al ser combinado con un mordiente adecuado, tiñe las paredes celulares de color púrpura. El cristal violeta es un componente importante en la coloración de Gram.
DAPI
[editar]El DAPI es un colorante nuclear (tiñe el núcleo) fosforescente, se excita con luz ultravioleta para producir una fuerte fluorescencia azul cuando se encuentra unido al ADN. El DAPI se une a las regiones de alta repetición A=T en los cromosomas. Además no es visible cuando se utiliza con un microscopio de transmisión corriente. Puede ser utilizado en células vivas o fijadas. La técnica de tinción con DAPI es especialmente adecuada para el recuento celular.[6]
Eosina
[editar]La eosina se utiliza más frecuentemente como contracoloración de la hematoxilina, impartiendo un color que va del rosado al rojo al material citoplasmático, membrana celular, y algunas estructuras extracelulares. Además imparte un fuerte color rojo a los eritrocitos. La eosina puede ser utilizada también en algunas variantes de la coloración de Gram, y en muchos otros protocolos de tinción. De hecho existen dos compuestos muy estrechamente relacionados (aunque no iguales) conocidos como eosina. El más frecuentemente utilizado es la eosina Y (también conocida como eosina amarillenta) ya que posee una tonalidad amarillenta muy suave. El otro compuesto conocido como eosina es la eosina B, también conocida como eosina azulada o rojo imperial, la cual posee una suave tonalidad azul. Los dos colorantes son intercambiables, y el la utilización de uno u otro es más una cuestión de preferencia y tradición.
Fucsina ácida
[editar]La fucsina ácida puede ser utilizada para colorear colágeno, músculo liso o mitocondrias. Forma parte de la coloración tricrómica de Mallory donde se utiliza para colorear núcleo y citoplasma. En la tinción de Van Gieson (picrofucsina), la fucsina es la responsable de dar el color rojo a las fibras de colágeno. También es una coloración tradicional para colorear mitocondrias (método de Altmann).
Hematoxilina
[editar]La hematoxilina es un colorante nuclear. Hay variedad de ellas siempre usando la base de hematoxilina extraída del árbol palo campeche. Existe la hematoxilina de Mayer, de Harris, y otras. Utilizado con un mordiente, la hematoxilina tiñe los núcleos celulares de color azul violeta a negro. Con gran frecuencia se utiliza en combinación con eosina en la coloración H&E (hematoxilina y eosina), una de las más comunes utilizadas en histología.
Hoechst
[editar]Hoechst es un compuesto derivado bis-benzimidazol que se une al surco menor del ADN. Se utiliza con frecuencia en microscopía de fluorescencia para colorear el ADN. Hoechst tiene color amarillo cuando se encuentra disuelto en agua, y emite luz azul cuando recibe luz ultravioleta. Hay dos tipos principales de colorantes Hoechst. Hoechst 33258 y Hoechst 33342. Ambos compuestos son funcionalmente similares, aunque poseen pequeñas diferencias en su estructura. El Hoechst 33258 contiene un hidroxilo terminal, y por lo tanto es más soluble en solventes acuosos, aunque esta característica disminuye su habilidad para penetrar la membrana plasmática. El Hoechst 33342 contiene un grupo etilo en sustitución del grupo hidroxilo terminal (un grupo etileter), lo que lo hace más hidrofóbico, y con mejor penetración en la membrana plasmática.
Yodo
[editar]El yodo se utiliza en química analítica como indicador para el almidón y otros polisacáridos. Cuando se mezcla almidón con una solución de yodo, se desarrolla un color intensamente azul, representando la formación del complejo de inclusión yodo/almidón. El almidón es una sustancia muy común en la mayor parte de las células vegetales, de modo que una solución diluida de yodo puede colorear el almidón presente en las células. El yodo también es componente de la coloración de Gram utilizada en microbiología. La solución de Lugol o Lugol yoduro (IKI) es una solución de color marrón que se torna negra en presencia de almidones y puede ser utilizada para colorear células, haciendo más visible el núcleo. En la coloración de gram el yoduro se utiliza como mordiente, aumentando la capacidad del colorante para entrar en las células a través de los poros presentes en la membrana o pared celular.
Naranja de acridina
[editar]El naranja de acridina es un colorante fluorescente, catiónico y selectivo para ácidos nucleicos útil para demostraciones sobre el ciclo celular. Es capaz de atravesar la membrana celular e interactúa con el ADN y el ARN por intercalación o interacciones electrostáticas. Cuando se une al ADN presenta un espectro muy similar al de la fluoresceína. Al igual que la fluoresceína, se puede utilizar también como una tinción inespecífica para dar un trasfondo fluorescente (contraste) a tinciones convencionales en la superficie de muestras sólidas de tejidos (coloración de contraste fluorescente).[7]
Plata
[editar]Una tinción argéntica es el uso de plata para colorear preparados histológicos. Este tipo de coloración es especialmente importante para demostrar proteínas (por ejemplo el colágeno tipo III) y ADN. Se utiliza para facilitar la visualización de ambas sustancias tanto dentro como fuera de las células. También se utiliza la tinción argéntica en la electroforesis en gel en gradiente de temperatura.
Algunas células argentafines reducen las soluciones de plata a plata metálica, luego de la fijación con formalina. Este método fue descubierto por el fisiólogo italiano Camillo Golgi, utilizando una reacción entre el nitrato de plata y el dicromato de potasio, para precipitar cromato de plata en algunas células (método de Golgi).
Otras células son argirofílicas: sólo reducen la plata a su forma metálica, después de ser expuestas a una tinción que contiene un agente reductor como la hidroxiquinona o formalina.
Rodamina
[editar]La rodamina es una tinción fluorescente específica para proteínas utilizada comúnmente en microscopía fluorescente.
Rojo neutro
[editar]El rojo neutro (toluylene red) colorea de rojo a los cuerpos de Nissl. Con frecuencia se utiliza como contracoloración en otras técnicas de tinción.
Rojo Nilo
[editar]El Rojo Nilo (también conocido como oxazona del azul nilo) se produce hirviendo el Azul Nilo con ácido sulfúrico. Este tratamiento produce una mezcla de Rojo y Azul Nilo. El Rojo Nilo es una coloración lipofílica, y se acumula en los glóbulos lipídicos en el interior de las células, y los colorea de rojo. El Rojo Nilo puede utilizarse con células vivas. Fluoresce fuertemente cuando se encuentra particionado en lípidos, pero prácticamente no presenta fluorescencia en soluciones acuosas.
Safranina
[editar]La safranina (o safranina O) es un colorante nuclear. Colorea los núcleos celulares de rojo, y se utiliza principalmente como contracoloración. También puede ser utilizada para darle una coloración amarilla al colágeno.
Sudán
[editar]La coloración de Sudán se utiliza para destacar sustancias "sudanofílicas", por lo común, lípidos. También se utiliza para determinar los niveles de grasa en materia fecal para diagnosticar esteatorrea. Hay varios colorantes de la familia sudan, por ejemplo: Sudan III, Sudan IV, Oil Red O, y Sudan Black B.
Tetróxido de osmio
[editar]El tetróxido de osmio se utiliza en microscopía óptica para colorear lípidos. Se disuelve con facilidad en las grasas y se reduce a osmio metálico al interactuar con material orgánico, dejando un color marrón o negro característico.
Verde de metilo
[editar]El verde de metilo se utiliza frecuentemente en microscopia de campo claro, para teñir la cromatina de las células y facilitar así su visualización.
Verde malaquita
[editar]El verde malaquita (conocido también como diamond green B o victoria green B) puede ser utilizado como contracoloración azul-verdosa en combinación con la safranina un ejemplo es la Tinción de Schaeffer-Fulton para bacterias. También se puede utilizar directamente para colorear endosporas.
En microscopía electrónica
[editar]Al igual que en la microscopía óptica, se puede hacer uso de sustancias que aumentan el contraste en la microscopía de transmisión electrónica. Por lo general se utilizan sustancias electrondensas, o metales pesados.
Ácido fosfotúngstico
[editar]El ácido fosfotúngstico es un colorante negativo común utilizado para resaltar virus, nervios, polisacáridos, y otros tejidos y materiales biológicos.
Tetróxido de osmio
[editar]El tetróxido de osmio se utiliza en microscopía óptica para teñir lípidos. Se disuelve en grasas y se reduce por la presencia de materiales orgánicos a osmio metálico, dejando un residuo negro fácilmente visible. Debido a que es un metal pesado, que absorbe los electrones, es quizá la coloración más común para resaltar morfologías en la microscopía electrónica. También se utiliza para la tinción de varios polímeros para el estudio de los mismos por TEM. El OsO4 es muy volátil y extremadamente tóxico. Es un agente oxidante fuerte, ya que en él el osmio tiene un estado de oxidación +8. Oxida agresivamente muchos materiales, dejando un depósito de osmio no volátil en un estado de oxidación bajo.
Tetróxido de rutenio
[editar]El tetróxido de rutenio es igualmente volátil e incluso más agresivo que el tetróxido de osmio, lo que permite colorear materiales que se resisten a la coloración con osmio. Por ejemplo el polietileno.
Otros
[editar]Otros compuestos químicos utilizados en microscopía electrónica: molibdato de amonio, yoduro de cadmio, carbohidrázida, cloruro férrico, hexamina tricloruro de indio, nitrato de lantano, acetato de plomo (II), citrato de plomo, nitrato de plomo (II), ácido peryódico, ácido fosfomolíbdico, ferricianuro de potasio, ferrocianuro de potasio, rojo de rutenio, nitrato de plata, proteinato de plata, cloroaurato de sodio, nitrato de talio, tiosemicarbázida, acetato de uranilo, nitrato de uranilo y sulfato de vanadilo.[8]
Algunas de las tinciones más comunes
[editar]Nota: Esta lista incluye solo algunas de las tinciones más comunes, y no es ni con mucho completa.
| Tinción | Tipo | Características | Uso | Ejemplo |
|---|---|---|---|---|
| Hematoxilina | Básica / Acidofílica | Tiñe núcleos, ácidos nucleicos y estructuras basofílicas (mitocondrias y ribosomas) en azul. | Tinción histológica general |  |
| Eosina | Ácida / Basofílica | Tiñe proteínas y estructuras con afinidad por los ácidos en diferentes tonos de rojo | Tinción histológica general |  |
| Tinción hematoxilina-eosina | Bicomponente Anfifílica |
| Tinción histológica general |  |
| Tinción hemalumbre-eosina | Similar a la tinción H&E con colores más marcados y definidos | Tinción histológica general |  | |
| Tinción HOPS | Policromática |
|  | |
| Tinción HPS |
|  | ||
| Tinción de Papanicolau | Permite ver la cromatina con mucha claridad.
| Se utiliza para diferenciar células en muestras de secreciones biológicas (esputo, LCR, orina, etc.) y en raspados y biopsias. Permite distinguir con relativa facilidad células con transformaciones neoplásicas, levaduras y bacterias. | ||
| Tinción de Romanowsky | Pancromática de Romanowsky | Extendidos sanguíneos |  | |
| Tinción de Wright |  | |||
| Tinción de Giemsa |  | |||
| Tinción de Jenner |  | |||
| Tinción de Leishman |  | |||
| Tinción de Field |  | |||
| Tinción de May Grünwald |  | |||
| Tinción de May Grünwald-Giemsa |  | |||
| Tinción con azul brillante de cresilo | Supravital | Tiñe de azul oscuro restos de ácidos nucleicos, y los proteoglicanos ácidos en varios tonos de violeta. | Diagnóstico de anemias regenerativas Demostración de estructuras metacromáticas |  |
| Tinción de Perls | Complexométrica | Tiñe los depósitos de hemosiderina y hierro férrico de color azul-celeste | Diagnóstico de hemopoyesis ineficaz, y hemocromatosis |  |
| Tinción tricrómica de Masson | Tricrómica |
| Se tiñen fibras, tejido muscular y citoplasmas, donde destaca esencialmente el condrioma como un fino granulado rojizo. Sin embargo, por su pH ácido, que se encuentra entre 2.5 y 2.7 (ligeramente por encima del óptimo para la tinción del colágeno), se presenta como una tinción incompleta y difusa del componente fibrilar más fino (membrana basal y finas fibras reticulares). |  |
| Tinción tricrómica de Lillie | Símil tricrómica de Masson |  | ||
| Tinción tricrómica AZAN de Heidenhan | Símil tricrómica de Masson. Los citoplasmas aparecen en tonos de rojo más profundos y el conectivo en tonos más intensos de azul. |  | ||
| Tinción tricrómica de Mallory | Símil tricrómica de Masson |  | ||
| Tinción de Van Gieson |
|  | ||
| Tinción de Movat |
|  | ||
| Tinción tricrómica de Gömöri | Tricrómica Argéntica |  | ||
| Tinción de Warthin-Starry | Argéntica |  | ||
| Tinción de Von Kossa | Tiñe de tonos de marrón y negro los depósitos de fosfato inorgánico en hueso. | |||
| Tinción de Golgi |  | |||
| Tinción de Bielchowsky |  | |||
| Tinción de Jones |  | |||
| Tinciones para microbiología | ||||
| Tinción de Gram |  | |||
| Tinción de Ziehl-Neelsen |  | |||
| Tinción de Schaeffer-Fulton | Tiñe endosporas de verde y bacterias en rojo | Sirve para diferenciar endosporas y bacterias. |  | |
| Tinción de Conklin | Tiñe endosporas de verde, similar a la tinción de Schaeffer-Fulton. | |||
| Tinción de Grocott | Detección de microorganismos, en especial fúngicos. |  | ||
| Tinción de Dieterle | Búsqueda de microorganismos (por ejemplo, Treponema pallidum) |  | ||
| Tinción negativa | Tiñe el exterior, pero no el interior de células y estructuras. | Es muy utilizada en microscopía electrónica. En microscopía óptica, para identificar microorganismos encapsulados. |  | |
| Tinción con mucicarmina | Tiñe las paredes celulares de polisacáridos de un intenso color rojo. | Sirve para diferenciar bacterias con pared de polisacáridos de otras que no (por ejemplo, los Cryptococcus son mucicarmina +). |  | |
| Tinciones para organelos | ||||
| Tinción metacromática | Produce colores púrpuras y violetas en presencia de mucopolisacáridos ácidos sulfatados. |  | ||
| Tinciones para fibras | ||||
| Tinción de Weigert | Tiñe fibras elásticas en tonos de azul y violeta. |  | ||
| Tinción con orceína | Tiñe fibras elásticas en tonos de marrón y negro. |  | ||
| Tinciones para carbohidratos | ||||
| Tinción PAS | Tiñe carbohidratos y proteínas glicosiladas de color rojo magenta. |  | ||
| Tinción con Lugol | Tiñe el almidón de azul, el glucógeno de amarillo y el resto en tonos de ocre. |  | ||
| Tinción con carmín | Tiñe el glicógeno de intenso color rojo. | 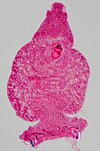 | ||
| Tinciones para proteínas | ||||
| Tinción argéntica | En función del fijado, tiñe proteínas y ácidos nucleicos en tonos de negro y marrón. |  | ||
| Tinción con Rojo Congo | Tiñe el amiloide de un intenso color rojo. | Se utiliza con hematoxilina/eosina en patología cuando se busca amiloide. |  | |
| Tinción con Alcian Blue | Tiñe mucopolisacáridos ácidos de color azul. |  | ||
| Tinción con Azul de Coomassie | Tiñe inespecíficamente proteínas de color azul. |  | ||
| Tinciones para ácidos nucleicos | ||||
| Tinción de Feulgen | Tiñe el ADN y los cromosomas de color rojo-violeta. |  | ||
| Naranja de acridina | Tiñe ADN y cromosomas de color verde fluorescente, ARN y ribosomas en color rojo fluorescente. |  | ||
| DAPI | Tiñe ADN de color azul-celeste fluorescente. |  | ||
| Bromuro de etidio |  | |||
| Tinciones para lípidos | ||||
| Tinción con Luxol Fast Blue | Tiñe la mielina de color azul-celeste. |  | ||
| Técnica de la Hematina ácida de Baker | Tiñe fosfolípidos y nucleoproteínas de color azul negro. | |||
| Tinción con Oil Red O | Sudán lipofílica | Tiñe lípidos neutros de color rojo intenso |  | |
| Tinción con Sudan Black B | Tiñe gotas de lípidos neutros de color negro azulado. |  | ||
| Tinción con Sudan II | ||||
| Tinción con Sudan III | Tiñe lípidos neutros de color rojo. | |||
| Tinción con Sudan IV | ||||
Referencias
[editar]- ↑ Penney, D. P., Powers, J. M., Frank, M., Churukian, C. (2002) «Analysis and testing of Biological Stains - the Biological Stain Commission Procedures.» Biotechnic & Histochemistry 77: 237-275.
- ↑ Horobin, R. W., Kiernan JA (2002) Conn's Biological Stains. A Handbook of Dyes Stains and Fluorochromes for Use in Biology and Medicine. 10th ed. Oxford: BIOS. ISBN 1-85996-099-5
- ↑ [1]
- ↑ thefreedictionary.com > amphophilic Citing: Saunders Comprehensive Veterinary Dictionary, 3 ed. 2007 Elsevier, Inc.
- ↑ Clark, G. (1981) Staining Procedures, 4th ed. p. 412. Baltimore: Williams & Wilkins.
- ↑ Levenfus, I.: An efficient method for counting DAPI-stained cells using Fiji. Grin: Munich. ISBN 978-3-640-86284-9
- ↑ Wells, J. (1988). «A Technique for Staining the Superficial Cells of Plucked Hair Follicles and Other Solid Tissues.» Stain Technology, 63(3).
- ↑ «Copia archivada». Archivado desde el original el 5 de noviembre de 2011. Consultado el 13 de marzo de 2014.
Bibliografía
[editar]- Clark, G. ed. (1973). Staining ological Stains. 10th ed. Oxford: BIOS. ISBN 1859960995.
- Kiernan, J. A. (2008). Histological and Histochemical Methods. Theory and Practice. Bloxham, UK: Scion. ISBN 9781904842422.
- Presnell, J. K., Schreibman MP (1997). Humason's Animal tissue Techniques. Baltimore: Johns Hopkins University Press.
- Ruzin, S. E. (1999). Plant Microtechnique and Microscopy. New York: Oxford University Press. ISBN 0195089561
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Tinción.
Wikimedia Commons alberga una categoría multimedia sobre Tinción.
- StainsFile referencia para colorantes y métodos de tinción (en inglés)
- Tinciones supravitales para protozoos y Técnicas de Montaje Temporarias ~ Howey, 2000 (en inglés)
- Hablando sobre fijación: Parte 1 y Parte 2 - by M. Halit Umar (en inglés)
- Photomicrographs of Histology Stains (en inglés)
- Frequently asked questions in staining exercises at Sridhar Rao P.N's home page (en inglés)
- Técnicas de tinción. Fundamentos Archivado el 13 de agosto de 2018 en Wayback Machine.
- Histology learning system Appendix A: Staining and Commonly Used Stains, Boston University
- Guía de trabajos de hematología. Hospital de Clínicas. U.B.A.
- Grignaschi
- Davidson & Henry
- Espinoza, J. (2014). Tesis de licenciatura en biología. Instituto Tecnológico de Los Mochis. Los Suárez, Sinaloa.


 French
French Deutsch
Deutsch

