Prymnesium parvum – Wikipedia, wolna encyklopedia
 | |
| Systematyka[1] | |
| Domena | |
|---|---|
| Supergrupa | |
| Królestwo | |
| Gromada | |
| Klasa | |
| Rząd | |
| Rodzina | |
| Rodzaj | |
| Nazwa systematyczna | |
| Prymnesium parvum N.Carter Carter, N. (1937). New or interesting algae from brackish water. Archiv für Protistenkunde 90: 1-68 | |
Prymnesium parvum – gatunek haptofitów występujących w różnych typach wód. Jeden z gatunków dających toksyczne zakwity.
Po raz pierwszy opisano na podstawie osobników zebranych ze słonawego stawu w Bembridge na wyspie Wight w 1937 roku. Wyróżniana jest forma Prymnesium parvum f. patelliferum (J.C.Green, D.J. Hibberd & R.N. Pienaar) A.Larsen, 1999. Epitet gatunkowy parvum oznacza „drobny”[1]. Niektórzy badacze sugerują, że pierwszy opisany gatunek z rodzaju Prymnesium, czyli Prymnesium saltans, może być utożsamiony z Prymnesium parvum[2].
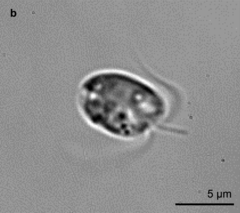
Jednokomórkowy organizm o formie wiciowca. Kształt nieregularny, obły. Długość ciała od 8 do 16 μm, a szerokość od 4 do 10 μm. Jak inne haptofity ma dwie gładkie wici służące do poruszania się i znajdującą się między nimi, zwykle krótszą lub im równą, haptonemę, która może służyć do przyczepiania się do podłoża. Haptonema jest dość sztywna. Chloroplasty są złotobrązowe, po dwa w komórce. Komórki okryte są dwuwarstwowymi urzeźbionymi płytkami celulozowymi[3]. Nie wytwarza kokolitów.
Cykl życiowy prawdopodobnie składa się z trzech stadiów wiciowcowych – dwóch haploidalnych i jednego diploidalnego, oraz stadium przetrwalnego – cysty. Prymnesium parvum f. patelliferum znane jest tylko jako forma haploidalna, podczas gdy forma typowa – jako diploidalna[3].
Ekologia
[edytuj | edytuj kod]Jest gatunkiem o dość dużej tolerancji ekologicznej. Jest euryhalinowy, występując zarówno w wodach słodkich, jak i morskich, choć typowy dla wód przejściowych. Wzrost jego liczebności powoduje zakwity zarówno wód słodkich, jak i morskich (przybrzeżnych). Zakwity te przybierają złotawą barwę. Jest eurytermiczny, żyjąc w zakresie 2–32 °C[3].
Jest organizmem miksotroficznym. Oprócz prowadzenia fotosyntezy zdolny jest do pochłaniania materii organicznej, także całych bakterii i innych drobnych organizmów oraz cząstek padliny ryb[3]. Nie musi pobierać witaminy B1, pod warunkiem dostępu do pirymidyny[4]. Miksotrofia pozwala na przeżycie w warunkach niskiej trofii, ale gatunek ten preferuje wody eutroficzne[3].
Rozmieszczenie geograficzne
[edytuj | edytuj kod]Występuje w różnych regionach świata: w Stanach Zjednoczonych i Brazylii, w Chinach i Nowej Zelandii[1], w Australii i Izraelu[3]. W Europie notowany w morskich wodach przybrzeżnych: Polski (Zatoka Gdańska)[5], Islandii[6], Portugalii[7], Rumunii[8], Ukrainy[9], Wielkiej Brytanii, Norwegii, Szwecji i Niemiec, w delcie rzeki Ebro w Hiszpanii, w płytkich jeziorach Węgier, północnych Włoch i w jeziorze Koronia w Grecji[10]. Na Węgrzech, mimo że obecność Prymnesium parvum została potwierdzona dopiero w 2012 roku, przypuszcza się, że od dłuższego czasu gatunek ten występuje cyklicznie w jeziorze Téglagyár w Hajdúszoboszló, dając zakwity co 5-10 lat, skutkujące masowym wymieraniem ryb[11]. Latem 2022 do masowego zakwitu tego gatunku doszło w Odrze, co spowodowało w niej masową śmierć ryb i mięczaków[12].
Toksyny
[edytuj | edytuj kod]Toksyny Prymnesium parvum określa się mianem ichtiotoksyn[3]. Fakt, że gatunek ten wytwarza i wydziela do wody toksyny zabójcze dla ryb, odkryto w 1939[13]. Pierwsze toksyny wytwarzane przez ten gatunek, czyli prymnezyny wyizolowano w 1995 roku[14]. Są to złożone polietery epoksydowe zawierające m.in. atomy chloru[15]. Enzymy służące do ich syntezy, PKZilla-1 i PKZilla-2, w czasie odkrycia były największymi znanymi białkami, o wadze 4,7 MDa i 3,2 MDa[16]. Wytwarza również inne rodzaje toksyn. Z reguły toksyny te oddziałują na zwierzęta wodne oddychające skrzelami, takie jak ryby, małże i kijanki[3]. Stwierdzono, że ropuchy po przeobrażeniu przestają być wrażliwe[13]. Toksyny zmieniają przepuszczalność błon komórkowych. Skutkuje to szczególnie uszkodzeniem skrzeli. Zatrute ryby krwawią ze skrzeli, wytwarzają więcej śluzu i zmieniają zachowanie, opadając na dno lub próbując czerpać powietrze z atmosfery, lub nawet wydostać się na brzeg zbiornika. Stwierdzono wpływ toksyczności poszczególnych składników toksyn na linie komórkowe pochodzące z przysadki mózgowej szczurów, ale nie ma danych wskazujących na rzeczywistą toksyczność dla ssaków. Mogą mieć właściwości allelopatyczne[3].
Toksyny Prymnesium parvum wydzielane są do wody w formie miceli. Często działają dopiero po aktywacji. Czynniki aktywacyjne to np. kationy, antybiotyki czy inne substancje[3]. Jednym z czynników zwiększającym wydzielanie toksyn jest szok osmotyczny, czyli nagła zmiana zasolenia wody[4]. Również niedobór któregoś ze składników pokarmowych może prowadzić do zwiększonego wydzielania toksyn w celu przejścia w fazę zakwitu i eliminacji konkurencji. Także w sytuacji przeciwnej – zwiększonego dostępu substancji biogennych dochodzi do rozbudowy populacji, skutkującej większą ilością wydzielanych toksyn. Niektóre toksyny łatwo rozkładane są przez światło słoneczne i dezaktywują się środowisku kwaśnym[3].
Zakwity powodowane przez Prymnesium parvum wiążą się z rozwojem bakterii z rodzajów Methyloversatilis, Lewinella, Marivita oraz rzędów Rhodobacterales i Rhodocyclales, przy czym nie jest jasne, czy ich obecność ułatwia zakwit, czy też dopiero korzystają one z jego efektów. Z kolei konkurencja z sinicami z rodzajów Microcystis, Cytophaga i Synechococcus sprawia, że ich zakwity stają się mniej prawdopodobne w obecności Prymnesium parvum[14].
Przypisy
[edytuj | edytuj kod]- ↑ a b c M.D. Guiry, Prymnesium parvum N.Carter 1937 [online], AlgaeBase.
- ↑ Bente Edvardsen i inni, Ribosomal DNA phylogenies and a morphological revision provide the basis for a revised taxonomy of the Prymnesiales (Haptophyta), „European Journal of Phycology”, 46 (3), 2011, s. 202–228, DOI: 10.1080/09670262.2011.594095, ISSN 0967-0262 [dostęp 2022-08-26] (ang.).
- ↑ a b c d e f g h i j k Daniel L. Roelke, Schonna R. Manning, Harmful Algal Species Fact Sheet: Prymnesium parvum (Carter) “Golden Algae”, Sandra E. Shumway, JoAnn M. Burkholder, Steve L. Morton (red.), wyd. 1, Wiley, 2 lipca 2018, s. 629–632, DOI: 10.1002/9781118994672.ch16q, ISBN 978-1-118-99467-2 [dostęp 2022-08-18] (ang.).
- ↑ a b Stefan Gumiński: Fizjologia glonów i sinic. Wrocław: Wydawnictwo Uniwersytetu Wrocławskiego, 1990, s. 13, 61. ISBN 83-229-0372-3. (pol.).
- ↑ Adam Bursa, Notatka o kilku godnych uwagi gatunkach planktonowych dotychczas nieznanych z Zatoki Gdańskiej, „Biuletyn Stacji Morskiej w Helu”, II (3), 1938, s. 63-68.
- ↑ Bettina Scholz, Hjörleifur Einarsson, Microphytobenthic community composition of two sub-Arctic intertidal flats in Huna Bay (Northern Iceland), „European Journal of Phycology”, 50 (2), 2015, s. 182–206, DOI: 10.1080/09670262.2015.1024286, ISSN 0967-0262 [dostęp 2022-08-26] (ang.).
- ↑ M.T. Moita, M.G. Vilarinho, Checklist of phytoplankton species off Portugal: 70 (1929-1998) years, „Portugaliae Acta Biologica. Serie B. Sistematica”, 18, 1999, s. 5-50.
- ↑ Ioan Cărăus, Algae of Romania. A distributional checklist of actual algae, wyd. 2.3, 2012, s. 95.
- ↑ А.Б. Зотов, Унификация расчета объема клеток микроводорослей черного моря в соответствии со стандартом ЕС [Unification of calculation the volume of alga for phytoplankton of the Black Sea to the standards of the EU Marine Strategy], „Algologia”, 28 (2), 2018, s. 208–232, DOI: 10.15407/alg28.02.208 [dostęp 2022-08-26].
- ↑ Prymnesium parvum (golden algae) [online], www.cabi.org [dostęp 2022-08-25] (ang.).
- ↑ Algavirágzások környezetterhelése és toxinjainak variabilitása [online], 9dok.org [dostęp 2022-08-25] (węg.).
- ↑ Podejrzenie jest uzasadnione: w wodzie z Odry wykryto toksynę z glonów żyjących w wodach słonawych | IGB [online], www.igb-berlin.de, 20 sierpnia 2022 [dostęp 2022-08-25] (niem.).
- ↑ a b M. Shilo, M. Aschner, Factors governing the Toxicity of Cultures containing the Phytoflagellate Prymnesium parvum Carter, „Journal of General Microbiology”, 8 (3), 1953, s. 333–343, DOI: 10.1099/00221287-8-3-333, ISSN 0022-1287 [dostęp 2022-08-18] (ang.).
- ↑ a b Ben A. Wagstaff i inni, Assessing the Toxicity and Mitigating the Impact of Harmful Prymnesium Blooms in Eutrophic Waters of the Norfolk Broads, „Environmental Science & Technology”, 55 (24), 2021, s. 16538–16551, DOI: 10.1021/acs.est.1c04742, ISSN 0013-936X [dostęp 2022-08-18] (ang.).
- ↑ Przemysław Mastalerz, Biogenne związki halogenoorganiczne [pdf], „Wiadomości chemiczne”, 52 (9-10), 1998, s. 644-671, ISSN 0043-5104.
- ↑ Timothy R. Fallon i inni, Giant polyketide synthase enzymes in the biosynthesis of giant marine polyether toxins, „Science”, 385 (6709), 2024, s. 671–678, DOI: 10.1126/science.ado3290, ISSN 0036-8075, PMID: 39116217, PMCID: PMC11416037 [dostęp 2024-10-03] (ang.).


 French
French Deutsch
Deutsch