Synteza Gabriela – Wikipedia, wolna encyklopedia
Synteza Gabriela – reakcja chemiczna, w wyniku której z pierwszorzędowych halogenków alkilowych (głównie chlorków) otrzymuje się pierwszorzędowe aminy z zastosowaniem ftalimidku potasu. Reakcja nosi nazwę od niemieckiego chemika Siegmunda Gabriela, który odkrył ją w 1887 roku[1][2][3].
Użyteczność tej metody wynika z faktu, że tworzenie amin w wyniku bezpośredniego alkilowania amoniaku jest procesem nieselektywnym i mało wydajnym na skalę laboratoryjną (natomiast metoda ta jest powszechnie stosowana w przemyśle), gdyż obok amin pierwszorzędowych powstają produkty polialkilowania, tj. aminy drugo- i trzeciorzędowe, a nawet czwartorzędowe halogenki tetraalkiloamoniowe. Amin pierwszorzędowych nie można też otrzymać zastępując amoniak amidkami metali (np. NaNH2), gdyż mają one charakter bardziej zasadowy niż nukleofilowy i zamiast reakcji substytucji nukleofilowej (R-Cl + NaNH2 → R-NH2 + NaCl) zachodzi reakcja eliminacji (z tej przyczyny amidki mogą być stosowane celowo do przeprowadzenia reakcji dehydrohalogenowania)[4].
W syntezie Gabriela nie dochodzi do powstawania amin wyższego rzędu. W warunkach wymaganych do przeprowadzenia obu etapów reakcji możliwe jest też zachowanie ewentualnych innych grup funkcyjnych w cząsteczce związku wyjściowego, np. karbonylowych, estrowych i nitrylowych.
Klasyczna synteza Gabriela
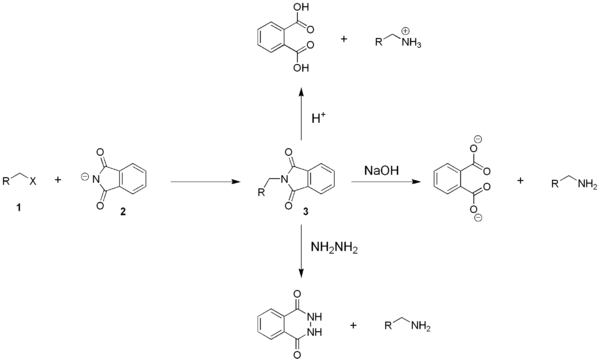
[edytuj | edytuj kod]W klasycznej syntezie Gabriela otrzymuje się pierwszorzędowe aminy na drodze dwuetapowej reakcji I- lub II-rzędowego chlorku alkilowego (1) z ftalimidkiem (2). Powstały w pierwszym etapie alkiloftalimid (3) poddaje się hydrolizie. Dobór metody hydrolizy zależy od obecności innych grup funkcyjnych wyjściowego halogenku. Zastosowana może zostać zarówno hydroliza kwasowa, jak i zasadowa. Aby uzyskać bardzo łagodne warunki rozkładu związku pośredniego stosuje się często hydrazynolizę (rozkład za pomocą hydrazyny)[5].
Etap pierwszy (alkilowanie) prowadzi się najczęściej w dimetyloformamidzie, w którym rozpuszcza się ftalimidek potasu, etap drugi (hydrolizę) prowadzi się najczęściej w roztworze etanolowym. Stosowane są też inne systemy reakcyjne, np. rozkład alkiloftalimidu za pomocą borowodorku sodu[6].
Mechanizm reakcji
[edytuj | edytuj kod]Anion ftalimidkowy reaguje z chlorkiem alkilowym (elektrofilem) jako N-nukleofil w reakcji typu SN2. Powstaje odpowiedni N-alkiloftalimid oraz KCl jako produkt uboczny. Otrzymana ftalimidowa pochodna (ftalhydrazyd) jest reaktywnym diamidem i ulega hydrolizie z wydzieleniem aminy zarówno w warunkach kwasowych, jak i zasadowych. Hydroliza kwasowa w obecności mocnych kwasów prowadzi do powstania soli amin R-NH3+ X-[7].
Odmiany
[edytuj | edytuj kod]W celu zastąpienia ftalimikdów w tej syntezie opracowano wiele różnych odczynników. Większość z nich, np. sól sodowa sacharyny, mają właściwości nukleofilowe podobne do soli ftalimidu. Zaletą niektórych zamienników ftalimików jest zwiększenie ich reaktywności wobec halogenków alkilowych, co pozwala na otrzymywanie amin drugorzędowych[8].
Synteza Gabriela umożliwia także otrzymywanie aminokwasów, np. w reakcji z α-bromopochodną malonianu dietylu otrzymuje się glicynę:



Aminokwasy chiralne otrzymywane są w syntezie Gabriela w postaci racemicznej.
Przypisy
[edytuj | edytuj kod]- ↑ S. Gabriel. Ueber eine Darstellung primärer Amine aus den entsprechenden Halogenverbindungen. „Chem. Ber.”. 20, s. 2224, 1887.
- ↑ J.C. Sheehan, V.A. Bolhofer, An Improved Procedure for the Condensation of Potassium Phthalimide with Organic Halides, „Journal of the American Chemical Society”, 72 (6), 1950, s. 2786–2788, DOI: 10.1021/ja01162a527 (ang.).
- ↑ M.S. Gibson, R.W. Bradshaw, The Gabriel Synthesis of Primary Amines, „Angewandte Chemie International Edition”, 7 (12), 1968, s. 919-930, DOI: 10.1002/anie.196809191 (ang.).
- ↑ P.J. Ashworth, G.H. Mansfield, M.C. Whiting, 2-Butyn-1-ol, „Organic Syntheses”, 35, 1955, s. 20, DOI: 10.15227/orgsyn.035.0020 (ang.).
- ↑ J.D. Roberts, M.C. Caserio: Chemia organiczna. Warszawa: PWN, 1969, s. 569-570.
- ↑ J.O. Osby, M.G. Martin, B. Ganem, An Exceptionally Mild Deprotection of Phthalimides, „Tetrahedron Letters”, 25 (20), 1984, s. 2093-2096, DOI: 10.1016/S0040-4039(01)81169-2.
- ↑ Khan, M. N.. Kinetic Evidence for the Occurrence of a Stepwise Mechanism in the Hydrazinolysis of Phthalimide. „J. Org. Chem.”. 60, s. 4536-4541, 1995. DOI: 10.1021/jo00119a035. (ang.).
- ↑ Ulf Ragnarsson, Leif Grehn, Novel Gabriel Reagents, „Accounts of Chemical Research”, 24 (10), 1991, s. 285–289, DOI: 10.1021/ar00010a001 (ang.).
Bibliografia
[edytuj | edytuj kod]- Arthur, Israel Vogel: Preparatyka Organiczna. Warszawa: Wydawnictwo Naukowo Techniczne, 2006, s. 746-748. ISBN 83-204-3152-2.
- Jerzy T. Wróbel: Preparatyka i elementy syntezy organicznej. Warszawa: Państwowe Wydawnictwo Naukowe PWN, 1983, s. 613-614. ISBN 83-01-02392-9.
Linki zewnętrzne
[edytuj | edytuj kod]- Gabriel Synthesis, [w:] Name Reactions [online], Organic Chemistry Portal [dostęp 2018-08-03] (ang.).


 French
French Deutsch
Deutsch