Western blot – Wikipedia, wolna encyklopedia

Western blot, western blotting, immunoblotting – metoda stosowana w biologii molekularnej służąca do wykrywania określonych białek. Technika ta obejmuje przygotowanie próbek z mieszaniną białek, elektroforezę, przeniesienie rozdzielonych białek z żelu na membranę, inkubację z odpowiednimi przeciwciałami i detekcję pożądanego białka.
Procedura
[edytuj | edytuj kod]Przygotowanie próbek
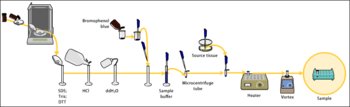
[edytuj | edytuj kod]Badane białka muszą zostać uwolnione z komórek przy użyciu technik rozbijania tkanek lub dezintegracji komórek, a następnie oczyszczania białek. Dla lepszego rozpuszczenia białek dodaje się czynniki chaotropowe, redukujące, detergenty, bufory, sole. Następnie określa się stężenie białek w próbkach, aby użyć odpowiednich ilości w elektroforezie[1].
Elektroforeza
[edytuj | edytuj kod]
Próbki poddaje się elektroforezie w żelu poliakryloamidowym w obecności SDS (SDS-PAGE). Zdenaturowane białka w wyniku tego procesu zostają rozdzielone według ich mas cząsteczkowych. Mają one postać serii prążków na żelu[2], które można zwizualizować przez barwienie błękitem Coomassie lub srebrem[3].
Rzadziej stosuje się elektroforezę w niedenaturujących warunkach, bez SDS[4]. Na rozdział taki ma wpływ wtedy również natywny ładunek białka, ponadto interakcje między białkami, więc skutek takiego rozdziału jest nieprzewidywalny (na przykład jedne białka mogą migrować w stronę jednej elektrody, inne w stronę drugiej)[1].
Elektrotransfer białek
[edytuj | edytuj kod]Następnie rozdzielone białka w żelu zostają przeniesione (odciśnięte, ang. blotting) w wyniku działania pola elektrycznego na membranę, gdzie zostają związane[2]. Używa się w tym celu najczęściej membrany nitrocelulozowej lub PVDF[5]. Membrany PVDF są bardziej wytrzymałe mechanicznie i mniej wrażliwe na działanie rozpuszczalników organicznych. Najrzadziej używanymi membranami w immunoblottingu są membrany nylonowe. Efektywność przeniesienia białek z żelu na membranę można ocenić, wybarwiając ją odwracalnie pąsem S (Ponceau S). Po obserwacji barwnik można szybko usunąć przez przemywanie i przystąpić do dalszych analiz[6].
Wyróżnia się dwa typy elektrotransferu – mokry i półsuchy. Transfer mokry przebiega w naczyniu wypełnionym buforem[7]. Żel, membrana i bibuły Whatmana tworzące „kanapkę” pomiędzy dwiema elektrodami ułożone są pionowo. Przy dłuższym transferze (ponad godzinnym) przeprowadzanym w taki sposób konieczne jest chłodzenie[8].
W przypadku elektrotransferu półsuchego „kanapka” żel-membrana obłożona jest kilkoma warstwami bibuły Whatmana nawilżonej buforem[7] i ułożona w pozycji poziomej[8]. W ten sposób białka przenoszone są szybciej, zwykle taniej, potrzeba mniej buforu i można stosować różne bufory po stronie anody i katody. Z reguły jednak wydajność przeniesienia białek jest niższa[7].
Podstawowym buforem w elektrotransferze białek jest bufor Tris-glicyna, na ogół o pH wyższym niż pI przenoszonych białek. Stosuje się także dodatki w postaci metanolu lub SDS. SDS przyśpiesza migrację białek, ale może osłabiać wiązanie białek do membrany. Metanol ułatwia dysocjację kompleksów SDS-białko, wzmacnia wiązanie białek do membrany, ale może powodować denaturację dużych białek, obniżać wydajność przenoszenia białek, chemicznie je modyfikować[9].
Użycie przeciwciał
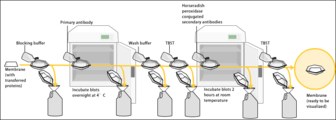
[edytuj | edytuj kod]Membranę z białkami inkubuje się w roztworze odtłuszczonego mleka w proszku[5], kazeiny[2] lub albuminy z surowicy wołowej[1]. Substancje te rozpuszcza się w buforze stosowanym do przemywania membrany, który składa się z TBS lub PBS i niejonowego detergentu, na przykład Tween 20)[5]. Mieszanina ta to tak zwany bufor blokujący, który ostatecznie wybierany jest na drodze empirycznej[10]. Dzięki niemu blokowana jest możliwość niespecyficznego wiązania się przeciwciał do membrany[2].
Następnie membranę inkubuje się z przeciwciałem związanym ze znacznikiem (metoda bezpośrednia) lub z dwoma rodzajami przeciwciał: nieznakowanym, specyficznym, rozpoznającym pożądane białko (przeciwciało pierwszorzędowe) oraz znakowanym, rozpoznającym przeciwciało pierwszorzędowe (przeciwciało drugorzędowe)[11].
Przeciwciała drugorzędowe rozpoznają epitopy charakterystyczne dla przeciwciał gatunku, z którego pozyskano przeciwciała pierwszorzędowe[12]. Przykładowo jeśli pierwszorzędowe przeciwciała pochodzą od myszy, przeciwciała drugorzędowe powinny pochodzić od innego zwierzęcia, np. kozy, i być skierowane przeciw przeciwciałom myszy[11]. Taki dwustopniowy system detekcji pozwala oszczędzić czas i jest tańszy[12]. Przeciwciała swoiste wobec konkretnego białka są bowiem unikalne, więc i kosztowne, a znakowanie we własnym zakresie pociąga za sobą straty. Roztwór do rozcieńczenia przeciwciała często jest taki sam jak bufor blokujący. Stosunek rozcieńczenia przeciwciała pierwszorzędowego ustalany jest eksperymentalnie[13].
Inkubacje te przeprowadza się na wytrząsarkach orbitalnych i po użyciu przeciwciał wymywa się te niespecyficznie związane odpowiednim buforem z detergentem[5]. Zbyt intensywnie wymywanie może znacznie obniżać sygnał pochodzący od analizowanego białka; niewystarczające przemywanie może doprowadzić do uzyskania zbyt wysokiego tła[10].
Detekcja
[edytuj | edytuj kod]Przeciwciała mogą być znakowane markerem promieniotwórczym, a następnie obraz można uzyskać metodami autoradiografii. Przeciwciało może być również połączone (sprzęgnięte) z enzymem, dającym barwny produkt[11]. Najczęściej w technice western blot wykorzystuje się dwa rodzaje przeciwciał, gdzie przeciwciała drugorzędowe są sprzężone z peroksydazą chrzanową, a do uwidocznienia wykorzystuje się zjawisko wzmocnionej chemiluminescencji[5]. W procesie tym peroksydaza utlenia luminol, powoduje to emisję światła, co można zarejestrować za pomocą kliszy fotograficznej[14].
- Schematy czynności w technice western blot
- Przygotowanie próbki do elektroforezy SDS
- Elektroforeza SDS-PAGE
- Przeniesienie białek na membranę
- Wiązanie przeciwciał
- Detekcja białek techniką chemiluminescencji
Zastosowanie
[edytuj | edytuj kod]Western blot znalazł zastosowanie m.in. w diagnostyce chorób[15], np. w przypadku wirusowego zapalenia wątroby typu C metodą tą wykrywa się rdzeń wirusa[16]. Stosowana jest również do diagnozy boreliozy i gruźlicy[15]. W diagnostyce zakażenia HIV pozytywny wynik testu western blot przeprowadzany po pozytywnym wyniku testu ELISA daje 99,9% pewności[17]. Technika western blot jest przydatna w ocenie jakości oczyszczania białka i produkcji rekombinowanych białek po klonowaniu genów[16].
Przypisy
[edytuj | edytuj kod]- ↑ a b c A Guide to Polyacrylamide Gel Electrophoresis and Detection. Bio-Rad. [dostęp 2017-10-18]. (ang.).
- ↑ a b c d Hames i Hooper 2002 ↓, s. 129–130.
- ↑ Faoro V., Becker K. F., Stanta G.: Visualisation of Proteins. W: Stanta G.: Guidelines for Molecular Analysis in Archive Tissues. Springer, 2011, s. 265–266. DOI: 10.1007/978-3-642-17890-0. ISBN 978-3-642-17889-4.
- ↑ Manoussopoulos I. N., Tsagris M.. Native electrophoresis and western blot analysis: method and applications. „Methods in Molecular Biology”. 536, s. 277–287, 2009. DOI: 10.1007/978-1-59745-542-8_29.
- ↑ a b c d e Faoro V., Becker K. F., Stanta G.: Western Blotting. W: Stanta G.: Guidelines for Molecular Analysis in Archive Tissues. Springer, 2011, s. 271–274. DOI: 10.1007/978-3-642-17890-0. ISBN 978-3-642-17889-4.
- ↑ Kraj, Drabik i Silberring 2010 ↓, s. 128–131.
- ↑ a b c Kraj, Drabik i Silberring 2010 ↓, s. 127.
- ↑ a b Ćwiczenia z Biologii Molekularnej dla Studentów II Roku Biologii Medycznej UMCS. Uniwersytet Marii Curie-Skłodowskiej, 2015. [dostęp 2017-10-18]. (pol.).
- ↑ Kraj, Drabik i Silberring 2010 ↓, s. 128–130.
- ↑ a b Kraj, Drabik i Silberring 2010 ↓, s. 131.
- ↑ a b c Hames i Hooper 2002 ↓, s. 130–131.
- ↑ a b P. Węgleński: Genetyka Molekularna. Warszawa: Wydawnictwo Naukowe PWN, 2017, s. 140–141. ISBN 978-83-01-14744-0.
- ↑ Kraj, Drabik i Silberring 2010 ↓, s. 132–133.
- ↑ Hames i Hooper 2002 ↓, s. 73.
- ↑ a b Barylski J.: Technika Western blot i jej zastosowanie w diagnostyce. Hylostet, 2009. [dostęp 2017-10-18].
- ↑ a b Jeremy Mark Berg, John L Tymoczko, Lubert Stryer: Biochemistry. Nowy Jork: W. H. Freeman and Company, 2012, s. 89. ISBN 978-1-4292-2936-4.
- ↑ Indu Khurana: Medical Physiology. New Delhi: Elsevier, 2012, s. 37. ISBN 978-81-312-2805-0.
Bibliografia
[edytuj | edytuj kod]- B. D. Hames, N. M. Hooper: Biochemia. Krótkie wykłady. Warszawa: Wydawnictwo Naukowe PWN, 2002. ISBN 83-01-13872-6.
- A. Kraj, A. Drabik, J. Silberring: Proteomika i Metabolika. Warszawa: Wydawnictwa Uniwersytetu Warszawskiego, 2010. ISBN 978-83-235-0765-9.


 French
French Deutsch
Deutsch