Enfarte agudo do miocárdio – Wikipédia, a enciclopédia livre
| Enfarte do miocárdio | |
|---|---|
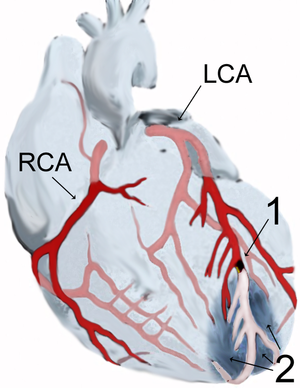
| Ilustração de um enfarte do miocárdio (2) na parede anterior do coração na sequência do bloqueio (1) de uma ramificação da artéria coronária esquerda (LCE). | |
| Sinónimos | Enfarte agudo do miocárdio, ataque cardíaco |
| Especialidade | Cardiologia |
| Sintomas | Dor no peito, falta de ar, náuseas, sensação de desmaio, suores frios, fadiga[1] |
| Complicações | Insuficiência cardíaca, arritmia cardíaca, choque cardiogénico, parada cardíaca[2][3] |
| Causas | Geralmente doença arterial coronária[2] |
| Fatores de risco | Hipertensão arterial, fumar, diabetes, falta de exercício, obesidade, colesterol elevado[4][5] |
| Método de diagnóstico | Eletrocardiograma (ECG), análises ao sangue, angiografia coronária[6] |
| Tratamento | Angioplastia coronária, trombólise[7] |
| Medicação | Aspirina, nitroglicerina, heparina[7][8] |
| Prognóstico | Com elevação ST: 10% risco de morte (países desenvolvidos)[7] |
| Frequência | 15,9 milhões (2015)[9] |
| Classificação e recursos externos | |
| CID-10 | I21-I22 |
| CID-9 | 410 |
| OMIM | 608557 |
| DiseasesDB | 8664 |
| MedlinePlus | 000195 |
| eMedicine | med/1567 emerg/327 ped/2520 |
| MeSH | D009203 |
Um enfarte agudo do miocárdio (português europeu) ou infarto agudo do miocárdio (português brasileiro), vulgarmente denominado ataque cardíaco, ocorre quando a circulação de sangue para uma parte do coração é interrompida, causando lesões no músculo cardíaco. O sintoma mais comum é dor no peito ou desconforto que se pode espalhar para o ombro, costas, pescoço ou maxilar. É comum ter início no lado esquerdo do peito e durar alguns minutos. O desconforto pode por vezes ser semelhante à azia. Entre outros sintomas possíveis estão a falta de ar, náuseas, sensação de desmaio, suores frios ou fadiga.[1] Cerca de 30% das pessoas manifestam sintomas atípicos,[7] os quais são mais comuns entre mulheres.[10] Entre as pessoas com mais de 75 anos de idade, cerca de 5% tiveram um enfarte do miocárdio com poucos ou nenhuns sintomas.[11] Um enfarte do miocárdio pode causar insuficiência cardíaca, arritmia cardíaca ou paragem cardiorrespiratória.[2][3]
A maior parte dos enfartes do miocárdio é causada por uma doença arterial coronária.[2] Entre os fatores de risco estão, entre outros, a hipertensão arterial, tabagismo, diabetes, sedentarismo, obesidade, colesterol elevado, uma dieta pouco saudável e consumo excessivo de bebidas alcoólicas.[4][5] O mecanismo de um enfarte do miocárdio muitas vezes envolve o bloqueio completo de uma artéria coronária, causado pela rotura de uma placa aterosclerótica.[2] Ainda que de forma menos comum, pode também ser causado por espasmos da artéria coronária (vasoespasmo), que podem dever-se ao consumo de cocaína, estresse emocional significativo e frio extremo, entre outros.[12][13] Alguns exames podem auxiliar o diagnóstico, incluindo eletrocardiogramas, análises de sangue e angiografias coronárias.[6] Os eletrocardiogramas permitem confirmar a presença ou não de elevação do segmento ST.[7] As análises de sangue geralmente incluem a medição da troponina e, de forma menos comum, dosagens de CK e CK-MB, contudo, com o advento da troponina ultrassenssível, a dosagem destes últimos não tem mais sido recomendada de forma rotineira pelos últimos guidelines.[6][14]
A aspirina é um tratamento imediato apropriado quando se suspeita de enfarte do miocárdio.[8] As dores no peito podem ser aliviadas com nitroglicerina ou opiáceos, embora não melhorem o prognóstico.[7][8] Em pessoas com baixos níveis de oxigénio pode ser administrado oxigénio suplementar.[8] Nos enfartes do miocárdio com elevação do segmento ST são geralmente recomendados tratamentos para restaurar a corrente sanguínea para o coração. Estes tratamentos incluem angioplastia coronária, em que o bloqueio é removido com a introdução de um pequeno catéter na artéria, ou trombólise, em que o bloqueio é removido com recurso a medicamentos.[7] As pessoas que apresentam um enfarte do miocárdio sem elevação do segmento ST são muitas vezes tratadas com o anticoagulante heparina, complementada por angioplastia em pessoas de risco elevado.[8] Em pessoas com bloqueios em múltiplas artérias coronárias e diabetes, pode ser recomendada a realização de um cirurgia de bypass em vez de uma angioplastia.[15] Na sequência de um enfarte do miocárdio são geralmente recomendadas alterações do estilo de vida e tratamento a longo prazo com aspirina, betabloqueadores e estatina.[7]
Em 2013 ocorreram em todo o mundo 8,6 milhões de enfartes do miocárdio.[16] Em mais de 3 milhões de casos verificou-se elevação do segmento ST.[17] Os enfartes com elevação ST são duas vezes mais comuns em homens do que em mulheres.[18] Nos países desenvolvidos o risco de morte em casos com elevação ST é de cerca de 10%.[7] Entre 1990 e 2010 a prevalência da doença, quando corrigida pela idade, diminuiu em todo o mundo.[19]
Sinais e sintomas
[editar | editar código-fonte]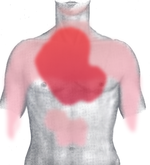
O sintoma mais importante e típico do IAM é a dor ou desconforto intenso retroesternal (atrás do osso esterno) que é muitas vezes referida como aperto, opressão, peso ou queimação, podendo irradiar-se para pescoço, mandíbula, membros superiores e dorso.
Frequentemente esses sintomas são acompanhados por náuseas, vômitos, sudorese, palidez e sensação de morte iminente. A duração é caracteristicamente superior a 20 minutos. Dor com as caraterísticas típicas, mas com duração inferior a 20 minutos sugere angina do peito, onde ainda não ocorreu a morte do músculo cardíaco.
Pacientes diabéticos, idosos e as mulheres têm maior probabilidade de apresentarem uma dor ou desconforto atípico, ou seja, com características e intensidade diferentes da descrição acima.

É possível a ocorrência de IAM sem dor. Este é o chamado infarto silencioso. Um infarto silencioso só será identificado na fase aguda se, por coincidência, um eletrocardiograma ou uma dosagem de enzimas cardíacas for feita enquanto ele ocorre.
Os achados dependerão da extensão do infarto. Na maioria das vezes os pacientes apresentam-se desconfortáveis, ansiosos, com sinais de liberação adrenérgica. Naqueles em que a área necrosada supera os 40% da massa ventricular esquerda têm alto risco de evoluírem com Insuficiência cardíaca, edema agudo de pulmão e choque cardiogênico.
Fisiopatologia
[editar | editar código-fonte]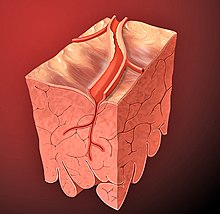
O suprimento de sangue para o coração é feito através das artérias coronárias, que surgem diretamente da artéria aorta na valva aórtica, preferencialmente chamada de valva semilunar aórtica ou valva semilunar esquerda. São duas as principais artérias coronárias: a artéria coronária direita e a artéria coronária esquerda que logo se bifurca em duas grandes artérias, a artéria descendente anterior e artéria circunflexa.
A interrupção do suprimento ou fluxo sanguíneo para o músculo cardíaco é causada pela obstrução de uma artéria coronária ou de um de seus ramos.
A obstrução é causada mais frequentemente pela formação de um coágulo (ou trombo) sanguíneo sobre uma placa aterosclerótica no interior de uma das artérias coronárias.
Este trombo costuma ocorrer sobre uma placa aterosclerótica que sofreu alguma alteração, como a formação de uma úlcera ou a ruptura parcial da placa. Esta placa, antes da alteração que a instabilizou, pode ser suficientemente pequena para passar despercebida pelos métodos habituais de diagnóstico. Ou seja, um paciente com "exames normais" pode vir a ter um infarto do miocárdio por um processo muito breve, às vezes de poucos minutos.
Uma placa é considerada vulnerável (ou imatura) quando apresenta risco de ruptura. Quando a placa apresenta uma cápsula espessa (placa madura) torna-se menos propensa a ruptura. Não existe um método aceito para determinar qual placa é vulnerável e qual não, mas, após necrópsias, se verificou que as placas com propensão a romper costumam ter mais conteúdo de lipídeos e menos fibrose.
Quando ocorre a ruptura da placa, existe exposição de colágeno e fragmentos de tecido conjuntivo da região subendotelial. As plaquetas, células do sangue, se aderem e se agregam ao local da ruptura. As plaquetas liberam substâncias que desencadeiam o processo de coagulação, resultando na formação do trombo.
Consequências da oclusão
[editar | editar código-fonte]A falta de circulação impede a chegada de nutrientes e de oxigênio (isquemia) ao território arterial a jusante. A isquemia determina redução imediata e progressiva da contratilidade do miocárdio. A dinâmica da movimentação normal de íons, em especial potássio, cálcio e sódio, começa a se alterar. Isto gera uma instabilidade elétrica.
Como o ritmo cardíaco depende deste fluxo de íons e elétrons, podem ocorrer arritmias já precocemente no infarto. A morte nesta fase do infarto não costuma ser por que não existe força nos músculos, mas por que os músculos perdem a capacidade de trabalhar coordenados, tornando-se ineficientes. São músicos sem maestro.
A partir de 20 minutos de oclusão, parcelas progressivamente maiores do miocárdio entram irreversivelmente em necrose. Essa inicia-se na região subendocárdica, metabolicamente mais ativa, estendendo-se para a epicárdica sob a forma de uma "onda de necrose", completando-se em cerca de 6 horas.
Na ausência de adequada circulação colateral, 50% da massa miocárdica em risco sofre necrose na primeira hora e 70% em 3 a 4h.
Remodelação ventricular
[editar | editar código-fonte]O grau de disfunção ventricular esquerda é um dos fatores de risco mais importantes na sobrevida pós IAM. Cerca de 30% a 50% dos pacientes apresentam sinais de dilatação ventricular, dependendo do local e extensão do infarto, da perviabilidade ou não da artéria ocluída, da intensidade da circulação colateral e dos fatores que aumentam a tensão ventricular.
A remodelação começa dentro de horas e continua por vários meses, mesmo após a cicatrização histológica da área infartada, a qual dura de seis semanas a seis meses. No processo de remodelação observa-se a expansão da área infartada, fenômeno precursor de aneurisma ventricular. Essa remodelação dependerá do tamanho e da transmuralidade do infarto, do processo de cicatrização adequado, da intensidade das forças mecânicas que atuam sobre a parede ventricular.
Fatores de risco
[editar | editar código-fonte]Os fatores de risco para infarto agudo do miocárdio[20] estão associados a arterioesclerose ou doença arterial coronariana. Os fatores de risco podem ser divididos em dois grupos:
- Fatores que podem ser mudados ou controlados:
- Colesterol Altoː
- Hipertensão arterial;
- Tabagismo;
- Excesso de peso;
- Sedentarismo;
- Diabetes Mellitus;
- Drogas;
- Apneia do sono - aumenta em até 30% a possibilidade de desenvolver arritmias e infarto.[21]
- Colesterol Altoː
- Fatores que não podem ser mudadosː
- Idadeː
- Risco aumentado para homens acima de 45 anos;
- Risco aumentado para mulheres acima de 55 anos (ou após a menopausa).
- História familiar ou predisposição genéticaː
- Risco aumentado se pai ou um irmão for diagnosticado com DAC antes de 55 anos de idade;
- Risco aumentado se mãe ou uma irmã for diagnosticada com DAC antes de 65 anos de idade.
- Idadeː
Diagnóstico
[editar | editar código-fonte]A Organização Mundial de Saúde determina que para o diagnóstico de IAM é necessária a presença de critérios diagnósticos em três áreas:
- Clínica;
- Eletrocardiográfica;
- Bioquímica.
Exame físico
[editar | editar código-fonte]Os sinais do IAM são:
- A pressão arterial geralmente é normal;
- Na ausculta cardíaca os ruídos estão abafados, sendo a quarta bulha um achado frequente. A terceira bulha relaciona-se com a gravidade da disfunção ventricular;
- O precórdio é geralmente invisível e o ictus cordis pode ser difícil de palpar;
- Outros sinais físicos de disfunção ventricular que podem estar presentes incluem, quarta (B4) e terceira (B3) bulhas, hipofonese de bulhas e, nos casos mais graves, desdobramento paradoxal da segunda bulha.
- Classificação de Killip
Classificação baseada em dados clínicos que permite estudar a gravidade da insuficiência ventricular nos pacientes com IAM é bastante usada na avaliação da mortalidade em geral.
- Killip I - sem dispneia, terceira bulha ou estertoração pulmonar. Mortalidade = 6%.
- Killip II - dispneia e estertoração pulmonar nos terços inferiores do tórax. Mortalidade = 17%.
- Killip III - edema agudo de pulmão. Mortalidade = 38%.
- Killip IV - choque cardiogênico. Mortalidade = 81%.
Eletrocardiograma
[editar | editar código-fonte]- Alterações morfológicas

Achados eletrocardiográficos são fundamentais no diagnóstico de IAM.
- Na suboclusão é frequente a presença de onda T invertida ou depressão no ponto J.
- Nos quadros oclusivos há supradesnivelamento do segmento ST em duas ou mais derivações contíguas e alterações difusas da repolarização. Se houver necrose pode ocorrer deflexão negativa inicial do complexo QRS e se torna progressivamente mais proeminente.
- O eletrocardiograma inicial não é diagnóstico em 40% ou mais dos pacientes com infarto agudo, mas os achados eletrocardiográficos em sequência permanecem como os pilares do diagnóstico. Podem ocorrer infartos sem as alterações agudas ou mesmo sem nenhuma alteração. Tais casos podem ser indiagnosticáveis na fase aguda.
- Localização (topografia)
A depender da região topográfica acometida, as alterações eletrocardiográficas aparecerão em derivações distintas:
- Região septal do ventrículo esquerdo - derivações V1 a V2;
- Região anterior media do ventrículo esquerdo - derivações V2, V3, I e aVL;
- Região ântero-septal do ventrículo esquerdo - derivações V1 a V3;
- Ápice do ventrículo esquerdo - derivações de V3 a V4;
- Região ântero-apical do ventrículo esquerdo - derivações V1 a V6;
- Parede lateral do ventrículo esquerdo - derivações V5, V6 e aVL;
- Parede inferior do ventrículo esquerdo - derivações II, III e aVF;
- Anterior extenso do ventrículo esquerdo - derivações V1 a V6, I e aVL.
Enzimas cardíacas
[editar | editar código-fonte]Os marcadores de necrose miocárdica têm dupla função na avaliação do IAM, têm efeito diagnóstico e também na avaliação prognóstica. Em decorrência da isquemia prolongada a membrana celular perde sua integridade permitindo a saída para o meio extracelular de macromoléculas, possibilitando a dosagem sérica das mesmas. Dentre as mais importantes podemos citar:
- Creatinofosfoquinase (CK) e Fração MB da Creatinofosfoquinase (CK-MB). A CK-MB é mais específica para diagnóstico de necrose miocárdica, sendo sua curva característica, obtida pela dosagem seriada, padrão para diagnóstico de IAM.
- Troponinas T e I - não são detectadas em indivíduos normais, sendo que sua elevação, mesmo mínima, pode significar algum grau de lesão miocárdica (microinfartos). Uma dosagem negativa de troponina não afasta diagnóstico de IAM, devendo-se repetir essa avaliação após 10 a 12 horas do início dos sintomas. Pode se manter elevado até por 2 semanas do IAM.
- Mioglobina – seu principal papel no diagnóstico de IAM decorre de seu valor preditivo negativo (variando de 83% a 98%), ou seja, é um bom método complementar para se afastar a presença de infarto do miocárdio quando negativo - sua curva é feita apenas nas primeiras horas de dor torácica.
- Aspartato aminotransferase (AST) ou transaminase glutâmico-oxalacética (GOT ou TGO) - muito útil para o diagnóstico e acompanhamento do IAM juntamente com a dosagem da creatina quinase (CK) e da desidrogenase láctica (LDH). AST está ligada à necrose de células miocárdicas e sua elevação é geralmente moderada raramente chegando a atingir 10 vezes o limite superior normal. Os níveis de AST aumentam dentro de 6 a 10 horas após o infarto, atingindo um valor máximo em 12 a 48 horas, voltando aos níveis normais em 3 a 4 dias, se não ocorrer novo infarto. No entanto, a AST é muito menos específica do que a CK-MB para o diagnóstico do infarto do miocárdio.
- Desidrogenase láctica (LDH) - também é usada como marcador de IAM. Níveis elevados são observados na maioria dos pacientes com IAM, embora o grau de elevação não seja tão grande como o da CK, ele persiste por 10 a 14 dias.
Na prática clínica são utilizados as troponinas e a CK-MB nas 12 primeiras horas para diagnóstico e avaliação de pacientes com suspeita de síndromes coronariana agudas e o acompanhamento da curva de CK-MB nos paciente com diagnóstico de infarto.
Ecocardiograma
[editar | editar código-fonte]
A ecocardiografia frequentemente evidencia um compromisso miocárdico segmentar, ou seja um segmento do coração não se contrai devidamente. O ecocardiograma com Doppler é um exame de rotina de grande utilidade em centros que dispõem desta facilidade. Porém o método apesar de útil não se presta ao diagnóstico diferencial da dor torácica, só afastando a possibilidade de outras patologias concomitantes como estenose aórtica, hipertensão pulmonar aguda, pericardites com derrame, entre outras. O Ecocardiograma é relevante nos casos de IAM complicados com insuficiência cardíaca, por permitir identificar e avaliar quantitativamente esta insuficiência porém deverá ser efetuado com excelente material e a fiabilidade depende, como em todos os exames de ecografia, da experiência do examinador. Atualmente, como a revascularização do miocárdio é uma urgência, quando a enzimologia é sugestiva de enfarte do miocárdio passa-se directamente à coronariografia que permite a realização da angioplastia coronária e a recuperação da zona muscular isquémica. O ecocardiograma é assim, atualmente, um exame de "segundo plano" nesta patologia.
Angiografia
[editar | editar código-fonte]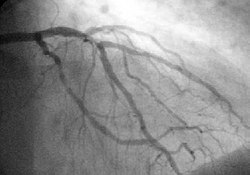
A angiografia é um exame bastante útil para visualização direta de vasos acometidos. Permite visualizar a artéria (ou as artérias) ocluída e o grau de oclusão. Este grau de oclusão é expresso por porcentagem de estenose, que é feito pela comparação do segmento mais estreitado com o segmento distal ou proximal de espessura normal.
Um estreitamento maior que 70% do diâmetro é considerado significante. Estreitamentos menores do que este grau não costumam provocar alterações importantes no fluxo coronário, não sendo prováveis causas do infarto. O procedimento costuma ser seguro, mas está sujeito a sérias complicações. É exame imprescindível quando se tentará restituir o fluxo de sangue a área de infarto, seja por Angioplastia, seja por Cirurgia. Não é feito apenas quando o risco de sua realização é maior que o possível benefício que traria.
Prevenção
[editar | editar código-fonte]A prevenção do infarto do coração passa pela promoção da saúde e pela prevenção de doenças relacionadas como a apneia do sono, a arterioesclerose, o diabetes, a dislipidemia, aterosclerose e a hipertensão arterial.
Perfil radiômico de gordura (FRP)
[editar | editar código-fonte]A FRP é um biomarcador, ou 'impressão digital', que pode identificar pessoas com alto risco de um ataque cardíaco fatal pelo menos cinco anos antes de ocorrer, detectando bandeiras vermelhas biológicas no espaço perivascular que revestem os vasos sanguíneos que fornecem sangue ao coração.[22]
Tratamento
[editar | editar código-fonte]Devem-se levar em conta as características da dor, os antecedentes de doença cardiovascular, idade e fatores de risco na determinação da conduta inicial do paciente ao serviço médico. Com base nessa clínica, no ECG e nos marcadores séricos de necrose, obtém-se a estratificação inicial do risco para óbito ou IAM. Medidas básicas iniciais devem incluir: obtenção dos sinais vitais, oxigenação por cateter ou máscara, obtenção de acesso venoso, monitorização do risco cardíaco e saturação de O2, administração de 200 mg de aspirina por via oral, nitrato sublingual 5 mg, obtenção de ECG, administração endovenosa de morfina em situações de dor intensa sem melhora com nitrato. Pacientes candidatos a terapêutico para recanalização coronariana, farmacológica ou mecânica são aqueles em que o ECG mostra-se supradesnivelamento do segmento ST que não reverte após a administração de nitrato ou com bloqueio completo de ramo esquerdo novo. Paciente de alto risco para IAM, que devem ser encaminhado para Centros de Terapia Intensiva, são aqueles cujo ECG se mostra com um infradesnivelamento do segmento ST além de 1 mm ou ondas T invertidas com alta voltagem em múltiplas derivações. Alternativa para esses paciente é o uso de drogas endovenosas para estabilização de quadro clínico e o estudo cinecoronariográfico precoce em até 24 horas (imediatamente em casos refratário a medicação inicial). O tratamento farmacológico se faz com várias drogas atuantes em diferentes mecanismos da doença. Dentre os antiplaquetários podemos destacar a Aspirina (ação por inibição da ciclo-oxigenase no metabolismo do ácido aracdônico), os derivados tienopiridínico (antagonistas da ativação plaquetária mediada pelo ADP, clopidrogel, ticlopidina) e os antagonista dos receptores glicoproteicos IIb-IIIa (abciximab). Dezenas de estudos já comprovaram os efeitos benéficos da aspirina como conduta inicial, correlacionada com o menor grau de mortalidade, associada ou não a estreptoquinase.
Outra classe de medicamento útil no IAM são os antitrombínicos que têm ação sinérgica com os antiplaquetários. Podemos destacar as heparinas que atuam acelerando a ação da antitrombina circulantes, precipitando a inibição da trombina IIa e dos fatores IX e Xá. Medicamentos anti-isquêmicos têm função importantíssima no controle da sintomatologia do paciente. Os Nitratos têm seus efeitos benéficos através da redução da pré-carga e pós-carga, diminuindo o consumo de oxigênio, atuam também por diminuição do vasoespasmo coronariano e tem potencial inibição da agregação plaquetária. Os Betabloqueadores diminuem o consumo de oxigênio pelo miocárdio, controlando a frequência cardíaca e a pressão arterial, reduzindo a contratilidade. Podemos destacar metoprolol, propranolol. As contra indicações do seu uso é o broncoespasmo, hipotensão, bradiarritmias e insuficiência ventricular esquerda. Também são medicamentos bastante estudados em pesquisas multicêntrincas, que determinaram uma diminuição significativa em casos de infarto e óbito.
Antagonistas dos canais de cálcio atuam bloqueando a entrada de cálcio nas fibras miocárdicas, reduzindo a contratilidade e, consequentemente o consumo de oxigênio, atuam também nas paredes de vasos promovendo a vasodilatação e melhorando o fluxo coronariano para áreas isquêmicas. Inibidores da Enzima convertora da Angiotensina (iECA) têm se mostrado benéfico na prevenção de óbito, infarto e AVC em pacientes com doenças ateroscleróticas prévias com comprometimento coronariano. Também se beneficiam os portadores de cardiopatia isquêmica na medida em que controlam a hipertensão arterial, e são essenciais no tratamento da insuficiência cardíaca.4 Três estudos multicêntricos conseguiram demonstrar os benefícios dos iECA na prevenção da mortalidade a curto prazo.
Tratamento de reperfusão
[editar | editar código-fonte]É importante salientar que o tratamento do paciente com IAM já instalado baseia-se na reperfusão cardíaca precoce e restabelecimento da vitalidade das artérias coronarianas. Nesta etapa o tratamento é múltiplo e com abordagem farmacológica e cirúrgica.
Os trombolíticos devem ser usados precocemente, até 6 a 12 horas do início da sintomatologia, com cuidado para as contra-indicações absolutas: AVC hemorrágico prévio, neoplasia intracraniana conhecida, sangramento interno e suspeita de dissecção de aorta. Cuidado também para com os pacientes de idade acima de 75 anos pelo aumento de risco de AVC. Atualmente na prática clínica existem duas drogas trombolíticas para uso de rotina, a estreptoquinase e ativador tecidual de plasminogênio (t-PA).
Uma vantagem da estreptoquinase é seu baixo custo. Deve-se evitar nova administração desse trombolítico por pelo menos 2 anos devido a chance de alergia, não se associa a heparina de rotina devido ao risco aumentado de sangramentos.
Os t-PA devem ser usados em infusão acelerada e combinada com heparinização plena, é o trombolítico mais eficaz para recanalização coronária precoce, obtém-se maior patência do vaso em curto período de tempo. Seus custos ultrapassam bastante aos da estreptoquinase e com riscos ligeiramente maiores para hemorragia intracraniana.
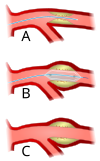
Outra abordagem no paciente com IAM é a angioplastia primária, realizada entre 6 a 12 horas de início dos sintomas. Essa terapêutica é uma alternativa ao tratamento com trombolíticos para reperfusão imediata do miocárdio isquêmico. A taxa de abertura da artéria ocluída é significantemente maior com a angioplastia primária do que com trombolítico. No entanto, a tradução dessa vantagem em benefício clínico não tem mesma magnitude. Importantes estudos revelam que pacientes tratados com angioplastia primária têm menos incidência de morte, reinfarto e doença cerebrovascular agudas aos 30 dias do infarto, mas que em 6 meses a 1 ano essa vantagem desaparece.
Contudo, mesmo no pior quadro, a angioplastia primária é no mínimo equivalente à terapia trombolítica e pode ser indicada formalmente se o paciente tem contra-indicação a esta última.
A vantagem da angioplastia em relação a terapia trombolítica são:
- Patência arterial precoce superior a 90%;
- Melhor manutenção de fluxo coronariano pleno;
- Menor lesão de reperfusão;
- Melhora da função ventricular;
- Redução da mortalidade no choque cardiogênico;
- Redução das taxas de reoclusão, reinfarto e mortalidade hospitalar;
- Menores taxas de mortalidade, de eventos isquêmicos e de insuficiência cardíaca em longo prazo;
- Menor risco de sangramento e AVC.
A angioplastia de salvamento é recomendada nos casos de insucesso do tratamento trombolítico, caracterizado principalmente como persistência do supradesnivelamento de ST e/ou da dor precordial. O advento dos stents e o uso de potentes antiplaquetários têm contribuído para um sucesso ainda maior da angioplastia. Estudos comparativos demonstraram as vantagens do tratamento angioplástico em relação ao trombolíticos, em se tratando de morte por reinfarto, proporcionando melhor conforto e estabilidade ao paciente.
Reperfusão coronária
[editar | editar código-fonte]Tratamento que visam recuperar a circulação (reperfusão) até 6 horas após a oclusão permitem o salvamento das células sob risco que ainda não necrosaram. Como o processo é contínuo, quanto mais precoce a intervenção, mais músculo é salvo no final do processo.
Por outro lado, a reperfusão acelera a necrose daquelas células que apresentam lesões irreversíveis, porém não parece acrescentar riscos adicionais àquelas com lesões reversíveis.
A reperfusão instabiliza ainda mais o coração, mas suas complicações são tratáveis em Unidades de Terapia Intensiva especiais, as (Unidades coronarianas).
São riscos da reperfusão:
- Lesão celular letal em células ainda viáveis;
- Lesão vascular pelo fenômeno de no-reflow e perda da reserva vasodilatadora;
- Miocárdio atordoado, que é uma prolongada disfunção contrátil pós-isquêmica;
- Arritmia de reperfusão, associada a sobrecarga de influxo de cálcio celular no tecido necrótico e à produção de radicais livres.
Prognóstico
[editar | editar código-fonte]O prognóstico, ou seja, a previsão de evolução, será tanto mais favorável quanto menor a área de infarto e mais precoce o seu tratamento.
Complicações
[editar | editar código-fonte]O infarto é um processo de necrose, morte celular. Imediatamente após sua ocorrência se inicia o processo de cicatrização local e readaptação do miocárdio restante as necessidades do corpo. Se não surgirem complicações, após alguns meses o processo cicatricial estará completo.
- Podem, no entretanto, ocorrer outras doenças decorrentes do infarto. São as chamadas complicações pós infarto.
- Sua gravidade se encontra dentro de uma faixa bem ampla de possibilidades, desde a morte súbita ou incapacidade permanente, até a ausência total de consequências para a vida futura do infartado.
São complicações possíveis:
- Arritmias cardíacas
- Distúrbios de condução ou bloqueios
- Insuficiência cardíaca
- Disfunções das válvulas cardíacas
- Aneurisma cardíaco
- Ruptura cardíaca, seja do septo interventricular, seja da parede externa do coração
- Pericardiopatias
- Tromboembolia pulmonar
- Tromboembolia sistêmica
- Choque cardiogênico
Epidemiologia
[editar | editar código-fonte]O enfarte agudo do miocárdio é a principal causa de morte nos países industrializados. Das mortes resultantes de enfarte, a maior parte é rápida, na primeira hora, em geral por uma arritmia severa denominada Fibrilação ventricular. Nos Estados Unidos, cerca de 25% das mortes são devidas a este problema, o que dá um número absoluto em torno de um milhão e quinhentas mil pessoas a cada ano. Um em cada 25 pacientes com alta hospitalar morre no primeiro ano pós enfarte. A mortalidade pós enfarte é diferente conforme a faixa etária, sendo maior nas faixas etárias mais avançadas.
Cerca de 60% dos óbitos acontecem na primeira hora após início dos sintomas.[23]
Referências
- ↑ a b «What Are the Signs and Symptoms of Coronary Heart Disease?». www.nhlbi.nih.gov/. 29 de setembro de 2014. Consultado em 23 de fevereiro de 2015
- ↑ a b c d e «What Is a Heart Attack?». www.nhlbi.nih.gov/. 17 de dezembro de 2013. Consultado em 24 de fevereiro de 2015
- ↑ a b «Heart Attack or Sudden Cardiac Arrest: How Are They Different?». www.heart.org/. 30 de julho de 2014. Consultado em 24 de fevereiro de 2015
- ↑ a b Mehta, PK; Wei, J; Wenger, NK (16 de outubro de 2014). «Ischemic heart disease in women: A focus on risk factors.». Trends in Cardiovascular Medicine. 25 (2): 140–151. PMID 25453985. doi:10.1016/j.tcm.2014.10.005
- ↑ a b Mendis, Shanthi; Puska,, Pekka; Norrving, Bo (2011). Global atlas on cardiovascular disease prevention and control (PDF) 1st ed. Geneva: World Health Organization in collaboration with the World Heart Federation and the World Stroke Organization. pp. 3–18. ISBN 9789241564373
- ↑ a b c «How Is a Heart Attack Diagnosed?». www.nhlbi.nih.gov/. 17 de dezembro de 2013. Consultado em 24 de fevereiro de 2015
- ↑ a b c d e f g h i Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology, (ESC); Steg, PG; James, SK; Atar, D; Badano, LP; Blömstrom-Lundqvist, C; Borger, MA; Di Mario, C; Dickstein, K; Ducrocq, G; Fernandez-Aviles, F; Gershlick, AH; Giannuzzi, P; Halvorsen, S; Huber, K; Juni, P; Kastrati, A; Knuuti, J; Lenzen, MJ; Mahaffey, KW; Valgimigli, M; van 't Hof, A; Widimsky, P; Zahger, D (outubro de 2012). «ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation.». European Heart Journal. 33 (20): 2569–619. PMID 22922416. doi:10.1093/eurheartj/ehs215
- ↑ a b c d e O'Connor, RE; Brady, W; Brooks, SC; Diercks, D; Egan, J; Ghaemmaghami, C; Menon, V; O'Neil, BJ; Travers, AH; Yannopoulos, D (2 de novembro de 2010). «Part 10: acute coronary syndromes: 2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care.». Circulation. 122 (18 Suppl 3): S787-817. PMID 20956226. doi:10.1161/CIRCULATIONAHA.110.971028
- ↑ GBD 2015 Disease Injury Incidence Prevalence Collaborators (outubro de 2016). «Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015». Lancet. 388 (10053): 1545–1602. PMC 5055577
 . PMID 27733282. doi:10.1016/S0140-6736(16)31678-6
. PMID 27733282. doi:10.1016/S0140-6736(16)31678-6 - ↑ Coventry, LL; Finn, J; Bremner, AP (2011). «Sex differences in symptom presentation in acute myocardial infarction: a systematic review and meta-analysis.». Heart & lung : the journal of critical care. 40 (6): 477–91. PMID 22000678. doi:10.1016/j.hrtlng.2011.05.001
- ↑ Valensi P, Lorgis L, Cottin Y; Lorgis; Cottin (março de 2011). «Prevalence, incidence, predictive factors and prognosis of silent myocardial infarction: a review of the literature». Arch Cardiovasc Dis. 104 (3): 178–88. PMID 21497307. doi:10.1016/j.acvd.2010.11.013
- ↑ «What Causes a Heart Attack?». www.nhlbi.nih.gov. 17 de dezembro de 2013. Consultado em 24 de fevereiro de 2015
- ↑ Devlin, RJ; Henry, JA (2008). «Clinical review: Major consequences of illicit drug consumption.». Critical care (London, England). 12 (1). 202 páginas. PMC 2374627
 . PMID 18279535. doi:10.1186/cc6166
. PMID 18279535. doi:10.1186/cc6166 - ↑ Collet, Jean-Philippe; Thiele, Holger; Barbato, Emanuele; Barthélémy, Olivier; Bauersachs, Johann; Bhatt, Deepak L; Dendale, Paul; Dorobantu, Maria; Edvardsen, Thor (29 de agosto de 2020). «2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation». European Heart Journal (14): 1289–1367. ISSN 0195-668X. doi:10.1093/eurheartj/ehaa575. Consultado em 17 de setembro de 2022
- ↑ Hamm CW, Bassand JP, Agewall S, Bax J, Boersma E, Bueno H, Caso P, Dudek D, Gielen S, Huber K, Ohman M, Petrie MC, Sonntag F, Uva MS, Storey RF, Wijns W, Zahger D (dezembro de 2011). «ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: The Task Force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC)». Eur. Heart J. 32 (23): 2999–3054. PMID 21873419. doi:10.1093/eurheartj/ehr236
- ↑ Global Burden of Disease Study 2013, Collaborators (22 de agosto de 2015). «Global, regional, and national incidence, prevalence, and years lived with disability for 301 acute and chronic diseases and injuries in 188 countries, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013.». Lancet (London, England). 386 (9995): 743–800. PMID 26063472. doi:10.1016/s0140-6736(15)60692-4
- ↑ White HD, Chew DP; Chew (agosto de 2008). «Acute myocardial infarction». Lancet. 372 (9638): 570–84. PMID 18707987. doi:10.1016/S0140-6736(08)61237-4
- ↑ O'Gara PT, Kushner FG, Ascheim DD, Casey DE, Chung MK, de Lemos JA, Ettinger SM, Fang JC, Fesmire FM, Franklin BA, Granger CB, Krumholz HM, Linderbaum JA, Morrow DA, Newby LK, Ornato JP, Ou N, Radford MJ, Tamis-Holland JE, Tommaso CL, Tracy CM, Woo YJ, Zhao DX, Anderson JL, Jacobs AK, Halperin JL, Albert NM, Brindis RG, Creager MA, DeMets D, Guyton RA, Hochman JS, Kovacs RJ, Kushner FG, Ohman EM, Stevenson WG, Yancy CW (29 de janeiro de 2013). «2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines.». Circulation. 127 (4): e362–425. PMID 23247304. doi:10.1161/CIR.0b013e3182742cf6
- ↑ Moran, AE; Forouzanfar, MH; Roth, GA; Mensah, GA; Ezzati, M; Flaxman, A; Murray, CJ; Naghavi, M (8 de abril de 2014). «The global burden of ischemic heart disease in 1990 and 2010: the Global Burden of Disease 2010 study.». Circulation. 129 (14): 1493–501. PMID 24573351. doi:10.1161/circulationaha.113.004046
- ↑ Infarto Agudo do Miocárdio. Portal Banco de Saúde. Infarto Agudo do Miocardio: Guia 2008
- ↑ Ronco e apneia do sono
- ↑ «AI technology to predict deadly heart attacks». Tech Explorist (em inglês). 4 de setembro de 2019. Consultado em 5 de setembro de 2019
- ↑ Heart Attack. National Heart Lung and Blood Institute (EUA). 2008. Heart Attack


 French
French Deutsch
Deutsch