Adalimumab – Wikipedia, wolna encyklopedia
| ||
| Identyfikacja | ||
| numer CAS | ||
|---|---|---|
| Klasyfikacja medyczna | ||
| ATC | ||
| Stosowanie w ciąży | kategoria B | |
| Farmakokinetyka | ||
| Działanie | przeciwciała przeciw TNF-α | |
| Biodostępność | 64% | |
| Okres półtrwania | 10–20 dni | |
| Wydalanie | brak danych | |
| Uwagi terapeutyczne | ||
| Drogi podawania | zastrzyk podskórny | |
Adalimumab – lek immunosupresyjny, rekombinowane ludzkie przeciwciało monoklonalne skierowane przeciw TNF-α. Działa selektywnie, inaktywując wspomniany czynnik poprzez bezpośrednie przyłączenie się do niego. Stosowany w leczeniu niektórych zapaleń stawów związanych z procesem autoimmunologicznym, w łuszczycy oraz w chorobie Crohna.
Mechanizm działania
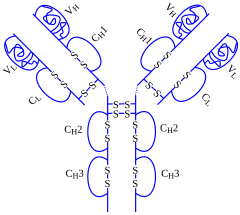
[edytuj | edytuj kod]Adalimumab jest rekombinowanym ludzkim przeciwciałem monoklonalnym[1] klasy IgG1 skierowanym przeciw czynnikowi TNF-α[2][3]. Wiąże się swoiście z TNF-α i niweluje jego aktywność. Na skutek działania leku dochodzi do hamowania interakcji podjednostki α cząsteczki TNF z receptorami p55 oraz p75 znajdującymi się na powierzchni komórki[4]. Adalimumab moduluje ponadto odpowiedź biologiczną regulowaną normalnie przez TNF w zakresie różnych mechanizmów, między innymi na poziomie cząsteczek adhezji międzykomórkowej odpowiedzialnych za zjawisko migracji leukocytów (cząsteczki ELAM-1, VCAM-1, ICAM-1)[5]. W badaniach klinicznych obserwowano zmniejszenie aktywności białka CRP oraz innych wskaźników ostrej fazy stanu zapalnego (OB, IL-6) w surowicy krwi pacjentów z reumatoidalnym zapaleniem stawów leczonych adalimumabem. Stwierdzano także obniżenie stężenia metaloproteinaz macierzy (MMP-1, MMP-3), odpowiedzialnych między innymi za niszczenie chrząstki stawowej u tych chorych[5]. Spadek aktywności CRP obserwowano również u pacjentów z chorobą Crohna[6].
Wskazania do stosowania
[edytuj | edytuj kod]Adalimumab jest zarejestrowany w leczeniu następujących chorób:
- reumatoidalne zapalenie stawów[7]
- młodzieńcze idiopatyczne zapalenie stawów[1]
- łuszczycowe zapalenie stawów[7]
- zesztywniające zapalenie stawów kręgosłupa[7]
- choroba Crohna[1][8]
- łuszczyca[1]
Reumatoidalne zapalenie stawów
[edytuj | edytuj kod]Lek stosuje się w okresie aktywnej choroby o umiarkowanym lub dużym nasileniu tylko u pacjentów dorosłych, u których nie uzyskano wystarczającej odpowiedzi po zastosowaniu innych leków modyfikujących przebieg choroby[9], w tym metotreksatu. Ponadto lek jest wykorzystywany w terapii ciężkiej, aktywnej i postępującej postaci choroby u dorosłych dotychczas nie leczonych metotreksatem. W obu przypadkach lek podaje się w skojarzeniu z metotreksatem lub w monoterapii, jeśli metotreksat jest źle tolerowany przez pacjenta lub dalsze jego podawanie mogłoby być szkodliwe[7].
Skuteczność oraz bezpieczeństwo stosowania adalimumabu w leczeniu reumatoidalnego zapalenia stawów potwierdzono w kilku randomizowanych badaniach klinicznych, które prowadzono metodą podwójnie ślepej próby, z udziałem grup kontrolnych, a więc zgodnie z zasadami EBM (Medycyna oparta na faktach). W badaniu ARMADA obserwowano 271 dorosłych pacjentów z czynnym reumatoidalnym zapaleniem stawów – na podstawie oceny parametrów tzw. skali ACR (liczba bolesnych i opuchniętych stawów, ocena aktywności choroby i dolegliwości bólowych przez lekarza i przez pacjenta, współczynnik niepełnosprawności HAQ oraz wartości CRP) wykazano poprawę u chorych leczonych adalimumabem w porównaniu z placebo[10][11]. Podobnie w innym badaniu opublikowanym w 2004 roku z udziałem 619 dorosłych chorych z reumatoidalnym zapaleniem stawów leczonych adalimumabem obserwowano poprawę parametrów w skali ACR, opóźnienie rozwoju choroby określane na podstawie zmian radiologicznych oraz poprawę jakości życia[12]. Z kolei w badaniu PREMIER, w którym wzięło udział 799 dorosłych pacjentów z aktywnym wczesnym reumatoidalnym zapaleniem stawów, obserwowano najlepszą odpowiedź na leczenie (na podstawie parametrów skali ACR) u chorych leczonych jednocześnie adalimumabem i metotreksatem (w porównaniu do chorych otrzymujących sam metotreksat lub adalimumab). W badaniu tym obserwowano również poprawę w badaniach radiologicznych oraz polepszenie jakości życia we wspomnianej grupie[13]. Korzystne wyniki leczenia reumatoidalnego zapalenia stawów po zastosowaniu adalimumabu obserwowano także w badaniu STAR[14].
| Odpowiedź | Placebo + metotreksat | Adalimumab + metotreksat |
|---|---|---|
| ACR 20 | 14,5% | 67,2% |
| ACR 50 | 8,1% | 55,2% |
| ACR 70 | 4,8% | 26,9% |
Młodzieńcze idiopatyczne zapalenie stawów
[edytuj | edytuj kod]Adalimumab stosuje się u młodzieży chorej na aktywne młodzieńcze idiopatyczne zapalenie stawów w wieku 13–17 lat. Lek podaje się w skojarzeniu z metotreksatem u chorych, u których nie było wystarczającej odpowiedzi po podaniu leków modyfikujących przebieg choroby. W przypadku nietolernacji metotreksatu bądź przeciwwskazań do jego stosowania, adalimumab można zastosować w monoterapii[1].
Skuteczność oraz bezpieczeństwo adalimumabu u chorych z młodzieńczym idiopatycznym zapaleniem stawów potwierdzono w randomizowanym badaniu klinicznym z wykorzystaniem metody ślepej próby, przeprowadzanym w wielu ośrodkach. W badaniu wzięło udział 171 dzieci w wieku od 4 do 17 lat[15].
Łuszczycowe zapalenie stawów
[edytuj | edytuj kod]Adalimumab podaje się w leczeniu aktywnej i postępującej postaci choroby u pacjentów dorosłych, jeśli odpowiedź na stosowane wcześniej leki modyfikujące przebieg choroby jest niewystarczająca[7].
W badaniu klinicznym ADEPT, z udziałem 313 pacjentów chorych na łuszczycowe zapalenie stawów leczonych adalimumbem, opisywano istotną poprawę parametrów ocenianych w wyżej wspomnianej skali ACR w porównaniu z grupą uczestników badania otrzymujących placebo[16]. Skuteczność adalimumabu w tej chorobie potwierdzono również w innym wieloośrodkowym badaniu z udziałem 100 chorych nadzorowanym przez lekarzy ze Stanford University Medical Center[17].
Zesztywniające zapalenie stawów kręgosłupa
[edytuj | edytuj kod]Adalimumab podaje się tylko u chorych dorosłych z ciężką postacią choroby, jeśli leczenie standardowe nie przyniosło skutku[7].
W badaniu z udziałem 315 chorych na zesztywniające zapalenie stawów kręgosłupa, uzyskano wyniki, na podstawie których wykazano istotną poprawę objawów przedmiotowych i podmiotowych choroby u pacjentów leczonych adalimumabem w porównaniu do placebo. Korzystny efekt obserwowano już w drugim tygodniu terapii[18]. W powyższym badaniu wykazano, że leczenie adalimumabem istotnie poprawia jakość życia chorych[19]. Podobne obserwacje poczyniono także w badaniu ATLAS przeprowadzonym w Kanadzie z udziałem 82 dorosłych pacjentów[20].
Choroba Crohna
[edytuj | edytuj kod]Skuteczność i bezpieczeństwo stosowania adalimuambu obserwowano u pacjentów z chorobą Crohna o umiarkowanym lub ciężkim przebiegu w randomizowanych badaniach klinicznych, przeprowadzonych metodą podwójnie ślepej próby, z kontrolną grupą chorych otrzymującą placebo[21]. W kontekście uzyskania indukcji remisji klinicznej lek kontrolowano w dwóch badaniach. W badaniu CLASSIC I z udziałem 299 pacjentów nie leczonych wcześniej lekami biologicznymi wykazano zwiększenie odsetka uzyskanych remisji w stosunku do grupy otrzymującej placebo[22]. Podobne wyniki uzyskano w badaniu GAIN, w którym wzięło udział 325 ludzi otrzymujących wcześniej infliksymab[21]. W innym badaniu CHARM z udziałem 854 chorych oceniano z kolei utrzymywanie się uzyskanej wcześniej remisji choroby. Stwierdzono zwiększenie odsetka pacjentów, u których utrzymywała się remisja, w grupie leczonej adalimumabem w porównaniu z grupą przyjmującą placebo[23]. W 2006 roku w wytycznych European Crohn’s and Colitis Organisation (ECCO) umieszczono informację o prawdopodobnym wykorzystaniu terapii adalimumabem u dorosłych osób z chorobą Crohna, u których po początkowej skuteczności leczenia infliksymabem, następuje nawrót choroby[3]. Od tego czasu wskazania do stosowania adalimumabu uległy rozszerzeniu – lek jest zarejestrowany do stosowania u pacjentów z ciężką, aktywną postacią choroby, u których nie uzyskano wystarczającej odpowiedzi na właściwą terapię kortykosteroidami lub lekami immunosupresyjnymi albo u chorych, którzy nie tolerują takiego leczenia bądź jest ono u nich przeciwwskazane. Zaleca się by adalimumab w indukcji terapii był stosowany razem z kortykosteroidami. Lek można podawać też w monoterapii jeśli kortykosteroidy są źle tolerowane przez pacjenta lub podawanie ich nie jest wskazane[1][8]. W 2009 roku ukazała się praca, której autorzy, oceniając działanie adalimumabu u 3160 pacjentów z chorobą Crohna otrzymujących ten lek w ramach badań klinicznych, uznali, że jest on w tej grupie podobnie bezpieczny jak inne antagonisty TNF-α, a częstość niepożądanych działań adalimumabu podczas 10-letniej obserwacji u tych pacjentów była podobna jak u osób otrzymujących wspomniany lek w związku z innymi zaakceptowanymi wskazaniami[24].
W Polsce w 2007 roku Narodowy Fundusz Zdrowia wprowadził program terapeutyczny pozwalający na refundację leczenia adalimumabem dorosłych pacjentów z chorobą Crohna[25].
| Placebo | Adalimumab 40 mg co 2 tygodnie | Adalimumab 40 mg co tydzień | |
|---|---|---|---|
| Ocena po 26 tygodniach | 17% | 40% | 47% |
| Ocena po 56 tygodniach | 12% | 36% | 41% |
Łuszczyca
[edytuj | edytuj kod]Adalimumab badano pod kątem skuteczności i bezpieczeństwa u dorosłych chorych na łuszczycę pospolitą. Opisano wyniki dwóch randomizowanych badań klinicznych z wykorzystaniem metody podwójnie ślepej próby. W trójetapowym badaniu klinicznym III fazy REVEAL wzięło udział 1212 pacjentów i porównywano w nim skuteczność leku w stosunku do placebo. Uzyskano istotną poprawę w grupie chorych otrzymujących adalimumab (ocena między innymi na podstawie wskaźnika PASI[26] i DLQI[27]) po 16 tygodniach leczenia w porównaniu do grupy, której podawano placebo[1][28]. Z kolei w badaniu CHAMPION, w którym wzięło udział 271 pacjentów z łuszczycą, porównywano skuteczność adalimumabu stosowanego u części badanych w stosunku do grup kontrolnych otrzymujących placebo lub metotreksat. Również w tym badaniu uzyskano lepszą odpowiedź na leczenie adalimumabem (ocena wskaźnika PASI) i poprawę wskaźnika DLQI w porównaniu do grup kontrolnych po 16 tygodniach[1][29].
Terapię adalimumabem zaleca się u chorych z umiarkowaną albo ciężką postacią łuszczycy pospolitej, którzy nie odpowiedzieli na innego typu terapię ogólnoustrojową, w tym metotreksat, cyklosporynę lub PUVA albo takie leczenie jest u nich przeciwwskazane bądź źle tolerowane[1].
Zastosowania w trakcie badań
[edytuj | edytuj kod]Wrzodziejące zapalenie jelita grubego
[edytuj | edytuj kod]Do leczenia chorych z opornym na standardową terapię wrzodziejącym zapaleniem jelita grubego o ciężkim lub średnio-ciężkim przebiegu, z grupy przeciwciał przeciw TNF-α znajduje zastosowanie infliksymab[30]. Adalimumab był również stosowany w badaniach klinicznych u pacjentów z wrzodziejącym zapaleniem jelita grubego. Stwierdzono jednak, że w przypadku tego leku uzyskuje się mniejsze korzyści terapeutyczne niż u pacjentów z chorobą Crohna otrzymujących podobne dawki[31]. W jednoośrodkowym badaniu z 2010 roku, mimo stwierdzenia nieco mniejszej odpowiedzi na terapię adalimumabem niż infliksymabem zarówno w fazie indukującej, jak i podtrzymującej remisję wrzodziejącego zapalenia jelita grubego, uznano za efektywne działanie obu leków[32]. W 2009 roku opublikowano wyniki badania przeprowadzonego na grupie 20 pacjentów z aktywnym wrzodziejącym zapaleniem jelita grubego, w tym chorych otrzymujących wcześniej infliksymab, na podstawie którego stwierdzono, iż adalimumab jest dobrze tolerowany u chorych z tą jednostką chorobową i wykazuje podobną skuteczność u chorych nieleczonych wcześniej infliksymabem, leczonych tym lekiem bez uzyskania odpowiedzi bądź źle go tolerujących[33].
Działania niepożądane
[edytuj | edytuj kod]Niekorzystne działania adalimumabu występują z różną częstością. Bardzo często występują infekcje górnych dróg oddechowych. Często pojawiają się zakażenia dolnych dróg oddechowych, grypa, grzybice skóry i błon śluzowych, niedokrwistość, limfopenia, ból i zawroty głowy, kaszel, przekrwienie błony śluzowej nosa, nadciśnienie tętnicze, nudności, biegunka, ból brzucha, nadżerki i owrzodzenia w jamie ustnej, wysypka, świąd, rumień, wypadanie włosów, zapalenie stawów, zmęczenie, hipertransaminazemia. Rzadziej obserwowano posocznicę, zakażenia ran, zakażenia skóry, ropnie, zapalenie tkanki łącznej, czyraki, zanokcicę, stany zapalne w jamie ustnej, zapalenie ucha, zapalenie błony śluzowej żołądka i jelit, drożdżycę, grzybicę pochwy u kobiet, brodawczaka skóry, leukopenię lub neutropenię, leukocytozę, trombocytopenię, limfadenopatię, reakcje alergiczne łącznie z anafilaksją, anoreksję, depresję, bezsenność lub nadmierną senność, migrenę, neuropatie, hipercholsterolemię, hiperurykemię, hiperglikemię i inne zaburzenia[7].
U pacjentów leczonych adalimumabem opisywano przypadki gruźlicy, a zwłaszcza rozsianej postaci tej choroby[1]. Zwraca się też uwagę na działania niepożądane obserwowane już po wprowadzeniu leku do obrotu oraz w badaniach klinicznych IV fazy: reaktywację wirusowego zapalenia wątroby typu B, choroby demielinizacyjne w tym zapalenie nerwu wzrokowego, śródmiąższowe choroby płuc z uwzględnieniem ich włóknienia, zapalenie naczyń skóry[1].
W niektórych badaniach klinicznych obserwowano niewielki wzrost zachorowań na nowotwory złośliwe, w tym chłoniaki, w grupie pacjentów leczonych antagonistami TNF-α w porównaniu z grupą kontrolną leczoną placebo. Przypadki te występowały jednak rzadko[1].
Przeciwwskazania
[edytuj | edytuj kod]Przeciwwskazania do stosowania adalimumabu występują w następujących stanach i schorzeniach[7]:
- nietolerancja któregokolwiek ze składników preparatu, reakcje alergiczne
- aktywna gruźlica
- posocznica
- zakażenia wywołane przez drobnoustroje oportunistyczne
- niewydolność serca klasy III i IV NYHA
- wiek poniżej 18 roku życia.
Środki ostrożności i interakcje
[edytuj | edytuj kod]Pacjenci, u których planowane jest leczenie adalimumabem powinni być poddani przed leczeniem diagnostyce w kierunku gruźlicy. Należy u tych chorych wykonać próbę tuberkulinową oraz badanie zdjęcie rentgenowskie klatki piersiowej. Jednocześnie należy pamiętać o ryzyku fałszywie ujemnych wyników próby tuberkulinowej u ciężko chorych z zaburzeniami odporności. Wykrycie czynnej gruźlicy jest przeciwwskazaniem do włączenia leku, w przypadku postaci utajonej przed włączeniem adalimumabu należy wdrożyć profilaktykę przeciwgruźliczą zgodnie z lokalnym schematem postępowania. Monitorowanie stanu chorego w kierunku wykrycia gruźlicy należy prowadzić przed leczeniem, w jego trakcie oraz 5 miesięcy po jego zakończeniu. Pacjenci powinni być poinformowani, że w przypadku wystąpienia objawów mogących wskazywać na gruźlicę (przewlekły kaszel, stan podgorączkowy, utrata masy ciała), powinni natychmiast zgłosić się do lekarza[1][7].
Należy także pamiętać o wykonaniu badań diagnostycznych w przypadku pojawienia się u chorego objawów innego niż gruźlica zakażenia. W przypadku wystąpienia poważnego zakażenia leczenie adalimumabem powinno zostać przerwane do czasu jego wyleczenia[7].
Zaleca się zachowanie ostrożności w stosowaniu adalimumabu w przypadku pacjentów z chorobami demielinizacyjnymi ośrodkowego układu nerwowego, u osób z niewydolnością serca w stopniu I lub II NYHA, z chorobami układu krwiotwórczego, u pacjentów operowanych, u chorych na nowotwory[7].
Nie zaleca się stosowania adalimumabu z anakinrą, w związku ze zwiększeniem ryzyka ciężkich zakażeń i neutropenii[7].
Stosowanie leku w ciąży
[edytuj | edytuj kod]Kategoria B. Nie zaleca się stosowania leku w ciąży. Podczas leczenia i w ciągu 5 miesięcy po jego zakończeniu należy stosować leczenie antykoncepcyjne. W tym czasie pacjentki powinny się także powstrzymać od karmienia piersią[7].
Dawkowanie
[edytuj | edytuj kod]Lek podaje się tylko metodą iniekcji podskórnej. W reumatoidalnym zapaleniu stawów zaleca się podawanie preparatu w dawce 40 mg co 2 tygodnie, maksymalnie 40 mg co tydzień. W trakcie podawania leku należy kontynuować terapię metotreksatem. W łuszczycowym zapaleniu stawów i zesztywniającym zapaleniu stawów kręgosłupa podaje się 40 mg leku co 2 tygodnie[7]. W ciężkiej chorobie Crohna w celu wywołania indukcji remisji podaje się wstępnie 80 mg adalimumabu i następnie 40 mg po 2 tygodniach, aby uzyskać szybszy efekt można podać 160 mg leku w pierwszym tygodniu terapii i następnie 80 mg po 2 tygodniach. W celu podtrzymania remisji choroby Crohna podaje się 40 mg adalimumabu co 2 tygodnie[1]. W przypadku braku odpowiedzi na leczenie w ciągu 12 tygodni należy rozważyć celowość kontynuacji terapii[7]. Zalecana pierwsza dawka adalimumabu w łuszczycy to 80 mg, a następnie po upływie tygodnia od pierwszej dawki podaje się 40 mg co 2 tygodnie, przy czym po 16 tygodniach w przypadku braku poprawy należy rozważyć sensowność dalszej terapii[1].
Historia
[edytuj | edytuj kod]Adalimumab po raz pierwszy został zastosowany u pacjentów z umiarkowaną lub ciężką postacią reumatoidalnego zapalenia stawów w roku 2002; następnie zaczęto go wykorzystywać w terapii innych schorzeń reumatycznych. Badania nad adalimumabem w leczeniu RZS trwają od ponad 9 lat. Producent leku podaje, że na świecie tym specyfikiem leczonych było ponad 180 tysięcy osób[34].
Preparaty
[edytuj | edytuj kod]- Humira[7]
Przypisy
[edytuj | edytuj kod]- ↑ a b c d e f g h i j k l m n o Informacja o leku na stronie European Medicines Agency.
- ↑ Filipowicz-Sosnowska A. Leczenie biologiczne w chorobach reumatycznych. „Przew lek”. 5, s. 27–33, 2004.
- ↑ a b Travis SPL, Stange EF, Lémann M, et al. European evidence based consensus on the diagnosis and management of Crohn’s disease: current management. „Gut”. 55. Suppl. 1, s. i16-i35, 2006.
- ↑ Mease PJ. Adalimumab: an anti-TNF agent for the treatment of psoriatic arthritis. „Expert Opin Biol Ther”. 5. 11, s. 1491–1504, 2005. PMID: 16255652.
- ↑ a b Fenner H. Immunopharmacologic profile and therapeutic prospects of anti-TNF-alpha therapy. „Z Rheumatol”. 57. 5, s. 294–297, 1998. PMID: 9864833.
- ↑ Seiderer J, Brand S, Dambacher J, e al. Adalimumab in patients with Crohn’s disease--safety and efficacy in an open-label single centre study. „Aliment Pharmacol Ther”. 25. 7, s. 787–796, 2007. PMID: 17373917.
- ↑ a b c d e f g h i j k l m n o p Indeks Leków Medycyny Praktycznej. Kraków: Wydawnictwo Medycyna Praktyczna, 2007, s. 48–49. ISBN 978-83-7430-110-7.
- ↑ a b Humira.com. [dostęp 2007-09-16]. [zarchiwizowane z tego adresu (2007-09-16)].
- ↑ Ang. disease-modifying anti-rheumatic drugs – DMARDs.
- ↑ a b Weinblatt ME, Keystone EC, Furst DE, et al. Adalimumab, a fully human anti-tumor necrosis factor alpha monoclonal antibody, for the treatment of rheumatoid arthritis in patients taking concomitant methotrexate: the ARMADA trial. „Arthritis Rheum”. 48. 1, s. 35–45, 2003. PMID: 12528101.
- ↑ Weinblatt ME, Keystone EC, Furst DE, et al. Long term efficacy and safety of adalimumab plus methotrexate in patients with rheumatoid arthritis: ARMADA 4 year extended study. „Ann Rheum Dis”. 65. 6, s. 753–759, 2006. PMID: 16308341.
- ↑ Keystone EC, Kavanaugh AF, Sharp JT, et al. Radiographic, clinical, and functional outcomes of treatment with adalimumab (a human anti-tumor necrosis factor monoclonal antibody) in patients with active rheumatoid arthritis receiving concomitant methotrexate therapy: a randomized, placebo-controlled, 52-week trial. „Arthritis Rheum”. 50. 5, s. 1400–1411, 2004. PMID: 15146409.
- ↑ Breedveld FC, Weisman MH, Kavanaugh AF, et al. The PREMIER study: A multicenter, randomized, double-blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patients with early, aggressive rheumatoid arthritis who had not had previous methotrexate treatment. „Arthritis Rheum”. 54. 1, s. 26–37, 2006. PMID: 16385520.
- ↑ Furst DE, Schiff MH, Fleischmann RM, et al. Adalimumab, a fully human anti tumor necrosis factor-alpha monoclonal antibody, and concomitant standard antirheumatic therapy for the treatment of rheumatoid arthritis: results of STAR (Safety Trial of Adalimumab in Rheumatoid Arthritis). „J Rheumatol”. 12, s. 2563–2571, 2003. PMID: 14719195.
- ↑ Lovell DJ., Ruperto N., Goodman S., Reiff A., Jung L., Jarosova K., Nemcova D., Mouy R., Sandborg C., Bohnsack J., et al. Adalimumab with or without methotrexate in juvenile rheumatoid arthritis. „The New England journal of medicine”. 8 (359), s. 810–820, sierpień 2008. DOI: 10.1056/NEJMoa0706290. PMID: 18716298.
- ↑ Simpson D, Scott LJ. Adalimumab: in psoriatic arthritis. „Drugs”. 66. 11, s. 1487–1496, 1497–9, 2006. PMID: 16906782.
- ↑ Genovese MC, Mease PJ, Thomson GT, et al. Safety and efficacy of adalimumab in treatment of patients with psoriatic arthritis who had failed disease modifying antirheumatic drug therapy. „J Rheumatol”. 34. 5, s. 1040–1050, 2007. PMID: 17444593.
- ↑ van der Heijde D, Kivitz A, Schiff MH, et al. Efficacy and safety of adalimumab in patients with ankylosing spondylitis: results of a multicenter, randomized, double-blind, placebo-controlled trial. „Arthritis Rheum”. 54. 7, s. 2136–2146, 2006. PMID: 16802350.
- ↑ Davis JC Jr, Revicki D, van der Heijde DM, et al. Health-related quality of life outcomes in patients with active ankylosing spondylitis treated with adalimumab: results from a randomized controlled study. „Arthritis Rheum”. 57. 6, s. 1050–1057, 2007. PMID: 17665483.
- ↑ W.P. Maksymowych. Update on the treatment of ankylosing spondylitis. „Ther Clin Risk Manag”. 3 (6), s. 1125–1133, Dec 2007. PMID: 18516314.
- ↑ a b Plosker GL, Lyseng-Williamson KA. Adalimumab: in Crohn’s disease. „BioDrugs”. 21. 2, s. 125–132, 2007. PMID: 17402796.
- ↑ Hanauer SB, Sandborn WJ, Rutgeerts P, et al. Human anti-tumor necrosis factor monoclonal antibody (adalimumab) in Crohn’s disease: the CLASSIC-I trial. „Gastroenterology”. 130. 2. s. 323–333. PMID: 16472588.
- ↑ a b Colombel JF, Sandborn WJ, Rutgeerts P, et al. Adalimumab for maintenance of clinical response and remission in patients with Crohn’s disease: the CHARM trial. „Gastroenterology”. 132. 1, s. 52–65, 2007. PMID: 17241859.
- ↑ J.F. Colombel, W.J. Sandborn, R. Panaccione, A.M. Robinson i inni. Adalimumab safety in global clinical trials of patients with Crohn’s disease. „Inflamm Bowel Dis”. 15 (9), s. 1308–1319, Sep 2009. DOI: 10.1002/ibd.20956. PMID: 19434735.
- ↑ Monika Wysocka, Choroba Leśniowskiego-Crohna: przełom w leczeniu [online], Puls Medycyny, 5 grudnia 2007 [zarchiwizowane z adresu 2013-05-03].
- ↑ Ang. Psoriasis Area and Severity Index.
- ↑ Ang. Dermatology Life Quality Index.
- ↑ Menter A, Tyring SK, Gordon K, Kimball AB, Leonardi CL, Langley RG, Strober BE, Kaul M, Gu Y, Okun M, et al. Adalimumab therapy for moderate to severe psoriasis: A randomized, controlled phase III trial. „J Am Acad Dermatol”. 1 (58), s. 106–115, styczeń 2007. DOI: 10.1016/j.jaad.2007.09.010. PMID: 17936411.
- ↑ Saurat JH, Stingl G, Dubertret L, Papp K, Langley RG, Ortonne JP, Unnebrink K, Kaul M, Camez A, Bagot M, et al. Efficacy and safety results from the randomized controlled comparative study of adalimumab vs. methotrexate vs. placebo in patients with psoriasis (CHAMPION). „Br J Dermatol”. 3 (158), s. 558–566, marzec 2008. DOI: 10.1111/j.1365-2133.2007.08315.x. PMID: 18047523.
- ↑ G.R. D’Haens, R. Panaccione, P.D. Higgins, S. Vermeire i inni. The London Position Statement of the World Congress of Gastroenterology on Biological Therapy for IBD With the European Crohn’s and Colitis Organization: When to Start, When to Stop, Which Drug to Choose, and How to Predict Response?. „Am J Gastroenterol”, Nov 2010. DOI: 10.1038/ajg.2010.392. PMID: 21045814.
- ↑ S.B. Hanauer. The role of biologics in ulcerative colitis. „Dig Dis”. 28 (3), s. 497–500, 2010. DOI: 10.1159/000320408. PMID: 20926878.
- ↑ N. Gies, K.I. Kroeker, K. Wong, R.N. Fedorak. Treatment of ulcerative colitis with adalimumab or infliximab: long-term follow-up of a single-centre cohort. „Aliment Pharmacol Ther”. 32 (4), s. 522–528, Aug 2010. DOI: 10.1111/j.1365-2036.2010.04380.x. PMID: 20500733.
- ↑ W. Afif, J.A. Leighton, S.B. Hanauer, E.V. Loftus i inni. Open-label study of adalimumab in patients with ulcerative colitis including those with prior loss of response or intolerance to infliximab. „Inflamm Bowel Dis”. 15 (9), s. 1302–1307, Sep 2009. DOI: 10.1002/ibd.20924. PMID: 19408340.
- ↑ Humira.com – About Humira. [dostęp 2007-09-26]. [zarchiwizowane z tego adresu (2007-10-08)].


 French
French Deutsch
Deutsch