Kolagen – Wikipedia, wolna encyklopedia

Kolagen – białko fibrylarne stanowiące główny składnik substancji międzykomórkowej organizmów zwierzęcych[1], nadające tkankom odporność na rozciąganie[2]. Występuje praktycznie we wszystkich tkankach zwierząt[3][4], pełniąc rolę głównego białka strukturalnego[3]. Wytrzymałość kolagenu związana jest z powtarzającymi się sekwencjami tripeptydowymi w trzech budujących go łańcuchach[5], dzięki czemu możliwe jest wzajemnie owinięcie się tych łańcuchów i powstanie długiej, potrójnej helisy (helisa kolagenowa)[6].
Kolagen nie stanowi pojedynczego białka o określonej strukturze[3], występuje wiele typów kolagenów wykazujących pewne różnice w cechach strukturalnych i funkcjonalnych[1], stąd mówi się o kolagenach jako rodzinie białek[3]. Wszystkie jednak zawierają przynajmniej jedną domenę z potrójną helisą oraz tworzą supramolekularne agregaty w substancji międzykomórkowej[7]. Typowo są nierozpuszczalnymi w wodzie pałeczkowatymi białkami włókienkowymi[3].
Kolagen jest najbardziej rozpowszechnionym białkiem zwierzęcym[4]. W organizmach kręgowców stanowi ok. 1/3 wszystkich białek[1]. Jest głównym białkiem w skórze, ścięgnach i kościach[8] – występuje tam najpowszechniejszy kolagen typu I. W chrząstce występuje kolagen typu II, a w błonie podstawnej – typu IV[2]. Kolagen jest budulcem kutykuli pierścienic. Występuje w mezoglei i tkankach parzydełkowców oraz u szkarłupni, stawonogów czy ramienionogów i innych bezkręgowców. Poza królestwem zwierząt kolagen stwierdzono u otwornic[9].
Kolagen wykorzystywany jest w przemyśle skórzanym, spożywczym, kosmetycznym, biotechnologicznym i farmaceutycznym[10].
Charakterystyka kolagenu w tkankach zwierzęcych
[edytuj | edytuj kod]Występowanie kolagenu bywa uznawane za charakterystyczną cechę wielokomórkowych organizmów zwierzęcych (od gąbek po człowieka)[11]. Kolagen jest głównym włóknistym składnikiem skóry, ścięgien, chrząstki, naczyń krwionośnych, kości i zębów[12]. W organizmach ssaków stanowi ok. 25% całkowitej masy białek[8]. W ścięgnach kolagen tworzy podłużne włókna, w skórze tworzy luźno utkaną sieć włókien[12]. Skóra garbowana w rzeczywistości jest wyprawionym kolagenem[8]. W zębach i kościach sieć włókien kolagenu podtrzymuje ich strukturę niczym pręty stalowe w zbrojonym betonie[5].
Kolagen nadaje tkankom odporność na rozciąganie – szacuje się, że włókno kolagenowe o średnicy 1 mm nie zerwie się w wyniku zawieszenia na nim ciężarka o masie 10 kg[13]. Natomiast odporność na ściskanie nadają wypełniające wolne przestrzenie w substancji międzykomórkowej proteoglikany złożone z rdzenia białkowego i glikozaminoglikanów (GAG)[14]. O ile w ścięgnach substancja międzykomórkowa składa się niemal wyłącznie z kolagenu (a w kościach z kolagenu i kryształów fosforanów wapnia), to przejrzysta substancja galaretowata wewnątrz oka zbudowana jest niemal wyłącznie z jednego typu GAG i wody, z niewielką ilością kolagenu. Substancja międzykomórkowa może też być bogata w kolagen i jednocześnie w GAG, co charakteryzuje sprężyste i amortyzujące uderzenia chrząstki[15].
Struktury te należą do tkanki łącznej, która ochrania narządy i zapewnia sprężystość, jeśli jest ona potrzebna[4]. Tkanka łączna od innych tkanek zwierzęcych wyróżnia się tym, że substancja międzykomórkowa jest w nich obfita i przenosi siły mechaniczne. Za ich wytrzymałość na rozciąganie odpowiada właśnie kolagen (dla porównania w strukturach roślinnych są to polisacharydy jak celuloza). W innych tkankach, np. w tkance nabłonkowej, substancja międzykomórkowa występuje w niewielkiej ilości, komórki są ze sobą połączone bezpośrednio i same przenoszą siły mechaniczne[16]. Zatem kolagen powstaje głównie w tkance łącznej[17].
Kolagen produkowany jest przede wszystkim w fibroblastach, a poza tym w chondroblastach, odontoblastach i osteoblastach[18]. Fibroblasty wydzielają także fibronektynę, glikoproteinę występującą w substancji pozakomórkowej i na powierzchni komórek. Wiąże ona agregujące włókna prokolagenowe i zmienia kinetykę tworzenia włókien[19]. Zawiera regiony wiążące kolagen, regiony wiążące proteoglikany oraz regiony wiążące specyficzne integryny występujące na powierzchni różnych typów komórek[20].
Kolageny w organizmach pełnią następujące funkcje:
- utrzymują strukturalną integralność tkanek i narządów
- uczestniczą w rozwoju narządów i naprawie tkanek
- biorą udział w procesie gojenia ran
- tworzą interakcje ze specyficznymi receptorami, wpływając na adhezję, różnicowanie, wzrost i przeżywalność komórek[1].
Typy i budowa kolagenu
[edytuj | edytuj kod]

Z ludzkich tkanek wyodrębniono ponad 28 typów kolagenu, które zbudowane są z ponad 30 różnych łańcuchów polipeptydowych, każdy kodowany przez osobny gen[21]. Wykazują one znaczącą różnorodność funkcjonalną i strukturalną[1]. Choć wiele z tych typów występuje w niewielkiej ilości w organizmie, to jednak mogą odgrywać ważną rolę w nadawaniu tkankom odpowiednich właściwości. Istnieje też wiele białek, które nie należą do kolagenów, jednak mają domeny przypominające strukturalnie kolagen, stąd nazywane bywają białkami kolagenopodobnymi[21].
Kolageny mogą być białkami zbudowanymi z trzech identycznych łańcuchów polipeptydowych (tzw. homotrimery) lub z różnych (heterotrimery). Przykładowo kolagen typu I jest heterotrimerem złożonym z dwóch łańcuchów α1(I) i jednego łańcucha α2(I) (gdzie liczba rzymska oznacza typ kolagenu). Kolagen typu II jest natomiast homotrimerem zbudowanym z trzech łańcuchów α1(II). Geny kodujące łańcuchy kolagenu mają w nazwie przedrostek COL, po nim typ kolagenu oznaczony cyfrą arabską, literę „A” i numer kodowanego łańcucha, np. za tworzenie łańcuchów kolagenu typu I odpowiedzialne są geny COL1A1 i COL1A2[22].
Kolageny można podzielić na dwie główne grupy – kolageny fibrylarne i kolageny niefibrylarne[1]. Kolageny fibrylarne są najczęściej spotykanym rodzajem. Mają łańcuchy polipeptydowe splecione w strukturę potrójnej helisy, które wynikają z długich, powtarzających się sekwencji aminokwasów (Gly-X-Y)n. W sekwencji tej w pozycji X często (choć nie zawsze) występuje prolina, a w pozycji Y – często hydroksyprolina[23]. Polipeptydowe łańcuchy kolagenu (nazywane α-łańcuchami)[13] zbudowane są z około 1000 reszt aminokwasowych, gdzie co trzecią resztą aminokwasową jest glicyna. W kolagenie ssaków około 100 pozycji X zajętych jest przez prolinę i około 100 pozycji Y przez 4-hydroksyprolinę. Na kilku pozycjach X znajduje się 3-hydroksyprolina (ale tylko w sąsiedztwie 4-hydroksyproliny). Poza tym 5–50 pozycji Y jest zajętych przez hydroksylizynę. Reszty hydroksylizynowe mogą tworzyć wiązania O-glikozylowe[24]. Kluczowa dla struktury jest glicyna (Gly) – co trzecia reszta aminokwasowa każdego polipeptydu wchodzi do środkowej części rdzenia potrójnej helisy i jedynie glicyna (jej reszta) jest na tyle małym aminokwasem, aby się tam zmieścić[23][25].
W uogólnionym składzie aminokwasowym kolagenu 33% to glicyna, 10% to prolina. Poza tym występują aminokwasy, których nie spotyka się w większości innych białek jak 4-hydroksyprolina (10%), 3-hydroksyprolina (<0,5%) i 5-hydroksylizyna (1%)[26]. Podobnie elastyna tworząca elastyczne włókna jest niestandardowo w porównaniu do innych białek bogata w glicynę i prolinę, ale w przeciwieństwie do kolagenu nie ulega glikozylacji[27].
Każdy z trzech łańcuchów występujących w kolagenie skręca się w helisę charakterystyczną dla kolagenu (tzw. helisa kolagenowa). Na pełny skręt takiej helisy przypada 3,3 reszt, tj. mniej niż dla helisy alfa (3,6 reszt). Łańcuchy ułożone są równolegle, owijają się jeden wokół drugiego[23]. Trzy takie łańcuchy, każdy lewoskrętny, skręcając się dodatkowo wokół wspólnej osi, tworzą prawoskrętną, rozciągniętą superhelisę[1][28]. Odwrotny kierunek skręcenia pojedynczych łańcuchów i potrójnej helisy sprawia, że struktura ta jest szczególnie odporna na odwijanie pod wpływem rozciągania[29].
Z takiej potrójnej helisy zbudowany jest tropokolagen, który jest podstawową jednostką strukturalną kolagenu[30]. Struktura ta utrzymywana jest przez sieć wiązań wodorowych, zwłaszcza między grupą aminową glicyny jednej helisy a grupą karboksylową proliny w pozycji X innej helisy[23]. Cząsteczki tropokolagenu (o średnicy 1,5 nm)[31] agregują we włókienka (fibryle)[32] (o średnicy 10–300 nm)[33], a w wyniku dojrzewania ulegają usieciowaniu poprzez wiązania poprzeczne, tworząc włókna kolagenu[32] (o średnicy 1–20 μm)[33].
W typowej fibryli cząsteczki tropokolagenu są względem siebie przesunięte o 67 nm[34] (64–67 nm)[35] (nieco mniej niż jedna czwarta długości)[33], a w jednym rzędzie są oddalone od siebie o 35 nm[34]. Taki układ w obrazie z mikroskopu elektronowego prowadzi do uwidocznienia regularnych prążków[33].
Kolageny niefibrylarne charakteryzują się brakiem ciągłości struktury helikalnej w wyniku braku ciągłości powtarzającej się sekwencji Gly-X-Y. Jej brak skutkuje wytworzeniem się fragmentów o strukturze globularnej (niekolagenowej). Kolageny niefibrylarne nie tworzą włókien, tworzą za to układy sieciowe. Do kolagenów niefibrylarnych można zaliczyć kolageny kotwiczące, transbłonowe, multipleksyny czy kolageny FACIT[1][36].
| Typ | Budowa | Występowanie | Inne cechy |
|---|---|---|---|
| Kolageny fibrylarne (włókniste) | |||
| I | [α1(I)]2[α2(I)] | skóra, ścięgna, więzadła, kości, zębina, inne tkanki łączne niebędące chrząstką | włókno o dł. 300 nm |
| II | [α1(II)]3 | chrząstki, ciało szkliste, jądro miażdżyste (w krążku międzykręgowym) | włókno o dł. 300 nm |
| III | [α1(III)]3 | rozciągliwe tkanki łączne jak skóra, mięśnie, układ naczyniowy; często razem z typem I | włókno o dł. 300 nm |
| V | [α1(V)]2[α2(V)], [α1(V)]3 | rogówka, zęby, kości, łożysko, skóra, mięśnie gładkie; często razem z typem I | włókno o dł. 390 nm, N-końcowy fragment globularny |
| Kolageny tworzące układy sieciowe | |||
| IV | [α1(IV)]2[α2(IV)] | wszystkie błony podstawne | |
| VIII | [α1(VIII)]3, [α2(VIII)]3, [α1(VIII)]2α2(VIII)[38] | śródbłonek, błona Descemeta | tworzy heksagonalne układy sieciowe |
| X | [α1(X)]3 | chrząstka hipertroficzna | tworzy heksagonalne układy sieciowe |
| Kolageny kotwiczące | |||
| VII | [α1(VII)]3 | półdesmosomy | najdłuższa domena trójhelikalna o dł. 420 nm |
| Kolageny towarzyszące włóknom o przerywanej strukturze helisowej (FACIT) | |||
| IX | [α1(IX)][α2(IX)][α3(IX)] | chrząstki, ciało szkliste; towarzyszy kolagenowi typu II | 3 krótkie domeny kolagenowe zawierające 4 regiony globularne[1] |
| XII | α1[XII]3[1] | towarzyszy kolagenowi typu I | |
| Kolageny transbłonowe | |||
| XIII | [α1(XIII)]3 | wiele tkanek, m.in. płytka nerwowo-mięśniowa | kolageny transbłonowe mają N-koniec zatopiony wewnątrz komórki i domenę hydrofobową przechodzącą przez dwuwarstwę lipidową błony[1] |
| XVII | [α1(XVII)]3 | nabłonek, hemidesmosomy | |
| Multipleksyny – kolageny o licznych nieciągłych domenach o budowie helikalnej | |||
| XV | [α1(XV)]3 | występuje w proteoglikanach, gdzie stanowi rdzeń białkowy połączony z siarczanem chondroityny; towarzyszy kolagenom błony podstawnej | stabilizuje mięśnie szkieletowe i mikronaczynia |
| XVIII | [α1(XVIII)]3 | towarzyszy kolagenom błony podstawnej | utrzymuje strukturalną integralność błony podstawnej; bliski homolog kolagenu typu XV |
Charakterystyczny motyw potrójnej helisy zidentyfikowano także w białkach wirusów, bakterii, grzybów, a także w pewnych białkach zwierzęcych, które nie należą do rodziny kolagenów (białka kolagenopodobne)[11]. Do takich kolagenopodobnych białek należą m.in. kolektyny, białko C1q układu dopełniacza, receptory zmiatacze klasy A[37].
Biosynteza kolagenu
[edytuj | edytuj kod]


W biosyntezie kolagenu można wyróżnić trzy główne etapy: syntezę na siateczce śródplazmatycznej szorstkiej (ER), potranslacyjną obróbkę w świetle ER oraz obróbkę pozakomórkową.
Polipeptydowe łańcuchy kolagenu zsyntetyzowane na siateczce śródplazmatycznej szorstkiej, podobnie większość innych białek, które mają być wydzielone, powstają w postaci prekursorowej jako cząsteczki preprokolagenu[39]. Preprokolagen zawiera sekwencję sygnałową, która kieruje łańcuch do cystern siateczki śródplazmatycznej w celu potranslacyjnej obróbki. W świetle ER następuje usunięcie peptydu sygnałowego (przez enzym peptydazę sygnałową, zmieniając tym samym preprokolagen w prokolagen), hydroksylacja reszt proliny i lizyny oraz glikozylacja w cząsteczce[39][40].
Hydroksylacja reszt proliny i lizyny zachodzi przy udziale enzymów:
- hydroksylazy lizyny – przekształca lizynę w sekwencjach X-Lys-Gly do 5-hydroksylizyny
- prolilo-4-hydroksylazy – zamienia prolinę w sekwencjach X-Pro-Gly do 4-hydroksyproliny
- prolilo-3-hydroksylazy – przekształca prolinę w sekwencjach Hyp-Pro-Gly do 3-hydroksyproliny[40].
Powyższe enzymy, hydroksylaza lizynowa i hydroksylaza prolinowa, mają w swoim centrum aktywnym jon Fe2+, poza tym wymagają kwasu askorbinowego (witaminy C), aby utrzymywać go w stanie zredukowanym, a substratami reakcji są tlen i α-ketoglutaran. Reakcja wygląda zatem następująco[41]:
prolina/lizyna + α-ketoglutaran + O2 → hydroksyprolina/hydroksylizyna + bursztynian + CO2.
Hydroksylowane aminokwasy stabilizują strukturę kolagenu poprzez tworzenie wiązań wodorowych[42], decydują o sztywności[25]. Niedobór witaminy C prowadzący do powstania mniejszej ilości takich hydroksylowanych aminokwasów skutkuje osłabieniem włókien kolagenu i wywołuje charakterystyczne objawy szkorbutu jak kruche naczynia krwionośne, nieprawidłowy rozwój kości, zaburzone gojenie się ran[42][43].
Niektóre reszty hydroksylizyny ulegają kolejnej modyfikacji potranslacyjnej – glikozylacji[25] – reszty cukrowe (zwykle tylko glukoza, galaktoza oraz budowane przez nie dwucukry) przyłączane są do nowo powstałych hydroksylowych reszt hydroksylizyny[23]. Taka glikozylacja nie zachodzi w innych białkach – tylko w kolagenie[25]. W zależności od tkanki udział wagowy cukrowców wynosi 0,4–12%[23].
Na tym etapie prokolagen ma dodatkowe reszty aminokwasowe (100–300)[42] o masie cząsteczkowej 20–35 kDa umieszczone na aminowym i karboksylowym końcu. Są to tzw. peptydy ekstensyjne[19] (zwane też telopeptydami)[44], których w dojrzałym kolagenie nie ma. Zawierają one reszty cysteinowe, z udziałem których tworzone są wewnątrz- i międzyłańcuchowe mostki dwusiarczkowe. Umożliwiają one odpowiednie ułożenie trzech łańcuchów polipeptydowych przy formowaniu się potrójnej helisy (bez udziału enzymów)[19].
Prokolagen jest transportowany do aparatu Golgiego, gdzie zachodzi ostateczna glikozylacja[40] – proces, w którym do niektórych reszt hydroksylizyny przyłączana jest galaktoza lub galaktozyloglukoza[25]. Następnie cząsteczki prokolagenu są pakowane do pęcherzyków transportowych i wydzielane poza komórkę[40]. Poza komórką w wyniku działania aminoproteinazy prokolagenowej i karboksypeptydazy prokolagenowej zostają odłączone peptydy ekstensyjne, w wyniku czego powstaje tropokolagen[19].
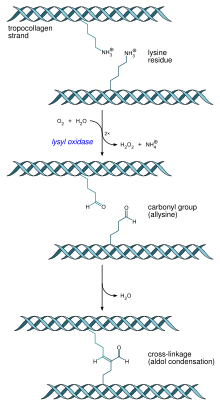
Trójhelikalne cząsteczki tropokolagenu ulegają spontanicznej agregacji w przesuniętym ustawieniu głową do ogona, która prowadzi do powstania włókienek kolagenowych[19][45]. Z czasem w wyniku dojrzewania kolagenu następuje wytworzenie kowalencyjnych wiązań poprzecznych wewnątrz cząsteczek tropokolagenu i pomiędzy nimi, co zwiększa wytrzymałość i sztywność struktury[45][40]. Mówi się wówczas już nie o włókienkach, a o włóknach kolagenowych[46][47]. Te poprzeczne wiązania nie są wiązaniami dwusiarczkowymi, jakie często występują w innych białkach, ale są utworzone między lizyną a jej aldehydową pochodną allizyną przy udziale enzymu oksydazy lizynowej. Enzym ten zawiera miedź i do działania wymaga obecności fosforanu pirydoksalu (witaminy B6)[45].
Synteza kolagenu jest stymulowana przez uszkodzenie tkanek – fibroblasty migrują do miejsca rany, gdzie wytwarza się tkanka bliznowata złożona głównie z kolagenu. Podobnie miejsca po śmierci komórek miąższowych są wypełniane przez tkankę łączną bogatą w kolagen, np. przy zwłóknieniu wątroby[48].
Okres półtrwania kolagenu wynosi do kilku miesięcy. Rozpad kolagenu (i zastępowanie go nowym) występuje podczas normalnego rozwoju i wzrostu, a także przy naprawie tkanek[49] – w przestrzeni zewnątrzkomórkowej jest nieustannie syntetyzowany i rozkładany. Potrójne helisy są odporne na działanie proteaz takich jak np. pepsyna, trypsyna, chymotrypsyna[1]. Degradacja następuje z udziałem kolagenaz – pozakomórkowych proteinaz zawierających cynk[49] (metaloproteinazy macierzy zewnątrzkomórkowej[1] – MMP-1, MMP-8, MMP-13)[34], które przecinają wiązanie Gly-Ile w każdej z trzech nici tropokolagenowych. Wówczas białko to spontanicznie denaturuje się i jest podatne na działanie kilku wewnątrzkomórkowych proteaz (np. katepsyn). Komórki nowotworowe mogą mieć zdolność wytwarzania kolagenaz, które ułatwiają im wzrost i rozsiew[49]. Kolagenazy biorą także udział podczas zapalenia stawów w rozkładzie chrząstki[31].
Konsekwencje nieprawidłowej budowy kolagenu
[edytuj | edytuj kod]Nieprawidłowości w genach kodujących kolagen czy w potranslacyjnej modyfikacji kolagenu (np. ze względu na brak kofaktorów niezbędnych dla działania enzymów) skutkują chorobami związanymi z nieprawidłową budową tego białka w organizmie, a przez to brakiem odpowiedniej wytrzymałości[50]. Do takich chorób zalicza się m.in.:
- zespół Ehlersa-Danlosa związany z nadmierną rozciągliwością skóry, podatnością tkanek na urazy i zwiększoną ruchomością stawów
- zespół Alporta związany z nieprawidłowościami w błonie podstawnej
- epidermoliza pęcherzowa związana z pękaniem skóry i tworzenie się pęcherzy nawet w wyniku niewielkich urazów[51]
- łamliwość kości[48]
- szkorbut wynikający z niedoboru witaminy C (kwasu askorbinowego), która jest kofaktorem w reakcjach hydroksylacji proliny i lizyny[52]
Do innych nieprawidłowości należy latyryzm związany ze spożyciem nasion groszku pachnącego zawierających β-aminopropionitryl. Związek ten nieodwracalnie hamuje aktywność oksydazy lizynowej, zaburzając tworzenie poprzecznych wiązań w kolagenie[45].
| Typ kolagenu | Powiązane choroby w przypadku nieprawidłowości | Odpowiedzialne geny lub inne czynniki |
|---|---|---|
| I | łamliwość kości (osteogenesis imperfecta), zespół Ehlersa-Danlosa typu VII (postać stawowa) | COL1A1, COL1A2 |
| II | dysplazje kręgosłupowo-nasadowe, achondrogeneza, hipochondrogeneza, dysplazja Kniesta, zespół Sticklera | COL2A1 |
| III | zespół Ehlersa-Danlosa typu IV (postać naczyniowa) | COL3A1 |
| IV | dziedziczna angiopatia z zespołem nefropatii, tętniaków i skurczów mięśni (HANAC) | COL4A1 |
| zespół Alporta | COL4A3, COL4A4, COL4A5 | |
| zespół Goodpasture’a | autoimmunologiczny | |
| V | zespół Ehlersa-Danlosa typu I i II (postać klasyczna) | COL5A1, COL5A2 |
| VIII | dystrofie śródbłonka rogówki | COL8A2 |
| IX | dysplazja wielonasadowa | COL9A1, COL9A2 |
| zespół Sticklera | COL9A1 | |
| X | chondrodysplazja przynasadowa typu Schmida | COL10A1 |
| XVII | pęcherzowe oddzielanie się naskórka w obrębie błony podstawnej | COL17A1 |
| pemfigoid pęcherzowy | autoimmunologiczny | |
| XVIII | zespół Knoblocha | COL18A1 |
Kolagen w sztuce kulinarnej
[edytuj | edytuj kod]Słowo kolagen pochodzi z języka greckiego κόλλα/kolla – klej i γεννάω/gennáo – rodzić[53]. Nazwa nawiązuje do tego, że gotując kości i skóry zawierające kolagen można go rozłożyć i otrzymać lepką mieszaninę zawierającą żelatynę, której można użyć jako klej[54]. W kontekście żywności kolagen jest to produkt na bazie białka pochodzący ze zwierzęcych kości, skór, skórek i ścięgien, natomiast żelatyna to naturalne rozpuszczalne białko, żelujące lub nieżelujące, uzyskane w wyniku częściowej hydrolizy takiego kolagenu[55].
Kolagen w stanie natywnym posiada znaczną zdolność wiązania i utrzymywania wody; obniża ją dodatek chlorku sodu (soli kuchennej)[10].
W przemyśle spożywczym kolagen może być używany do poprawienia elastyczności, stabilności i konsystencji produktu[56], do modyfikacji parametrów reologicznych[10]. Stosowany jest jako dodatek do żywności w produkcji kiełbas, można z niego tworzyć jadalne błony, np. jako osłonki do kiełbas. Źródłem komercyjnego kolagenu są skóry i kości niektórych kręgowców, przede wszystkim świń i bydła[56]; tworzy się z niego żelatynę metodami chemiczno-termicznymi[10].
Rozmieszczenie kolagenu w mięsie
[edytuj | edytuj kod]

Kolagen to główny składnik śródmięśniowej tkanki łącznej, która stanowi ok. 2–6% całkowitej zawartości białek w mięsie. Gruba, odporna na rozciąganie tkanka łączna otaczająca mięśnie szkieletowe nazywana jest omięsną zewnętrzną (epimysium)[53]. Włókna mięśniowe skupione w małe pęczki (wiązki) otoczone są przez pierwotną omięsną wewnętrzną (primary perimysium) i zebrane w większe pęczki wtórne otoczone grubszą omięsną wewnętrzną wtórną (secondary perimysium). Grubość warstw omięsnej wewnętrznej jest zależna od rodzaju mięśni, gatunku i rasy zwierzęcia oraz jego wieku. Pojedyncze włókna mięśni są otoczone cienką śródmięsną (endomysium)[53].
Omięsne tworzą sieć kolagenu i elastyny w mięśniach, śródmięśniową tkankę łączną, która istotnie wpływa na teksturę mięsa. Kruchość mięsa generalnie zależy od zawartości, składu i struktury śródmięśniowej tkanki łącznej, jak również od stopnia poubojowej degradacji miofibryli i cytoszkieletowych włókien mięśniowych. Proteoliza białek podczas poubojowego dojrzewania mięsa sprzyja nabieraniu kruchości. Objawem tej proteolizy jest zwiększająca się rozpuszczalność rozpadającego się kolagenu[53].
Duża zawartość kolagenu w mięsie obniża jego kruchość, strawność i zmniejsza wartość odżywczą. Kolagen nie jest białkiem pełnowartościowym ze względu na to, że nie zawiera tryptofanu oraz ma niską zawartość aminokwasów siarkowych i aromatycznych[53].
Z wiekiem zwierzęcia rośnie udział kolagenu w składzie białek mięsa, a co więcej, zwiększa się w nim liczba wiązań poprzecznych. To dlatego mięso młodych zwierząt jest delikatniejsze i mniej „żylaste”[57]. Przykładowo 20-dniowy kurczak ma 12% mniej całkowitego kolagenu, a w nim 12 razy mniej wiązań poprzecznych w porównaniu do kurczaka półtorarocznego[58].
Obróbka cieplna kolagenu i poprawa kruchości mięsa
[edytuj | edytuj kod]Długa, powolna obróbka cieplna mięsa przy obecności wody (jak np. przy duszeniu) powoduje rozpad bądź rozpuszczenie kolagenu, zamieniając go w żelatynę. Niezbędna woda jest obecna w surowym mięsie, w tkance mięśniowej, ale długotrwała obróbka cieplna na sucho stwarza ryzyko wyparowania nadmiernej ilości wody i wysuszenia mięsa. W przemianie kolagenu pomagają kwasy pochodzące np. z marynaty, dodanych pomidorów czy wina, oraz enzymy, zarówno naturalnie występujące w mięsie, jak i dodane (np. papaina)[59].
Sucha obróbka cieplna (np. grillowanie) nadaje się bardziej dla kawałków mięsa o dobrej kruchości, powinna być krótka, w przeciwnym razie mięso może stać się suche, chyba że pieczony kawał jest duży[60]. Przy mokrej, długotrwałej obróbce usuwanie kolagenowych ścięgien nie jest konieczne[61]; tworząca się z kolagenu żelatyna jest pożądana, nadaje odpowiednią teksturę i utrzymuje wilgotność mięsa[62]. W przypadku suchej obróbki mięso zawierające dużo kolagenu (który nie zdąży się rozłożyć) może być nieprzyjemnie gumowate i zdeformowane[61]. Wynika to z faktu, że wraz ze wzrostem dostarczanej energii kolagen kurczy się nawet do 1/3, 1/4 początkowej długości[62], wyciskając z mięsa wodę (i pozbawiając je pożądanej soczystości)[63]. Najlepsi kucharze zajmujący się grillowaniem potrafią zastosować powolną obróbkę cieplną, zachowując jednocześnie jak najwięcej soków w mięsie[63].
W wielu przepisach poleca się po obróbce cieplnej odstawić mięso na kilka–kilkanaście minut. Pozwala to na zatrzymanie większej ilości soków między włóknami przez odtwarzanie się wiązań wodorowych[63].
Można uogólnić, że kolagen zaczyna denaturować w temperaturze 52 °C, kurczyć się przy 58 °C, a przy 68 °C rozpada się, przekształcając w rozpuszczalną żelatynę[64]. Przykładowo w temperaturze ok. 71 °C (panującej we wnętrzu mięsa) cały kolagen wołowy będzie zdenaturowany i przekształcony w żelatynę, a przy temperaturze 74–77 °C panującej we wnętrzu mocno wysmażonych steków (well done) mięso będzie pozbawione większości wody, wszystkie białka będą zdenaturowane, a cała mioglobina przekształcona w brązowy hemichrom[65].
Mięso ryb zawiera znacznie mniej kolagenu niż wołowina czy wieprzowina i ma on dodatkowo mniej wiązań poprzecznych. Ponadto pewne różnice w składzie aminokwasowym przyczyniają się do faktu, że rybi kolagen denaturuje i rozpuszcza się w niższych temperaturach w porównaniu do kolagenu zwierząt lądowych[58]. Sporo kolagenu znajduje się za to w kałamarnicach i ośmiornicach – ich obróbka polega na ich szybkim usmażeniu, aby zachować białka w natywnej formie lub na długim ogrzewaniu, aby doszło do rozpadu kolagenu. W innym przypadku mięso będzie gumowate w teksturze[62].
Kości na zupę są często gotowane na wolnym ogniu, aby przekształcić kolagen w żelatynę i wytworzyć bazę dla zup, nadając nieco gęstości[63]. Kolagen może również zagęszczać sosy[64].
Elastyna z kolei nie ulega rozkładowi podczas obróbki kulinarnej, a jej udział zwiększa się w mięsie starszych zwierząt. W celu poprawienia kruchości mięsa odcina się ścięgna oraz mechanicznie rozbija włókna poprzez jego tłuczenie, krojenie w kostkę, krojenie w plastry w poprzek włókien czy mielenie[59].
Kolagen w garbarstwie
[edytuj | edytuj kod]
Skóra jako surowiec to wyprawiona powłoka ciała (skóra) kręgowców uzyskiwana przez chemiczną stabilizację włóknistego kolagenu, jej głównego składnika[66]. Od dziesiątków lat najczęściej stosuje się sole chromowe. Polega to na sieciowaniu garbnika (chromu) z wolnymi grupami karboksylowymi aminokwasów budujących kolagen w skórze. Ze względu jednak na niekorzystne oddziaływanie na środowisko odpadów przemysłu garbarskiego i zużytych skór powstałych w taki sposób szuka się alternatywnych środków garbujących zapewniających pożądane właściwości[67][68].
Kolagen w medycynie i kosmetyce
[edytuj | edytuj kod]
Ze względu na swoje specyficzne właściwości, nietoksyczność i biozgodność kolagen jest stosowany w medycynie i kosmetyce[69].
W kosmetyce i medycynie estetycznej preparaty kolagenowe można podzielić na trzy główne kategorie:
- preparaty przeznaczone do zastosowania na skórę w postaci kremów, żeli, masek
- nutraceutyki, tj. stosowane doustnie suplementy diety zawierające kolagen lub jego hydrolizaty
- wypełniacze tkankowe stosowane w postaci iniekcji[69].
Kolagen nie wchłania się przez skórę, nie ma możliwości przejścia przez nabłonek. W przypadku zaaplikowania preparatu na skórę kolagen może tworzyć na jej powierzchni hydrofilową błonę, która zapobiega transepidermalnej utracie wody[69].
Doustne preparaty zawierające kolagen lub hydrolizaty kolagenu stosowane są przede wszystkim w celu profilaktyki chorób związanych ze zmianami w tkance łącznej (zwłaszcza chrzęstno-stawowej) oraz w celach kosmetycznych dla poprawy wyglądu skóry. Skuteczność ich jest jednak słabo zbadana[69]. Istnieją doniesienia, że spożywane preparaty z peptydami kolagenowymi mogą poprawić poziom nawilżenia skóry[70], a także zredukować dolegliwości w stawach wynikające z intensywnego uprawiania sportu przez młodych dorosłych[71].
Kolagen wykorzystuje się w medycynie estetycznej jako wypełniacz w celu wyrównania powierzchni skóry w miejscu zmarszczek czy zanikowych blizn oraz modelowania owalu twarzy i ust[69]. Jest jedną z pierwszych substancji używanych w tym celu (ustępując tylko tłuszczowi)[72]. Zabiegi z jego użyciem wykonuje się od początków lat 80. XX w.[69] Można rozróżnić wypełniacze syntetyczne i naturalne, a wśród tych drugich – ksenogeniczne (z tkanek zwierzęcych, zwykle bydlęcych), allogeniczne (z tkanek innych, zmarłych ludzi) lub autogeniczne (z tkanek własnych). Preparaty kolagenowe różnią się między sobą prawdopodobieństwem wywołania alergii, część z nich wymaga wykonania testów alergicznych przed zastosowaniem; w przypadku stosowania kolagenu bydlęcego – dwukrotnego testu skórnego[69].
Stosowanie wypełniaczy kolagenowych może wywołać pewne działania niepożądane, które można podzielić na reakcje wczesne i opóźnione. Do wczesnych zalicza się m.in. obrzęk, ból, świąd, zasinienie, twarde guzki, infekcje. Do opóźnionych obrzęk, ból, guzki, tworzenie ziarniaków, ropnie jałowe, blizny[69][72]. Obecnie pochodne kwasu hialuronowego stały się bardziej popularne od kolagenu ze względu na mniejsze ryzyko wystąpienia nadwrażliwości i brak konieczności wykonywania uprzednich testów skórnych oraz dłużej utrzymujący się efekt[72]. W przypadku kolagenu efekt wypełnienia utrzymuje się zwykle od 3 do kilkunastu miesięcy[69][72].
Jako biomateriał w medycynie stosuje się zwykle kolagen w formie atelokolagenu (pochodna kolagenu typu I z odciętymi peptydami ekstensyjnymi odpowiedzialnymi w głównej mierze za immunogenność białka)[69]. Ma zastosowanie w medycynie regeneracyjnej i inżynierii tkankowej. Wykorzystuje się go m.in. w produkcji implantów, błon zaporowych w celu regeneracji tkanek i kości oraz zamykania połączeń ustno-zatokowych po usunięciu zęba. Znajduje zastosowanie w systemach dostarczania leków (DDS). Biomateriały kolagenowe mogą być pomocne m.in. w leczeniu uszkodzeń rogówki i schorzeń układu moczowo-płciowego[69].
Uwagi
[edytuj | edytuj kod]- ↑ W tytule dzieła zastosowano grę słów: unravel oznacza zarówno „rozplatać”, jak i „rozwikłać zagadkę”.
Przypisy
[edytuj | edytuj kod]- ↑ a b c d e f g h i j k l m n Kamila A. Czubak, Halina M. Żbikowska, Struktura, funkcja i znaczenie biomedyczne kolagenów, „Annales Academiae Medicae Silesiensis”, 68 (4), 2014, s. 245–254.
- ↑ a b Alberts 2015 ↓, s. G:7.
- ↑ a b c d e Davidson i Sittman 2002 ↓, s. 49.
- ↑ a b c Harper 2018 ↓, s. 800.
- ↑ a b Harper 2018 ↓, s. 54.
- ↑ Alberts 2016 ↓, s. 141.
- ↑ Jean-Yves Exposito, Collagens, [w:] Jerry L. Atwood, Jonathan W. Steed (red.), Encyclopedia of Supramolecular Chemistry, CRC Press, 2004, s. 295–296, DOI: 10.1201/9780429075728, ISBN 978-0-8247-5056-5 (ang.).
- ↑ a b c Alberts 2016 ↓, s. 704.
- ↑ Kenneth M. Towe, Oxygen-Collagen Priority and the Early Metazoan Fossil Record, „Proceedings of the National Academy of Sciences of the United States of America”, 65 (4), 1970, s. 781-788, DOI: 10.1073/pnas.65.4.781 (ang.).
- ↑ a b c d Grażyna Krasnowska, Charakterystyka i wykorzystanie białek kolagenowych, „Medycyna Wet.”, 61 (3), 2005, s. 271–274.
- ↑ a b Jean-Yves Exposito i inni, The Fibrillar Collagen Family, „International Journal of Molecular Sciences” (11), 2010, s. 407–426, DOI: 10.3390/ijms11020407 (ang.).
- ↑ a b Hames i Hooper 2002 ↓, s. 53.
- ↑ a b Gerald Karp, Cell and Molacular Biology, Wiley, 2010, s. 232–234, ISBN 978-0-470-48337-4.
- ↑ Alberts 2016 ↓, s. 706.
- ↑ Alberts 2016 ↓, s. 704–708.
- ↑ Alberts 2016 ↓, s. 703–704.
- ↑ Alberts 2015 ↓, s. 1061.
- ↑ a b c Jasvir Kaur, Dieter P. Reinhardt, Extracellular Matrix (ECM) Molecules, [w:] Ajaykumar Vishwakarma i inni red., Stem Cell Biology and Tissue Engineering in Dental Sciences, Elsevier, 2015, s. 27, 30–33, ISBN 978-0-12-397157-9.
- ↑ a b c d e Harper 2018 ↓, s. 803.
- ↑ Alberts 2015 ↓, s. 1067.
- ↑ a b Harper 2018 ↓, s. 800–801.
- ↑ Harper 2018 ↓, s. 804.
- ↑ a b c d e f Hames i Hooper 2002 ↓, s. 55–56.
- ↑ N.V. Bhagavan, Chung-Eun Ha, Connective Tissue: Fibrous and Nonfibrous Proteins and Proteoglycans, [w:] N.V. Bhagavan, Chung-Eun Ha (red.), Essentials of Medical Biochemistry, Academic Press, 2015, s. 120–122, ISBN 978-0-12-416687-5.
- ↑ a b c d e Harper 2018 ↓, s. 801.
- ↑ Puri 2011 ↓, s. 77.
- ↑ Alberts 2015 ↓, s. 1065.
- ↑ G. Schoukens, Bioactive dressings to promote wound healing, [w:] S. Rajendran (red.), Advanced Textiles for Wound Care, Woodhead Publishing, 2009, s. 114–152, ISBN 978-1-84569-271-1.
- ↑ Puri 2011 ↓, s. 76.
- ↑ Davidson i Sittman 2002 ↓, s. 50.
- ↑ a b Alberts 2016 ↓, s. 705.
- ↑ a b Hames i Hooper 2002 ↓, s. 54.
- ↑ a b c d e Harper 2018 ↓, s. 801–802.
- ↑ a b c Monika Morąg, Agnieszka Burza, Budowa, właściwości i funkcje kolagenu oraz elastyny w skórze, „Journal of Health Study and Medicine” (2), 2017, s. 77–100.
- ↑ D.J.S. Hulmes, Collagen diversity, synthesis and assembly, [w:] Peter Fratzl (red.), Collagen: Structure and Mechanics, Springer, 2008, s. 16, ISBN 978-0-387-73905-2.
- ↑ Harper 2018 ↓, s. 802–803.
- ↑ a b Harvey Lodish i inni, Molecular Cell Biology, W. H. Freeman and Company, 2016, s. 948, ISBN 978-1-4641-8339-3.
- ↑ Sylvie Ricard-Blum, The Collagen Family, „Cold Spring Harb Perspect Biol.”, 3 (1), 2011, DOI: 10.1101/cshperspect.a004978 (ang.).
- ↑ a b Harper 2018 ↓, s. 800–803.
- ↑ a b c d e Davidson i Sittman 2002 ↓, s. 50–53.
- ↑ Hames i Hooper 2002 ↓, s. 54–55.
- ↑ a b c Puri 2011 ↓, s. 78–79.
- ↑ Davidson i Sittman 2002 ↓, s. 53–55.
- ↑ Hames i Hooper 2002 ↓, s. 57.
- ↑ a b c d Hames i Hooper 2002 ↓, s. 58.
- ↑ Abraham L. Kierszenbaum, Laura L. Tres, Histology and Cell Biology. An Introduction to Pathology, Elsevier, 2020, s. 141, ISBN 978-0-323-67321-1.
- ↑ Davidson i Sittman 2002 ↓, s. 52–53.
- ↑ a b Puri 2011 ↓, s. 81–82.
- ↑ a b c Puri 2011 ↓, s. 79–80.
- ↑ Puri 2011 ↓, s. 80.
- ↑ Harper 2018 ↓, s. 804–805.
- ↑ Davidson i Sittman 2002 ↓, s. 53–54.
- ↑ a b c d e Bogdan Janicki, Mateusz Buzała, Wpływ kolagenu na jakość technologiczną mięsa, „Żywność. Nauka. Technologia. Jakość”, 2 (87), 2013, s. 19–29.
- ↑ Alfons T.L. Van Lommel, Tissues, [w:] From Cells to Organs: A Histology Textbook and Atlas, Springer, 2003, s. 59–122, DOI: 10.1007/978-1-4615-0353-8, ISBN 978-1-4613-5035-4 (ang.), patrz s. 76.
- ↑ Rozporządzenie (WE) nr 853/2004 Parlamentu Europejskiego i Rady z dnia 29 kwietnia 2004 r. ustanawiające szczególne przepisy dotyczące higieny w odniesieniu do żywności pochodzenia zwierzęcego (CELEX: 32004R0853).
- ↑ a b P. Hashim i inni, Collagen in food and beverage industries, „International Food Research Journal”, 22 (1), 2015, s. 1–8.
- ↑ Puri 2011 ↓, s. 81-82.
- ↑ a b Provost 2016 ↓, s. 282–283.
- ↑ a b Gisslen 2015 ↓, s. 453–454.
- ↑ Gisslen 2015 ↓, s. 470.
- ↑ a b Gisslen 2015 ↓, s. 365.
- ↑ a b c Jeff Potter, Gotowanie dla geeków, wyd. II, Gliwice: Helion, 2019, s. 196–197, ISBN 978-83-283-4992-6.
- ↑ a b c d Provost 2016 ↓, s. 302.
- ↑ a b Stuart Farrimond, The Science of Cooking, Penguin Random House (DK), 2017, s. 54–55, 60–61, ISBN 978-1-4654-6369-2.
- ↑ Provost 2016 ↓, s. 300–301.
- ↑ B.M. Haines, J.R. Barlow, The anatomy of leather, „Journal of Materials Science”, 10, 1975, s. 525–538, DOI: 10.1007/BF00543698 (ang.).
- ↑ Ammar Malek i inni, Chemical Transformation of Chromedleather Wastes Into Environmentally Harmless Fibrous Biomass, „Environment Protection Engineering”, 42 (3), 2016, s. 179–192, DOI: 10.5277/epe160314 [dostęp 2022-06-07] (ang.).
- ↑ Krzysztof Śmiechowski i inni, Wpływ zagarbowania bezchromowego na właściwości skór, „Przegląd Włókienniczy - Włókno, Odzież, Skóra” (8), 2017, s. 179–192, DOI: 10.15199/60.2017.08.2.
- ↑ a b c d e f g h i j k Dorota Żelaszczyk, Anna Waszkielewicz, Henryk Marona, Kolagen – struktura oraz zastosowanie w kosmetologii i medycynie estetycznej, „Estetologia Medyczna i Kosmetologia”, 2 (1), 2012, s. 14–20, DOI: 10.14320/EMK.2012.003.
- ↑ Jérome Asserin i inni, The effect of oral collagen peptide supplementation on skin moisture and the dermal collagen network: evidence from an ex vivo model and randomized, placebo‐controlled clinical trials, „Journal of Cosmetic Dermatology”, 14 (4), 2015, s. 291–301, DOI: 10.1111/jocd.12174 (ang.).
- ↑ Denise Zdzieblik i inni, Improvement of activity-related knee joint discomfort following supplementation of specific collagen peptides, „Applied Physiology, Nutrition, and Metabolism” (42), 2017, s. 588–595, DOI: 10.1139/apnm-2016-0390 (ang.).
- ↑ a b c d Kimberly Cockerham, Victoria J. Hsu, Collagen-Based Dermal Fillers: Past, Present, Future, „Facial Plastic Surgery”, 25 (2), 2009, s. 106–113, DOI: 10.1055/s-0029-1220650 (ang.).
Bibliografia
[edytuj | edytuj kod]- Bruce Alberts i inni, Molecular Biology of the Cell, wyd. VI, Garland Science, 2015, ISBN 978-0-8153-4464-3.
- Bruce Alberts i inni, Podstawy biologii komórki, wyd. II, Warszawa: Wydawnictwo Naukowe PWN, 2016, ISBN 978-83-01-14470-8.
- Victor L. Davidson, Donald B. Sittman, Biochemia, Wrocław: Urban & Partner, 2002, ISBN 83-87944-33-5.
- Wayne Gisslen, Professional Cooking, wyd. VIII, Wiley, 2015, ISBN 978-1-118-63672-5.
- David B. Hames, Nigel M. Hooper, Biochemia. Krótkie wykłady, wyd. II, Warszawa: Wydawnictwo Naukowe PWN, 2002, ISBN 83-01-13872-6.
- Joseph J. Provost i inni, The Science of Cooking. Understanding the Biology and Chemistry Behind Food and Cooking, Wiley, 2016, ISBN 978-1-119-21032-0.
- Dinesh Puri, Textbook of Medical Biochemistry, wyd. III, Elsevier, 2011, ISBN 978-81-312-2312-3.
- Victor W. Rodwell i inni, Biochemia Harpera, wyd. VII, Warszawa: PZWL Wydawnictwo Lekarskie, 2018, ISBN 978-83-200-5410-1.


 French
French Deutsch
Deutsch