Trichlorek fosforylu – Wikipedia, wolna encyklopedia
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||
| Wzór sumaryczny | POCl3 | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 153,33 g/mol | ||||||||||||||||||||||||||||
| Wygląd | bezbarwna ciecz[1] | ||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||
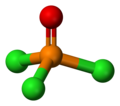
Trichlorek fosforylu, POCl
3 – nieorganiczny związek chemiczny z grupy chlorków kwasowych, zawierający grupę fosforylową P=O oraz trzy atomy chloru przyłączone do atomu fosforu.
Przemysłowo jest otrzymywany z trichlorku fosforu i tlenu lub pięciotlenku fosforu. Znajduje zastosowanie jako surowiec do otrzymywania fosforanów organicznych, katalizatorów, plastyfikatorów, środków chlorujących.
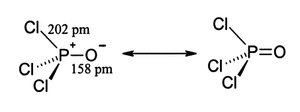
Budowa
[edytuj | edytuj kod]Podobnie jak fosforany, cząsteczka tego związku ma kształt tetraedru. Występują w niej trzy wiązania pojedyncze P−Cl oraz bardzo silne wiązanie podwójne P=O z szacowaną energią dysocjacji około 533,5 kJ/mol.
Własności chemiczne
[edytuj | edytuj kod]Chlorek fosforylu to bezbarwna ciecz, dymiąca na powietrzu wskutek hydrolizy, powodującej powstanie kwasu fosforowego i duszących oparów kwasu solnego. Reaguje z wodą i alkoholami dając odpowiednio kwas fosforowy lub jego estry:
- O=PCl
3 + 3H
2O → O=P(OH)
3 + 3HCl - O=PCl
3 + 3ROH → O=P(OR)
3 + 3HCl - ROH oznacza alkohol
Reakcje te często prowadzi się w obecności pirydyny lub amin neutralizujących wydzielający się chlorowodór.
Ogrzewanie z nadmiarem fenoli w obecności katalizatora będącego kwasem Lewisa, na przykład chlorku magnezu, daje fosforany triarylowe:
- 3ArOH + O=PCl
3 → O=P(OAr)
3 + 3HCl
Związek może również działać jako zasada Lewisa, tworząc addukty z kwasami Lewisa, jak na przykład z tetrachlorkiem tytanu:
- Cl
3P+
−O−
+ TiCl
4 → Cl
3P+
−O−
−TiCl
4
Addukt z chlorkiem glinu (POCl
3·AlCl
3) jest bardzo stabilny, w związku z tym POCl
3 można używać do dokładnego usuwania AlCl
3 ze środowiska reakcji Friedla-Craftsa. POCl
3 reaguje w obecności AlCl
3 z bromowodorem dając POBr
3.
Otrzymywanie
[edytuj | edytuj kod]Związek można wytworzyć w reakcji trichlorku fosforu z tlenem w temperaturze od 20 do 25 °C (użycie powietrza nie jest skuteczne):
- 2PCl
3 + O
2 → 2O=PCl
3
Inną metodą syntezy jest reakcja pentachlorku fosforu (PCl
5) i dekatlenku tetrafosforu (P
4O
10). Ponieważ oba te związki są ciałami stałymi, reakcję przeprowadza się przez chlorowanie mieszaniny ciekłego PCl
3 z P
4O
10. Powoduje to powstanie PCl
5 in situ. W miarę zużywania PCl
3 rozpuszczalnikiem staje się wytworzony POCl
3:
- 6PCl
3 + 6Cl
2 → 6PCl
5 - 6PCl
5 + P
4O
10 → 10POCl
3
Obie te metody są stosowane przemysłowo[8].
Chlorek fosforu(V) w reakcji z jednym ekwiwalentem wody również daje POCl
3, ale reakcję tę jest trudniej kontrolować, gdyż POCl
3 może ulegać dalszej reakcji z wodą, zgodnie z dwuetapowym mechanizmem hydrolizy PCl
5[9]:
- PCl
5 + H
2O → POCl
3 + 2HCl - POCl
3 + 3H
2O → H
3PO
4 + 3HCl
Zastosowanie
[edytuj | edytuj kod]Najważniejszym zastosowaniem tego związku jest wytwarzanie triarylowych fosforanów takich, jak fosforan trifenylu OP(OC
6H
5)
3 i trikrezolu OP(OC
6H
4CH
3)
3. Używane są one jako plastyfikatory PCW oraz substancje nadające ogniotrwałość. Fosforany trialkilowe, jak fosforan tributylu, są stosowane jako rozpuszczalniki w ekstrakcji ciecz-ciecz w przerobie zużytego paliwa jądrowego.
Przypisy
[edytuj | edytuj kod]- ↑ a b c d e f Haynes 2016 ↓, s. 4-78.
- ↑ a b c Haynes 2016 ↓, s. 6-193.
- ↑ Haynes 2016 ↓, s. 15-19.
- ↑ a b Haynes 2016 ↓, s. 6-120.
- ↑ Haynes 2016 ↓, s. 9-65.
- ↑ Trichlorek fosforylu, [w:] Classification and Labelling Inventory, Europejska Agencja Chemikaliów [dostęp 2017-08-29] (ang.).
- ↑ Phosphorus oxychloride, [w:] ChemIDplus [online], United States National Library of Medicine [dostęp 2017-08-29] (ang.).
- ↑ Fabien Caillé, Phosphorus Oxychloride, „Synlett”, 10, 2011, s. 1477–1478, DOI: 10.1055/s-0030-1260574 (ang.).
- ↑ Philip John Durrant, Bryl Durrant, Zarys współczesnej chemii nieorganicznej, Warszawa: Państwowe Wydawnictwo Naukowe, 1965, s. 834.
Bibliografia
[edytuj | edytuj kod]- CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, ISBN 978-1-4987-5429-3 (ang.).


 French
French Deutsch
Deutsch